Frontiers in Neurology
- Introduzione
- Metodi
- Soggetti
- Studi di conduzione nervosa
- Ultrasuoni
- Statistiche
- Risultati
- Caratteristiche cliniche
- Area della sezione trasversale (CSA)
- Correlazione tra maxCSA e il punteggio Sum (MRC) del Medical Research Council
- Correlazione di CSA e CB
- Discussione
- Limitazioni
- Dichiarazione sulla disponibilità dei dati
- Dichiarazione etica
- Contributi dell’autore
- Conflitto di interessi
- Riconoscimenti
- Materiale supplementare
- Abbreviazioni
Introduzione
La neuropatia motoria multifocale (MMN) è stata descritta per la prima volta nel 1988 (1) come una neuropatia puramente motoria che colpisce più nervi motori con blocco di conduzione (CB). Il CB del motore è il segno distintivo elettrofisiologico del centro per la diagnosi di MMN. L’ecografia nervosa può fornire le caratteristiche morfologiche dei nervi periferici. L’allargamento multifocale dei nervi periferici o delle radici cervicali nelle aree della sezione trasversale nervosa (CSAS) è stato riportato in MMN (2-4). Kerasnoudis et al. (5) ha riportato una correlazione tra potenziali di azione motoria composti (CMAP) e CSA del nervo mediano nel braccio superiore (r = 0,851, p < 0,001). Beekman et al. (6) ha rilevato che gli studi di ecografia hanno mostrato un aumento del nervo CSA compatibile con anomalie di conduzione più del previsto per motivi puramente clinici. Inoltre, alcuni siti hanno mostrato l’allargamento del nervo senza CB. Le CBS multifocali sono state distribuite lungo il nervo in MMN; tuttavia, questi studi hanno misurato solo alcuni siti predeterminati, fornendo informazioni morfologiche limitate. In questo studio, l’uso della scansione consecutiva lungo il nervo e la misurazione del CSA in più siti basati su ultrasuoni ha permesso una correlazione più accurata tra blocco di conduzione e aumento del CSA in MMN.
Metodi
Soggetti
Tra dicembre 2014 e maggio 2018, 12 pazienti con MMN sono stati reclutati consecutivamente dal Peking Union Medical College Hospital secondo i criteri proposti dall’AANEM (7). Come controlli sono stati arruolati lo stesso numero di controlli sani (HC), corrispondenti all’età (±1 anni). Tutti i pazienti e i controlli sani sono stati sottoposti a un esame clinico standardizzato, tra cui test di forza muscolare del polso, del pollice e della flessione del dito, opponens pollicis, abductor pollicis brevis, finger spreading e adductor pollicis, insieme a test sensoriali. Gli esami clinici, l’elettromiogramma e gli studi ecografici sui nervi sono stati eseguiti lo stesso giorno. Il comitato etico del Peking Union Medical College Hospital ha approvato il nostro protocollo di studio e tutti i pazienti hanno firmato un modulo di consenso informato in conformità con la Dichiarazione di Helsinki.
Studi di conduzione nervosa
Studi di conduzione nervosa motoria (NCSs) sono stati eseguiti su tutti i soggetti sui nervi bilaterali mediano e ulnare con stimolazione percutanea del nervo supramassimale durante la registrazione di CMAPs con elettrodi a disco da 10 mm. I segmenti standard sono stati definiti come polso al gomito e gomito all’ascella per il nervo mediano, e come polso al di sotto del gomito e gomito superiore all’ascella per il nervo ulnare. Una tecnica di impulsi (stimolando lungo il corso del nervo con incrementi di 2 cm) è stata eseguita su alcuni segmenti standard con un blocco di conduzione parziale, rilevando il sito esatto del CB, insieme a un test ecografico consecutivo sullo stesso segmento. La diagnosi CB dei segmenti standard e la tecnica di impulsi sono state eseguite secondo i criteri suggeriti dall’AANEM (7). Per includere solo il vero blocco di conduzione, CMAP distale doveva essere 1 mV. La temperatura ambiente è stata mantenuta per garantire che la temperatura della pelle rimanesse a >31°C. I tecnici sono stati accecati alle informazioni del paziente.
Ultrasuoni
I test ultrasonografici sono stati eseguiti tramite tracciamento nervoso dal polso all’ascella sui nervi mediano bilaterale e ulnare con un trasduttore lineare a 10 MHz (GE LOGIQ e, USA). Al fine di eliminare l’aumento artificiale delle dimensioni del nervo, l’uso dell’ingrandimento dello zoom non è stato consentito per queste misurazioni. Le impostazioni iniziali sono state mantenute costanti durante tutti gli esami, comprese le profondità. Il trasduttore è stato mantenuto perpendicolare al nervo con un angolo selezionato per ottenere l’immagine più piccola e luminosa. I CSA nei siti predeterminati su ciascun nervo sono stati misurati tracciando appena all’interno del bordo iperecogeno del nervo. Dieci siti predeterminati sono stati misurati su ciascun nervo secondo un precedente rapporto del nostro laboratorio (8). Per il nervo mediano, il 10 siti di sbocco del tunnel carpale (M1), il punto centrale della piega del polso (M2), l’ingresso del tunnel carpale (M3), 4 cm prossimalmente alla piega del polso (M4), al centro tra la piega del polso e del gomito (M5), ingresso in pronatore teres (M6), gomito (M7), 4 cm sopra il gomito (M8), 8 cm sopra il gomito (M9), e ascella (M10). Per il nervo ulnare, il 10 siti di polso (U1), 4 cm prossimalmente al polso (U2), il punto di partenza dall’arteria ulnare (U3), a fianco del ventre muscolare del flessore ulnare di carpi è (U4), l’uscita del tunnel cubitale (U5), all’interno del tunnel cubitale (U6), l’ingresso del tunnel cubitale (U7), 4 cm prossimalmente all’ingresso del tunnel cubitale (U8), 8 cm prossimalmente all’ingresso del tunnel cubitale (U9), e l’ascella (U10). Ad eccezione dei siti summenzionati, sono state effettuate misurazioni anche in altri siti di allargamento. L’allargamento CSA è stato riferito ai valori normativi nel nostro laboratorio (nel nervo mediano, i segmenti avambraccio-gomito erano ≤ 10 mm2 e i segmenti gomito-ascella erano ≤ 9 mm2; nel nervo ulnare, entrambi i segmenti avambraccio e braccio erano ≤ 6 mm2). Dopo la misurazione CSA, il nervo è stato nuovamente tracciato continuamente e registrato accuratamente. Dallo studio sono state escluse neuropatie compressive comuni con conseguente ingrossamento dei nervi. Gli ultrasonografi sono stati accecati alle informazioni del paziente.
Statistiche
Il CSAs di MMN ha mostrato una distribuzione non normale. Il Mann-Whitney U-test è stato utilizzato per confrontare MMN e controlli sani, e la differenza di massimo CSA tra i segmenti con CB e quelli senza CB. Il CSA massimo è stato definito come il CSA massimo in tutto il segmento standard. Per tutti i test, un valore P bilaterale di <0,05 è stato considerato statisticamente significativo.
Risultati
Caratteristiche cliniche
Otto uomini e 4 donne con un’età media di 43,7 anni (intervallo 21-62, DS 13,2), 12 controlli sani (età media 43,6, intervallo 28-57, DS 13,3, 8 uomini) sono stati inclusi in questo studio. La durata media della malattia era di 65.3 (24-108) mesi. L’altezza media era di 168 (155-186) cm e il peso medio era di 65,4 (56,5-88) kg. Tutti i pazienti erano naive al trattamento.
Area della sezione trasversale (CSA)
I valori di CSA per i nervi mediano e ulnare in MMN e HC nei 10 siti sono mostrati nella Tabella 1 e nella Figura 1. Gli ingrandimenti CSA erano multifocali rispetto ai controlli sani. Nei nervi mediani, valori di CSA più elevati sono stati distribuiti principalmente nel segmento dell’avambraccio e nel segmento superiore del braccio. I siti sotto il gomito e il segmento superiore del braccio dei nervi ulnari hanno mostrato un allargamento CSA più evidente. È interessante notare che i siti comuni di compressione nervosa, come il canale carpale e il tunnel cubitale non hanno rivelato un aumento prevalente di CSA nei pazienti con MMN rispetto ai controlli sani.

Tabella 1. CSA in diversi siti di nervi mediani e ulnari in MMN e HC.

Figura 1. La distribuzione di 10 siti CSA nei nervi mediano e ulnare. La linea di 10 mm2 è stato istituito come distinguere anomalie significative siti CSA dagli altri segmenti. (A) Per il nervo mediano: M1-l’uscita del carpello canale, M2-il punto di mezzo della piega del polso, M3-l’ingresso del carpello canale, M4-4 cm prossimalmente alla piega del polso, M5-il punto di mezzo tra la piega del polso e del gomito, M6-ingresso in pronatore teres, M7-gomito, M8-4 cm sopra il gomito, M9-8 cm sopra il gomito, M10-ascella. (B) Per il nervo ulnare: U1-il polso, U2-4 cm sopra il polso, U3-punto di partenza dall’arteria ulnare, U4-a fianco del ventre muscolare del flessore ulnare di carpi è, U5-l’uscita del tunnel cubitale, U6-all’interno del tunnel cubitale, U7-l’ingresso del tunnel cubitale, U8-4 cm prossimalmente all’ingresso del tunnel cubitale, U9-8 cm prossimalmente all’ingresso del tunnel cubitale, U10-ascella. CSA, area della sezione trasversale; MMN, neuropatia motoria multifocale.
Correlazione tra maxCSA e il punteggio Sum (MRC) del Medical Research Council
Nei 12 pazienti con MMN, in totale sono stati inclusi 23 nervi mediani e 23 nervi ulnari perché uno dei pazienti con MMN è stato amputato per infortunio sul lavoro. La tendenza tra la massima CSA nervosa di un nervo e la corrispondente forza muscolare è divisa nei seguenti due tipi (Figura 2): (1) CSA aumentato e MRC diminuito. (2) CSA aumentato e MRC non ha mostrato alcun cambiamento evidente.
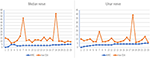
Figura 2. La correlazione tra nervo maxCSA e MRC. La tendenza tra l’area della sezione trasversale del nervo massimo (CSA) di un nervo e la forza muscolare corrispondente. L’ascissa indica 23 nervi bilaterali in 12 pazienti, uno dei quali non è stato in grado di registrare il nervo laterale a causa dell’amputazione; l’ordinata rappresenta l’area della sezione trasversale del nervo (mm2) o la valutazione della forza muscolare. MRC, Medical Research Council Sum Score; maxCSA, area massima della sezione trasversale di un certo nervo.
Correlazione di CSA e CB
Con NCSs motore, sono state rilevate 12 aree CB definite e 12 probabili CB attraverso segmenti standard di nervi mediani e ulnari. Con gli studi ecografici, è stato rilevato un aumento della CSA in 36 siti, rimuovendo i segmenti che erano sensibili alla pressione. Nel nervo mediano, la mediana (P25, P75) del massimo CSA di un segmento standard era 10,3 (8-12) mm2 per quelli senza CB e 21,22 (8,5,38) mm2 per quelli con CB (Z = 1,409, P = 0,159). Nel nervo ulnare, la mediana (P25, P75) del massimo CSA di un segmento nervoso standard era 7,7 (5.8,7) mm2 per quelli senza CB e 6.25 (5,8.25) mm2 per quelli con CB (Z = 0.744, P = 0.457).
C’erano 9 segmenti standard con CB e CSA aumentata (Figura 3, Video 1), 15 segmenti con CB ma CSA normale (Figura 4, Video 2) e 27 segmenti con CSA aumentata ma senza CB (Figura 5, Video 3). La tecnica di impulsi e la scansione consecutiva con ultrasuoni sono state eseguite su cinque segmenti di cui i blocchi di conduzione sono stati difficilmente confermati dal rilevamento di segmenti standard con un blocco di conduzione parziale. Combinando tecniche di impulsi e ultrasuoni, altri due segmenti hanno mostrato CBS e aumentato CSA negli stessi siti, e 3 segmenti hanno mostrato CBS ma CSA normale negli stessi siti.
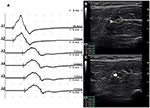
Figura 3. Modalità 1. Un uomo di 28 anni con 4 anni di progressiva debolezza asimmetrica delle mani bilaterali. L’esame ha rivelato i muscoli innervati del nervo ulnare della mano (MRC grade right 3, left 4). Una tecnica di impulsi utilizzata attraverso il segmento dell’avambraccio sinistro del nervo ulnare ha mostrato blocco di conduzione e allargamento CSA nello stesso sito in un paziente con MMN. (A) Blocco di conduzione è stato rilevato tra A1 (latenza 4.9 ms, durata 8.2 ms, ampiezza 14.8 mv, area 38.2 mvms, velocità di conduzione 66.6 m/s) e A2 (latenza 5.2 ms, durata 8.2 ms, ampiezza 9.5 mv, area 26.1 mvms, velocità di conduzione 11.6 m/s). (B) La punta di freccia bianca ha mostrato che il CSA di A1 era 8 mm2. (C) La freccia mostra che il CSA di A2 era 19 mm2 (A1, gomito-6 cm; A2, gomito-4 cm; A3, gomito-2 cm) (Video 1). CSA, area della sezione trasversale; CB, blocco di conduzione; l, sinistra; r, destra.
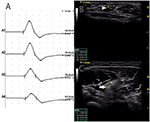
Figura 4. Modalità 2. Una donna di 46 anni con 11 anni di progressiva debolezza asimmetrica degli arti superiori bilaterali, con arto superiore destro MRC grado 3 e 4 sinistro, ha mostrato blocco di conduzione e CSA normale nello stesso sito. (A) Sono stati rilevati blocchi di conduzione tra A1 e A2. (B) La freccia bianca mostrava 6 mm2 ad A1 (Latenza 2,8 ms, durata 3,8 ms, ampiezza 12,4 mv, area 13,3 mvms, velocità di conduzione 50,9 m/s) e (C) La freccia mostrava 8 mm2 ad A2 (Latenza 6,8 ms, durata 3,9 ms, ampiezza 8,2 mv, area 7,7 mvms, velocità di conduzione 63 m/s) (A1, polso; A2, gomito) (Video 2). CSA, area della sezione trasversale; CB, blocco di conduzione; l, sinistra; r, destra.
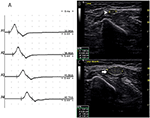
Figura 5. Modalità 3. Una donna di 51 anni con 4 anni di debolezza dell’arto superiore sinistro e MRC grado 4 ha mostrato un allargamento CSA senza corrispondente blocco di conduzione. (A) Studio standard di conduzione nervosa del motore del segmento del nervo ulnare sinistro. Non è stato rilevato alcun CB. Lo studio ecografico del nervo attraverso il braccio sinistro del nervo ulnare mostra: (B) CSA (punta di freccia bianca) che era 8 mm2 nel sito di A3 (latenza 8.7 ms, durata 8.0 ms, ampiezza 8.2 mv, area 19.2 mvms, velocità di conduzione 48.6 m/s) e (C) CSA (freccia) del sito 6 cm prossimale al gomito dell’ulnare sinistro che era 39 mm2 (latenza 12,0 ms, durata 7,9 ms, ampiezza 8,4 mv, area 19,5 mvms, velocità di conduzione 18,2 m/s), ma non è stato rilevato alcun CB sullo stesso segmento (A1, polso; A2, sotto il gomito; A3, sopra il gomito; A4, CSA, area della sezione trasversale; CB, blocco di conduzione; l, sinistra; r, destra.
Discussione
Gli studi elettrofisiologici riflettono le caratteristiche fisiologiche di un nervo e gli studi ecografici rivelano le caratteristiche morfologiche di un nervo. MMN è uno dei modelli ideali per esplorare la correlazione tra motore CB e CSA, per il quale è coinvolto solo il nervo motorio, e CB è la principale caratteristica elettrofisiologica. Sebbene studi precedenti abbiano riportato una correlazione tra CB e CSA (5, 6, 9), sono stati osservati siti limitati senza scansione continua del nervo sotto ultrasuoni e le lesioni in MMN sono state distribuite stocasticamente e non sempre in siti predeterminati.
In questo studio, abbiamo eseguito una scansione consecutiva lungo tutto il nervo per registrare il CSA in siti anormali. Inoltre, le CSA sono state misurate in 10 siti predeterminati. La tecnica di impulsi è stata eseguita se necessario. Anche se la durata di malattia in questo gruppo di pazienti con MMN sono stati a lungo e variegato, che può avere influenzato l’ecografia e caratteristiche elettrofisiologiche, abbiamo ancora trovato tre modalità di relazioni tra CSA e CB CB con nervo corrispondente CSA allargamento (Modalità 1), CB senza nervo corrispondente CSA allargamento (Modalità 2), e del nervo CSA allargamento senza corrispondente CB (Modalità 3). Di conseguenza, la CB non è sempre correlata con un aumento della CSA.
Il potenziale meccanismo di questi diversi modelli di correlazione tra CB e CSA non è ancora chiaro. Inoltre, le vere manifestazioni patologiche corrispondenti dietro l’allargamento del nervo non sono state chiaramente rivelate. L’allargamento ipoecogeno del nervo può riflettere infiammazione attiva e bulbi di cipolla, mentre l’allargamento del nervo con ulteriori fasci iperecogeni / tessuto perifascicolare può riflettere la degenerazione assonale (10). Cioè, entrambe le lesioni assonali e della guaina mielinica potrebbero portare all’allargamento del nervo CSA (11). Per quanto riguarda la modalità 2, CB senza corrispondente allargamento CSA può essere facilmente compreso. Allo stato attuale, MMN è considerata una neuropatia motoria immunomediata, che è correlata al danno anticorpale anti-GM1 ai canali Na + voltaggio-dipendenti nel nodo di Ranvier (12, 13). Teoricamente, gli anticorpi anti-GM1 innescano danni diretti e dipendenti dal complemento agli assoni, portando al blocco della conduzione, mentre non ci possono essere evidenti cambiamenti di mielina. Taylor et al. ipotizzò che l’attacco anticorpale potesse essere diretto ai componenti della mielina paranodale e scoprì che l’alterazione patologica assonale MMN predominava sulla patologia della mielina (14). Inoltre, i nostri risultati relativi al normale CSA e CB in MMN potrebbero essere una conseguenza del fatto che solo i singoli fascicoli sono ingranditi, mentre il nervo principale CSA rimane inalterato (15).
Rispetto alla Modalità 1 (CB con aumento della CSA), è stato riportato un aumento della CSA nella MMN in studi di risonanza magnetica (MRI) (16) e in altri studi ecografici (3). La nostra scoperta che i pazienti con MMN avevano un allargamento CSA del nervo multifocale e un blocco di conduzione nello stesso sito lungo il nervo può implicare che nel sito di CB non solo c’erano canali Na+voltaggio-dipendenti danneggiati ma anche alcune lesioni, come demielinizzazione, edema e formazione di bulbi di cipolla (6, 17). Questa modalità ha indicato che CB potrebbe essere causato da diversi meccanismi, e MMN può essere una sindrome. Non tutti i casi di MMN sono causati da anticorpi IgM anti-GM1 e potrebbero essere coinvolti anche altri processi di immunizzazione con conseguente demielinizzazione / remielinizzazione e processi di degenerazione/rigenerazione assonale.
Il meccanismo per la Modalità 3 necessita di ulteriori esplorazioni. L’allargamento del nervo CSA senza CB in MMN, o anche gli arti senza disfunzione neurofisiologica, è stato trovato anche in altri rapporti (6, 9, 18). Abbiamo ipotizzato che quando infiltrati infiammatori, edema e disfunzione del canale si verificano nei nodi di Ranvier nella fase iniziale, la soglia di depolarizzazione dei canali ionici potrebbe rimanere in un intervallo normale, tale che la disfunzione della trasmissione dello stimolo saltatorio non è stata ancora raggiunta e non è possibile rilevare CB. Nei pazienti con MMN, se viene rilevato un aumento di CSA senza CB, i cambiamenti morfologici del nervo dovrebbero anche avere un significato clinico. La scansione consecutiva lungo il nervo e le misurazioni in un numero maggiore di siti per rilevare i cambiamenti morfologici potrebbero aumentare la sensibilità diagnostica per MMN.
In conclusione, esistevano tre modelli di correlazioni tra CB e CSA e i cambiamenti elettrofisiologici e morfologici non erano sempre coerenti in MMN. Gli studi ecografici potrebbero rilevare più lesioni lungo il nervo in MMN, anche senza CB. La combinazione di NCS del motore e degli studi di ultrasuono potrebbe fornire più informazioni per la diagnosi clinica di MMN.
Limitazioni
Questo è stato un confronto di parametri singoli, uno studio trasversale. Le diverse durate della malattia dei pazienti con MMN in questo studio, oltre alle loro diverse altezze, pesi, potrebbero influenzare la CSA nervosa e il rilevamento della velocità di conduzione nervosa. Inoltre, abbiamo osservato solo se CB nervo motore presentato e se ci sono stati cambiamenti correlati in CSA su un ultrasuono; i potenziali meccanismi dei diversi modelli di correlazione tra CB e CSA richiedono ulteriori studi. Solo nerve CSA, il parametro più importante, era stato incluso in questo studio, quindi per eseguire ricerche più precise, dovrebbero essere coinvolti più indici come l’intensità dell’eco.
Dichiarazione sulla disponibilità dei dati
Tutti i dati non pubblicati all’interno dell’articolo sono disponibili e saranno condivisi su richiesta da qualsiasi investigatore qualificato.
Dichiarazione etica
Il comitato etico del Peking Union Medical College Hospital ha approvato il nostro protocollo di studio e tutti i pazienti hanno firmato un modulo di consenso informato in conformità con la Dichiarazione di Helsinki.
Contributi dell’autore
YL: studi elettrofisiologici ed ultrasonografici, acquisizione di dati, analisi statistica e scrittura manoscritta. JN: studi elettrofisiologici ed ecografici e analisi statistiche. LC: concetto di studio e progettazione e redazione di manoscritti. TL: raccolta dati e redazione di manoscritti. QD: studi elettrofisiologici ed ecografici. SW e YG: studi elettrofisiologici. ML: concetto di studio e design, revisione dei dati, editing manoscritto e revisione critica.
Conflitto di interessi
ML ha ricevuto il sostegno di Beijing Capital Special Fund (Z171100001017220).
I restanti autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Riconosciamo con gratitudine il finanziamento del Fondo speciale di Beijing Capital (Z171100001017220).
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online all’indirizzo: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Video 1. Modalità 1: Blocco di conduzione e allargamento CSA nello stesso sito in MMN.
Video 2. Modalità 2: blocco di conduzione e CSA normale nello stesso sito in MMN.
Video 3. Modalità 3: CSA allargamento senza corrispondente blocco di conduzione.
Abbreviazioni
MMN, multifocal motor neuropathy; CB, motor nerve conduction block; CSA, cross-sectional area; NCS, motor nerve conduction studies.
1. Parry GJ, Clarke S. Neuropatia demielinizzante acquisita multifocale mascherata da malattia del motoneurone. Nervo muscolare. (1988) 11:103–7. doi: 10.1002 / mus.880110203
PubMed Abstract / CrossRef Testo completo / Google Scholar
2. Grimm A, Rattay TW, Winter N, Axer H. Sistemi di punteggio per ultrasuoni dei nervi periferici: benchmarking e analisi comparativa. J Neurol. (2017) 264:243–53. doi: 10.1007 / s00415-016-8305-y
PubMed Abstract / CrossRef Testo completo / Google Scholar
3. Il nostro sito utilizza cookie tecnici e di terze parti. Ultrasuoni nervosi come strumento di follow-up nella neuropatia motoria multifocale trattata. Eur J Neurol. (2017) 24:1125–34. doi: 10.1111 / en.13344
PubMed Abstract / CrossRef Testo completo / Google Scholar
4. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. Ultrasuoni nervosi nella differenziazione della neuropatia motoria multifocale (MMN) e della sclerosi laterale amiotrofica con predominante malattia del motoneurone inferiore (SLA/LMND). J Neurol. (2016) 263:35–44. doi: 10.1007 / s00415-015-7927-9
PubMed Abstract / CrossRef Testo completo / Google Scholar
5. Kerasnoudis A, Pitarokoili K, Behrendt V, Gold R, Yoon MS. Neuropatia motoria multifocale: correlazione di ultrasuoni nervosi, risultati elettrofisiologici e clinici. J Peripher Nerv Syst. (2014) 19:165–74. doi: 10.1111 | jns5.12067
PubMed Abstract / CrossRef Full Text / Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. L’ecografia mostra ampi allargamenti nervosi nella neuropatia motoria multifocale. Neurologia. (2005) 65:305–7. doi: 10.1212 / 01.lnl.0000169179.67764.30
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. Criteri di consenso per la diagnosi di neuropatia motoria multifocale. Nervo muscolare. (2003) 27:117–21. doi: 10.1002 / mus.10317
PubMed Abstract / CrossRef Testo completo / Google Scholar
8. Niu J, Cui L, Liu M. Siti multipli ecografia dei nervi periferici nel differenziare charcot-marie-tooth tipo 1A da poliradicoloneuropatia demielinizzante infiammatoria cronica. Neurolo anteriore. (2017) 8:181. doi: 10.3389 / fneur.2017.00181
PubMed Abstract / CrossRef Testo completo / Google Scholar
9. Pitarokoili K, Oro R, Yoon MS. Ecografia del nervo in un caso di neuropatia motoria multifocale senza blocco di conduzione. Nervo muscolare. (2015) 52:294–9. doi: 10.1002 / mus.24583
PubMed Abstract / CrossRef Testo completo / Google Scholar
10. Il nostro obiettivo è quello di migliorare la qualità e la qualità del prodotto. L’ecografia del nervo predice la risposta al trattamento nella poliradicoloneuropatia demielinizzante infiammatoria cronica-un follow-up prospettico. Neuroterapeutica. (2018) 15:439–51. doi: 10.1007 / s13311-018-0609-4
PubMed Abstract / CrossRef Testo completo / Google Scholar
11. Tsukamoto H, Granata G, Coraci D, Paolasso I, Padova L. Correlazione ecografica e neurofisiologica nel blocco di conduzione del nervo fibulare comune alla testa fibulare. Neurofisiolo di Clin. (2014) 125:1491–5. doi: 10.1016 / j.clinph.2013.11.041
PubMed Abstract | CrossRef Testo completo / Google Scholar
12. Harschnitz O, Jongbloed BA, Franssen H, Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: alterazioni patologiche nel sito del blocco di conduzione. J Neuropatolo Exp Neurolo. (2004) 63:129–37. doi: 10.1093/jnen / 63.2.129
PubMed Abstract / CrossRef Full Text / Google Scholar
15. Grimm A, Inverno N, Rattay TW, Hartig F, Dammeier NM, Auffenberg E, et al. Uno sguardo all’interno del nervo – Morfologia dei fascicoli nervosi nei controlli sani e nei pazienti con polineuropatia. Neurofisiolo di Clin. (2017) 128:2521–6. doi: 10.1016 / j.clinph.2017.08.022
PubMed Abstract | CrossRef Testo completo / Google Scholar
16. Haakma W, Jongbloed BA, Froeling M, Goedee HS, Bos C, Leemans A, et al. La risonanza magnetica mostra ispessimento e diffusione alterata nei nervi mediano e ulnare nella neuropatia motoria multifocale. Radiol Eur. (2017) 27:2216–24. doi: 10.1007 / s00330-016-4575-0
PubMed Abstract / CrossRef Testo completo / Google Scholar
17. Kaji R, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I, et al. Risultati patologici nel sito del blocco di conduzione nella neuropatia motoria multifocale. Ann Neurol. (1993) 33:152–8. doi: 10.1002 / ana.410330204
PubMed Abstract / CrossRef Testo completo / Google Scholar
18. Gallardo E, Noto Y, Simon NG. Ultrasuoni nella diagnosi di neuropatia periferica: la struttura incontra la funzione nella clinica neuromuscolare. J Neurol Neurochirurgia Psichiatria. (2015) 86:1066–74. doi: 10.1136 / jnnp-2014-309599
PubMed Abstract / CrossRef Full Text | Google Scholar