Infezione da citomegalovirus (CMV) nei pazienti HIV/AIDS e valori diagnostici di CMV-Rilevamento del DNA su diversi tipi di campione
- Introduzione
- Metodi
- Soggetti
- Inclusione ed esclusione
- Reagenti e apparecchiature
- Quantificazione dell’HIV-RNA
- Conteggio dei linfociti T CD4 +
- Quantificazione del CMV-DNA
- CMV anticorpo test
- Metodi di studio
- Rilevamento dell’acido nucleico
- Rilevazione di sottoinsiemi di linfociti T
- Rilevamento di anticorpi immunitari
- Analisi statistica
- Risultati
- Dati generali
- tassi Positivi di CMV-DNA, CMV IgG, e CMV-IgM
- Correlazione tra infezione da CMV ECD4+ conta dei linfociti T
- Rilevamento di CMV-DNA in campioni diversi
- Conclusioni
- Riconoscimenti
- Nota a piè di pagina
Introduzione
Il citomegalovirus (CMV) è un herpesvirus comune diffuso tra le popolazioni umane. L’infezione da CMV di solito non causa sintomi e colpisce principalmente le ghiandole salivari, i reni e altri organi. Tuttavia, la replicazione virale può verificarsi in pazienti immunocompromessi e può contribuire al danno agli organi e alle loro funzioni. Le infezioni opportunistiche sono più frequenti e gravi nei pazienti con HIV / AIDS. L’infezione da virus CMV è comune in questi pazienti e può colpire più organi/sistemi, inclusi occhi, polmoni, sistema nervoso e sistema digestivo. Molti studi hanno esplorato le caratteristiche virologiche e immunologiche dell’infezione da CMV semplice (1), specialmente quelle riscontrate nelle donne e nei bambini. Le caratteristiche immunologiche dell’infezione da CMV, tuttavia, sono piuttosto uniche nei pazienti già immunocompromessi di HIV/AIDS. Esistono differenze nelle caratteristiche cliniche, nelle misure di trattamento, nei fattori prognostici tra i pazienti HIV con infezione da CMV e quelli con infezione da CMV da sola (2). La linea guida della Cina ha raccomandato che sia necessaria una terapia antivirale immediata di CMV e ART in quei pazienti HIV / AIDS con complicanze (retinite, polmonite, encefalite da CMV, enterite, ecc.) quando viene identificata l’infezione da CMV. A causa della non specificità dei sintomi clinici causati dall’infezione da CMV, l’esame di laboratorio è la base principale per la diagnosi di infezione da CMV. Più due ampiamente utilizzati metodi clinici sono CMV la replicazione del virus e di siero di metodi immunologici tra cui il rilevamento di CMV IgG CMV IgM e CMV antigene PP65 (2) In pazienti con alterata funzione del sistema immunitario, la produzione di anticorpi CMV è indebolito o in ritardo, il che può portare a falsi negativi e aumentare il tasso di mancata diagnosi, perciò PCR detection di CMV-DNA è diventato in gran parte il metodo standard per la diagnosi di infezione da CMV e il monitoraggio del trattamento (3). Daisuke Mizushima et al. ha riferito che il plasma CMV-DNA PCR ha un valore importante nella diagnosi sia per la retinite da CMV che per tutta la CMV-EOD in pazienti con infezione avanzata da HIV-1 (4). CMV-DNA PCR può essere rilevato in una varietà di tipi di campioni come plasma, urina, liquido cerebrospinale, umore acqueo, feci, ecc. (5). Tuttavia, pochi articoli hanno analizzato e discusso il significato e il valore del rilevamento del CMV-DNA PCR in campioni diversi dal plasma. Nel presente studio abbiamo analizzato retrospettivamente i test di laboratorio (tra cui CMV-DNA, anticorpo CMV, conta dei linfociti T CD4+, carica virale dell’HIV, ecc.) in 808 pazienti HIV/AIDS che sono stati trattati nel nostro centro dal 2017 al 2019 per comprendere la coinfezione da CMV e i punti di forza e di debolezza di diversi metodi di rilevamento. Presentiamo il seguente articolo/caso in conformità con la lista di controllo di segnalazione MDAR (disponibile a http://dx.doi.org/10.21037/apm-20-1352).
Metodi
Soggetti
Sono stati arruolati un totale di 808 pazienti HIV/AIDS ricoverati nel nostro centro tra gennaio 2017 e ottobre 2019. HIV-RNA, conta linfocitaria CD4 + T, CMV-DNA e anticorpi correlati sono stati misurati in ciascun paziente. La diagnosi di infezione da HIV era basata sulle linee guida per la diagnosi e il trattamento dell’HIV/AIDS (terza edizione) (6) e tutti i pazienti sono stati confermati come infezione da HIV dai Centri municipali di Fuzhou per il controllo delle malattie (CDC) o dal CDC locale che ha trattato il paziente. La diagnosi di infezione da CMV si basava sui seguenti criteri: (I) CMV-DNA positivo nel plasma, liquido di lavaggio alveolare, urina, liquido cerebrospinale (CSF) e / o altri fluidi corporei; (II) siero CMV-immunoglobulina M (IgM) positivo; (III) una diagnosi oftalmologica di retinite da CMV; (IV) CMV polmonite soprattutto che si manifesta come la febbre, la tosse, il catarro, e senso di costrizione toracica; CMV-DNA positivi nel fluido di lavaggio alveolare; (V) CMV enterite o esofagite principalmente si manifesta come disfagia/deglutizione, dolore, diarrea o dolori addominali, ed efficace diagnostica anti-CMV trattamento; (VI) CMV encefalite che si manifesta come il sistema nervoso sintomi e CMV-DNA positivi nel CSF e il tessuto cerebrale; (VII) CMV epatite che si manifesta come febbre, disturbi della funzione epatica, e il disagio nella zona del fegato, e CMV-DNA positivi nella biopsia epatica. Una diagnosi di infezione da CMV è stata fatta se uno qualsiasi dei criteri di cui sopra, tranne il punto II), è stato soddisfatto o se il punto II) più qualsiasi altro criterio è stato soddisfatto (7).
Tutte le procedure eseguite in questo studio che ha coinvolto partecipanti umani erano in conformità con la Dichiarazione di Helsinki (come rivisto nel 2013). Lo studio è stato approvato dal comitato etico medico del nostro centro (approvazione n. KS2019-070-01). I dati sono anonimi e pertanto è stato revocato l’obbligo del consenso informato.
Inclusione ed esclusione
Criteri di inclusione: pazienti con HIV / AIDS che hanno visitato per la prima volta l’ospedale epatobiliare Mengchao della Fujian Medical University e hanno completato il rilevamento di HIV-RNA, CMV-DNA, anticorpo CMV-IgG, anticorpo CMV-IgM e linfociti T CD4+ entro 14 giorni. Escludere i casi di HIV / AIDS che non possono completare gli elementi di prova di cui sopra a causa della dimensione del campione insufficiente.
Reagenti e apparecchiature
Quantificazione dell’HIV-RNA
La reazione a catena quantitativa fluorescente in tempo reale della polimerasi (PCR) (FQ-PCR) è stata eseguita sul sistema QPCR Mx3000p (Agilent, USA) utilizzando il kit di quantificazione dell’HIV-RNA prodotto da QiaGen (Shenzhen, Cina).
Conteggio dei linfociti T CD4 +
Lo strumento utilizzato era il citometro a flusso FACSCalibur (BD Biosciences, USA) e il kit di reagenti utilizzato era BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, USA).
Quantificazione del CMV-DNA
La FQ-PCR è stata eseguita sul sistema Mx3000p QPCR (Agilent, USA) per rilevare i livelli di CMV-DNA nel plasma, nelle urine e nel CSF. Il kit utilizzato è stato prodotto da Sansure Biotech (Hunan, Cina).
CMV anticorpo test
Chemiluminescenza immunodosaggio è stato eseguito per rilevare anticorpi anti-CMV-IgG e IgM sull’analizzatore Cobas e601 (Roche Diagnostics, Germania) con i kit di supporto (Roche Diagnostics, Germania).
Metodi di studio
Rilevamento dell’acido nucleico
Dopo che i pazienti HIV/AIDS sono stati ricoverati nel nostro ospedale, 3 ml di campione di sangue intero anticoagulante a digiuno di acido etilendiamminotetraacetico (EDTA) sono stati raccolti e quindi centrifugati a 3.000 giri/min per 5 minuti per raccogliere 200 µL di plasma per il rilevamento di HIV-RNA e CMV-DNA. In tutti i pazienti, 5 ml di campione di urina sono stati raccolti al mattino e mescolati accuratamente, quindi 200 µL sono stati raccolti per il rilevamento del CMV-DNA. Per i pazienti con sintomi neurologici, è stato ottenuto 1 mL di CSF per il rilevamento del CMV-DNA. Secondo il limite di rilevamento e lo standard di giudizio positivo del kit CMV-DNA e del kit HIV-RNA. I campioni sono stati considerati positivi se il valore di CMV-DNA era superiore a 400 copie / mL, o se il livello di HIV-RNA era superiore a 500 copie/mL.
Rilevazione di sottoinsiemi di linfociti T
Nei pazienti affetti da HIV/AIDS, 3 ml di campione di sangue intero a digiuno anticoagulante EDTA sono stati raccolti al momento del ricovero e quindi miscelati accuratamente per la rilevazione di sottoinsiemi di linfociti T su un citometro a flusso FACSCalibur BD utilizzando i reagenti ausiliari.
Rilevamento di anticorpi immunitari
Nei pazienti HIV/AIDS, 3 ml di campione di sangue a digiuno sono stati raccolti al momento del ricovero, centrifugati a 3.000 giri/min per 5 minuti in una provetta di siero con separatore di gel e quindi testati sulla macchina.
Tutti i test di cui sopra sono stati eseguiti rigorosamente in conformità con le istruzioni del reagente nel manuale del produttore e le procedure operative standard degli strumenti.
Analisi statistica
L’analisi statistica è stata eseguita utilizzando il software SPSS 21.0. I dati di misurazione normalmente distribuiti sono presentati utilizzando la media ± deviazione standard (x ±DS) e i dati non normalmente distribuiti sono espressi come mediana (25-75 percentili). I dati di conteggio sono espressi in percentuali e tassi. Il confronto dei dati di misurazione non normalmente distribuiti tra due gruppi è stato eseguito utilizzando un test di somma di rango non parametrico, mentre i dati di conteggio sono stati confrontati utilizzando il test Chi-quadrato. Un valore P <0,05 è stato considerato statisticamente significativo.
Risultati
Dati generali
I dati generali di 808 pazienti affetti da HIV/AIDS sono riassunti nella Tabella 1. Il sesso e l’età non hanno mostrato differenze significative tra il gruppo CMV e il gruppo non CMV. La conta assoluta di CD4 nel gruppo infetto da CMV era significativamente inferiore a quella nel gruppo non infetto da CMV (Z = -8,87, P < 0,001) e il livello di HIV-RNA era significativamente più alto nel gruppo infetto da CMV rispetto al gruppo infetto da non CMV (Z=-3,207, P<0,05) (Tabella 1).
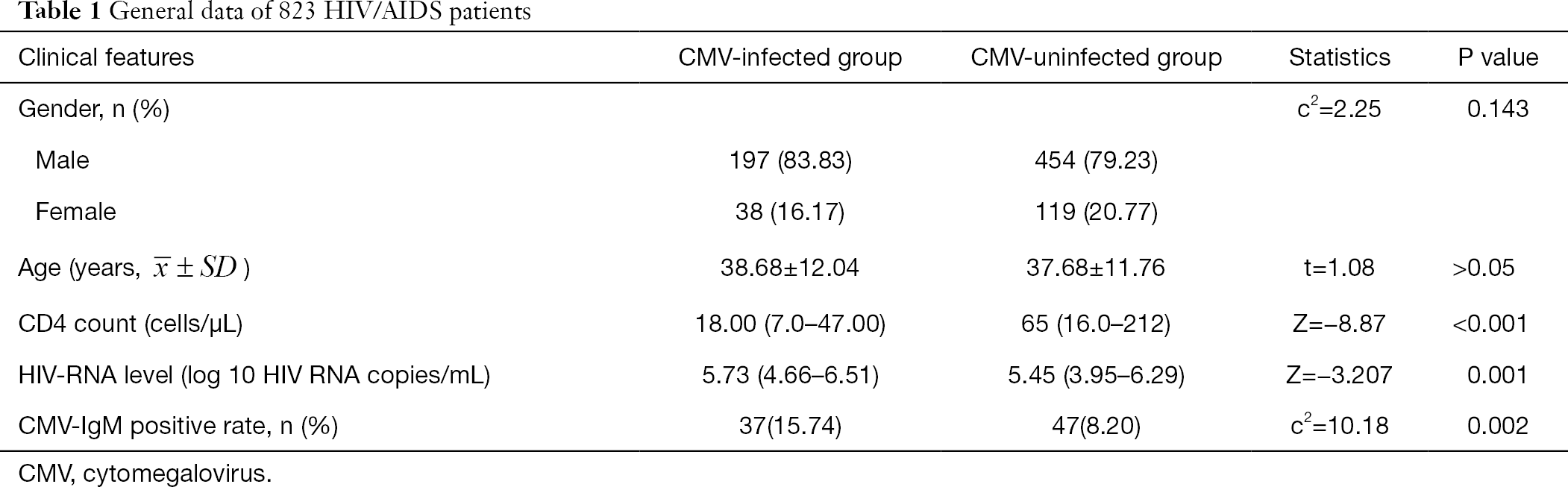
tabella Completa
tassi Positivi di CMV-DNA, CMV IgG, e CMV-IgM
complessivamente positiva del tasso di CMV-DNA è stato 29.08% (235/808); in particolare, è stata 5.70% (13/228) CSF 26.01% (77/296) nel plasma, e 25.75% (180/699) nelle urine. Il tasso positivo di CMV-IgG era del 99,8% (806/808) e il tasso positivo di CMV-IgM era del 10,40% (84/808).
Correlazione tra infezione da CMV ECD4+ conta dei linfociti T
Dopo aver raggruppato la conta dei linfociti T CD4+, abbiamo scoperto che la percentuale di pazienti infetti da citomegalovirus a bassa frequenza dei linfociti T CD4+ era maggiore di quella dei pazienti non infetti da CMV. L’incidenza dell’infezione da CMV è aumentata con la diminuzione della conta dei CD4 (Tabella 2).
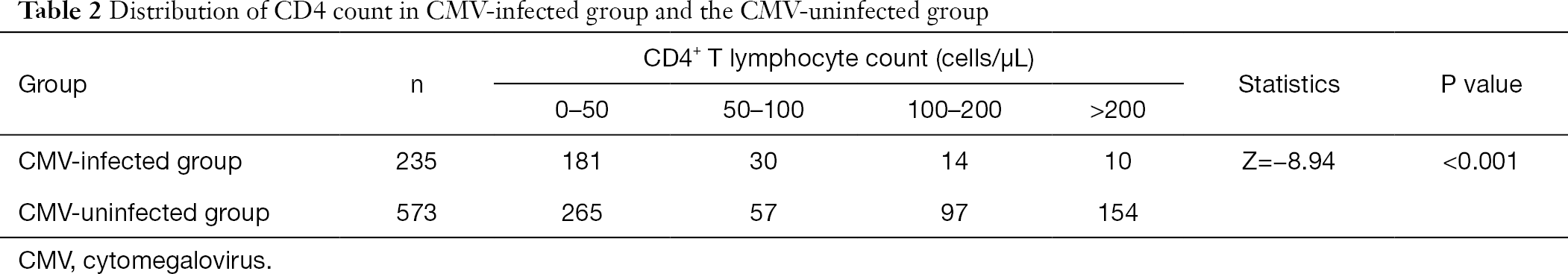
tabella Completa
Rilevamento di CMV-DNA in campioni diversi
Di questi 808 pazienti, 198 pazienti ricevuto anche i test per le urine e plasma CMV-DNA e plasma anti-CMV IgG CMV-IgM. Utilizzando l’analisi Chi-quadrato per i dati accoppiati, abbiamo eseguito confronti a coppie di urina CMV-DNA e plasma CMV-DNA con anticorpo plasma CMV-IgM, rispettivamente. Si è riscontrato che i risultati del rilevamento del CMV-DNA nelle urine e nel plasma differivano significativamente da quello del test degli anticorpi CMV-IgG nel plasma (P<0,001), mentre il risultato del rilevamento del CMV-DNA nel plasma non era significativamente diverso da quello del rilevamento del CMV-DNA nelle urine (P>0,05) (Tabelle 3,4).

tabella Completa
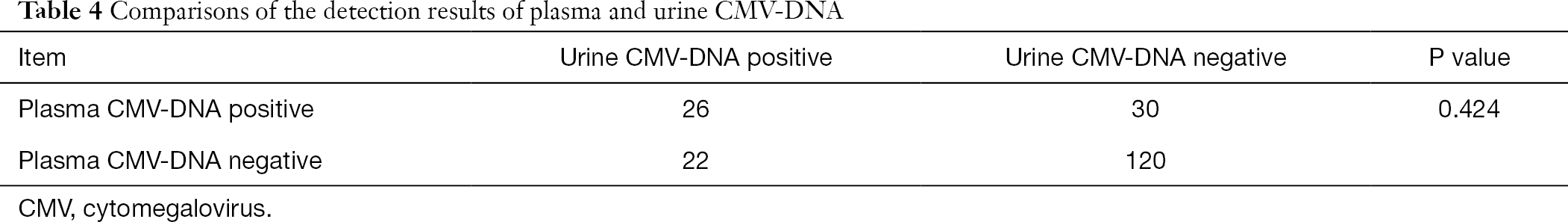
tabella Completa
CMV è un membro della β-herpes virus di gruppo ed è caratterizzata dalla stretta specificità di specie e diffusa incidenza nella popolazione umana. La sieroprevalenza della CMV è di circa l ‘ 85% nei bambini e fino al 95% negli adulti. Nel nostro attuale studio, il tasso positivo di CMV-IgG ha raggiunto il 99,8%. La CMV è latente nella maggior parte dei casi, ma negli individui immunocompromessi, il virus si replica esponenzialmente e si diffonde in tutto il corpo con il sangue, causando viremia da CMV e persino malattia da CMV organica (8). L’infezione da CMV è una delle infezioni opportunistiche comuni nei pazienti con HIV / AIDS. I linfociti T CD4 + sono le cellule bersaglio del virus HIV e i loro conteggi possono spesso riflettere il decorso dell’AIDS e possono anche essere usati come indicatore per valutare lo stato immunitario dei pazienti affetti da AIDS. Questo studio ha analizzato l’infezione da CMV, il numero di CD4 e il livello di HIV-RNA in 808 pazienti con HIV/AIDS. Abbiamo scoperto che il tasso positivo di CMV nei pazienti affetti da AIDS è aumentato con la diminuzione del numero di CD4 e con l’aumento della carica virale dell’HIV. Anche nel nostro studio attuale, fino al 77,02% dei pazienti CMV-positivi aveva una conta CD4 di < 50 cellule / µL, suggerendo che CD4 < 50 cellule / µL è un fattore di rischio per la coinfezione da HIV-CMV, che è coerente con la scoperta di Deng et al. (9). Il livello quantitativo di HIV-RNA nel gruppo infetto da CMV era superiore a quello nel gruppo non infetto da CMV, il che suggeriva indirettamente che alti livelli di carica virale di HIV-RNA erano un altro fattore di rischio di infezione da CMV nei pazienti HIV/AIDS .Pertanto, si raccomanda ai pazienti con HIV / AIDS di iniziare il trattamento ART il più presto possibile per promuovere la ricostituzione immunitaria per prevenire infezioni opportunistiche e lo screening per HCMV è essenziale per i pazienti con HIV/AIDS con una conta CD4 di <50 cellule/µL (2).
Abbiamo anche valutato i valori dei test di acido nucleico virale e dei metodi immunologici nella rilevazione clinica dell’infezione da CMV. Studi in Cina e a livello internazionale hanno dimostrato che il CMV-DNA appare prima dei sintomi clinici e delle reazioni sierologiche delle infezioni da CMV. La FQ-PCR è attualmente il metodo di quantificazione microbica più accurato e rapido ed è in grado di superare alcuni problemi della PCR tradizionale (ad esempio, contaminazione del prodotto di amplificazione e non quantificazione) (10). Nel nostro studio attuale, il tasso positivo di CMV-DNA era 5.70% (13/228) nei campioni di liquido cerebrospinale di 228 pazienti con sintomi neurologici, che era molto inferiore a quello dei campioni di plasma e urine, che potrebbe essere spiegato dalla barriera emato-encefalica e dalla suscettibilità agli organi. L’anticorpo anti-CMV-IgM è spesso usato come marcatore di infezione virale attiva; tuttavia, il tasso positivo dell’anticorpo anti-CMV-IgM era solo del 10,40% (84/808) nei nostri pazienti HIV/AIDS, che era inferiore al tasso positivo di infezione da CMV riportato nelle popolazioni non HIV/AIDS (11). Inoltre, il suo tasso positivo ha avuto scarso accordo con i risultati del rilevamento dell’acido nucleico, che potrebbe essere dovuto all’indebolimento del sistema immunitario o alla generazione ritardata di anticorpi IgM nei pazienti HIV/AIDS. Pertanto, la rilevazione dell’anticorpo CMV-IgM ha un ruolo limitato nello screening HCMV nei pazienti HIV / AIDS. Inoltre, il tasso positivo di infezione da CMV in 808 pazienti è stato del 29,05% (235/808) nel nostro studio attuale, che è leggermente superiore al 21,85% riportato da Li et al., e può essere dovuto alla maggiore varietà di campioni (incluso plasma, urina e liquido cerebrospinale) raccolti in questo studio (12). Il tasso positivo di CMV-DNA era del 25,57% nelle urine e del 26,01% nel plasma, la differenza non era statisticamente significativa. Pertanto, si consiglia di eseguire lo screening del CMV-DNA nel plasma e nelle urine quando la conta dei linfociti T CD4+ è inferiore a 200 cellule/µL, specialmente quando <50 cellule/µL; inoltre, è necessaria la rilevazione del CMV-DNA nel CSF se sono presenti evidenti sintomi neurologici.
Conclusioni
In conclusione, la bassa conta dei linfociti T CD4+ e l’alta carica virale dell’HIV-1 sono fattori di rischio per l’infezione da CMV nei pazienti affetti da HIV/AIDS. Il rilevamento di urina o plasma CMV-DNA da FQ-PCR è molto prezioso nello screening dell’infezione da CMV nei pazienti HIV / AIDS, mentre il rilevamento dei livelli ematici di CMV IgG e CMV IgM ha un valore clinico limitato. Lo screening CMV-DNA del sangue o delle urine è raccomandato per i pazienti affetti da AIDS per prevenire e diagnosticare precocemente l’infezione da CMV e migliorare la loro qualità di vita.
Riconoscimenti
Finanziamento: sponsorizzato da Key Clinical Specialty Discipline Construction Program of Fujian, P. R. C.
Nota a piè di pagina
Lista di controllo di reporting: Gli autori hanno completato la lista di controllo di reporting MDAR. Disponibile a http://dx.doi.org/10.21037/apm-20-1352
Dichiarazione di condivisione dei dati: Disponibile a http://dx.doi.org/10.21037/apm-20-1352
Conflitti di interesse: Tutti gli autori hanno compilato il modulo di divulgazione uniforme ICMJE (disponibile a http://dx.doi.org/10.21037/apm-20-1352). Gli autori non hanno conflitti di interesse da dichiarare.
Dichiarazione etica: Gli autori sono responsabili per tutti gli aspetti del lavoro nel garantire che le questioni relative all’accuratezza o all’integrità di qualsiasi parte del lavoro siano adeguatamente investigate e risolte. Tutte le procedure eseguite in questo studio che ha coinvolto partecipanti umani erano in conformità con la Dichiarazione di Helsinki (come rivisto in 2013). Lo studio è stato approvato dal comitato etico medico del nostro centro (approvazione n. KS2019-070-01). I dati sono anonimi e pertanto è stato revocato l’obbligo del consenso informato.
Dichiarazione di accesso aperto: Questo è un articolo ad accesso aperto distribuito in conformità con la licenza internazionale Creative Commons Attribution-NonCommercial-NoDerivs 4.0 (CC BY-NC-ND 4.0), che consente la replica non commerciale e la distribuzione dell’articolo con la rigorosa condizione che non vengano apportate modifiche o modifiche e che l’opera originale sia correttamente citata (inclusi i link sia alla pubblicazione formale attraverso il DOI pertinente che alla licenza). Vedi: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, He G. Effetti dell’infezione da citomegalovirus sulle cellule immunitarie regolatrici nelle donne in gravidanza cinesi. Rivista di Nosocomiologia. 2017;27:2103-6.
- Il National Science and Technology Major Project AIUTA il gruppo di ricerca sulle infezioni opportunistiche durante il 13 ° piano quinquennale. Consenso degli esperti sulla diagnosi clinica e il trattamento dell’AIDS complicato con la malattia da citomegalovirus . Journal of Southwest University (Edizione Scienze naturali): 1-17 .
- Hodowanec AC, Pikis A, Komatsu TE, et al. Trattamento e prevenzione della malattia da CMV nei pazienti trapiantati: conoscenze attuali e prospettive future. J Clin Pharmacol 2019;59:784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Utilità diagnostica della PCR quantitativa del DNA del citomegalovirus plasmatico per le malattie end-organo del citomegalovirus in pazienti con infezione da HIV-1. J Acquir Immune Defic Syndr 2015; 68:140-6.
- Michaelides A, Liolios L, Glare EM, et al. L’aumento del carico di DNA del citomegalovirus umano (HCMV) nei leucociti del sangue periferico dopo trapianto polmonare è correlato alla polmonite da HCMV. Trapianto 2001; 72: 141-7.
- L’infezione della neurologia, gruppo AIDS dell’associazione medica cinese. Linee guida per la diagnosi e il trattamento dell’HIV/AIDS (terza edizione). Chinese Journal of Infectious Diseases 2015; (10): 577-93.
- Corrales I, Giménez E, Solano C, et al. Incidenza e dinamica dell’infezione attiva da citomegalovirus in pazienti sottoposti a trapianto di cellule staminali allogeniche secondo polimorfismi a singolo nucleotide nei geni CCR5, MCP-1, IL-10 e TLR9 del donatore e del ricevente. J Med Virol 2015;87:248-55.
- Tagarro A, Del Valle R, Dominguez-Rodríguez S, et al. Modelli di crescita nei bambini con infezione congenita da citomegalovirus. Pediatr Infect Dis J 2019;38: 1230-5.
- Deng X, Liu J, Zhang M, et al. Analisi delle caratteristiche virologiche e immunologiche dell’HIV / AIDS in combinazione con l’infezione da citomegalovirus. Giornale cinese di infezione ospedaliera 2019;29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analisi di pazienti con microRNA sin umani e virali circolanti con infezione congenita da citomegalovirus. J Perinatol 2016;36:1101-5.
- Li L, Gao S, Zhang T, et al. Confronto tra il rilevamento del DNA e il rilevamento di IgM dell’infezione da citomegalovirus umano e discussione del loro valore di applicazione combinato. Chinese Journal of Experimental Diagnostics 2015; (1): 78-80.
- Li X, Cao L, Yu C, et al. Studio sull’infezione del citomegalovirus nei pazienti affetti da AIDS. Medicina Preventiva moderna 2012;39:2278-9.
(Editor di lingua inglese: J. Gray)