L’impegno dell’antigene cognato sulle cellule parenchimali stimola la proliferazione delle cellule T CD8+ in situ
- Le cellule T CD8+ cognate si trovano in LN e tessuto infiammato
- Le cellule T CD8 + si espandono nel sito di infiammazione
- L’interazione affine con le isole promuove l’espansione
- Non è richiesta l’interazione affine con i leucociti residenti
- L’interazione affine con le cellule parenchimali è importante
- Le cellule T proliferano nel sito di infiammazione
- L’interazione cognata con le cellule parenchimali spinge la proliferazione
- IL-2 è più importante nel sito di infiammazione
Le cellule T CD8+ cognate si trovano in LN e tessuto infiammato
In esperimenti iniziali (Fig. 1) abbiamo stabilito un modello in cui le risposte delle cellule T CD8 a un antigene parenchimale, l’ovalbumina (OVULI), potrebbero essere analizzate. I topi OT-I esprimono un TCR transgenico che media il riconoscimento delle cellule T CD8+ del peptide OVA257-264 presentato sulla molecola MHC di classe I H-2Kb. Le cellule T CD8 sono state arricchite da topi OT-I/CD45.1, etichettati con coloranti CFSE e trasferiti adottivamente da IV in topi ospiti B6 (CD45.2+). Le cellule T trasferite adottivamente potrebbero essere distinte dalle cellule ospiti mediante colorazione CD45.1 (così come CD8 e la catena Va2 del TCR OT-I) mentre la diluizione CFSE-dye è stata utilizzata per identificare le cellule che si erano proliferate (ad esempio, Fig. 1a, Fig. supplementare 1). L’antigene parenchimale è stato introdotto innestando B6.Isole ßOVA (tali isole esprimono gli OVULI nelle cellule β parenchimali sotto il promotore dell’insulina di ratto, Tabella supplementare 1) sotto la capsula renale di topi ospiti che avevano già ricevuto cellule T OT-I/CD45.1. Tutte e tre le fonti (ospite, donatore di cellule T e donatore di isole) hanno un background B6 e quindi esprimono H-2Kb. Pertanto, sebbene l’espressione dell’antigene degli OVULI fosse limitata alle cellule β innestate, abbiamo ipotizzato che la presentazione di OVULI derivati dalle cellule β mediante APC non parenchimale come DC tramite presentazione incrociata sarebbe necessaria per l’innesco LN e forse per le risposte locali delle cellule t17,18.

Cellule OT-I divise (CD45.1+CD8+Va2+ gate vitali) in drenaggio LN renale e innesto 3 o 6 giorni dopo il ricevimento di un singolo innesto di 400 B6.Isole ßOVA. (a) Diagrammi rappresentativi della citometria a flusso. La posizione del picco OT-I indiviso è stata determinata utilizzando il controllo “nessun antigene” di un innesto di isolotto B6. b) Numero totale di OT-I divisi in LN renale e innesto in cui ogni punto rappresenta un singolo topo. Dati raccolti da sette esperimenti indipendenti: n = 8 pazienti trapiantati al giorno 3 e n = 14 pazienti trapiantati al giorno 6. Un giorno 6 innesto è stato perso a causa di un malfunzionamento del citometro a flusso. Le barre orizzontali sono mezzi, i valori P sono stati calcolati mediante test t a due code spaiati con correzione di Welch.
Le cellule T CD8 + si espandono nel sito di infiammazione
Come previsto, una potente risposta OT-I è stata rilevata per prima nel LN renale che drena il sito dell’innesto e ciò dipendeva dalla presenza dell’antigene OVULO (Fig. 1 bis, lettera b). A 3 giorni dopo l’innesto, OT-I diviso potrebbe essere rilevato in LNs drenante B6.ßOVA innesti isolotto (Fig. 1a) ed erano abbondanti (Fig. 1b, media=9,2 × 104). Al contrario, 100 volte meno cellule OT-I divise potrebbero essere rilevate all’interno di B6.Innesti ßOVA (Fig. 1a, b, media=6,6 × 102). Il numero di cellule OT-I divise è aumentato di 300 volte nel sito dell’innesto dal giorno 3 al giorno 6 (Fig. 1b, media=6,6 × 102 al giorno 3 a 2,1 × 105 al giorno 6, P <0,0001, test t a due code spaiato con correzione di Welch) mentre non vi è stato alcun aumento del LN (Fig. 1 ter). La risposta OT-I in B6.Gli innesti di ßOVA potrebbero essere spiegati dall’infiltrazione di cellule OT-I che si erano proliferate nell’LN. Tuttavia, i profili CFSE erano diversi tra i siti di innesto e LN poiché le cellule OT-I negli innesti erano più altamente divise rispetto a quelle nel LN al giorno 6 (Fig. 1 bis). Ci sono almeno due possibili spiegazioni per questa differenza. Solo le cellule che si erano divise molte volte si sono infiltrate nell’innesto. In alternativa, le cellule che raggiungono l’innesto si sono divise più rapidamente, probabilmente a causa dell’abbondanza di antigene disponibile. L’aumento del numero assoluto di cellule nell’innesto rispetto a LN al giorno 6 ci ha portato a indagare su quest’ultima spiegazione.
L’interazione affine con le isole promuove l’espansione
Per determinare il possibile contributo di MHC affine nell’innesto all’espansione locale abbiamo usato isole derivate da bm1.ßOVA topi (Tabella supplementare 1). In bm1.ßOVA topi, la molecola H-2Kbm1 non è in grado di presentare il peptide OVA257–264 a causa di tre mutazioni a H-2Kb (ref. 19). Un confronto delle risposte a B6.ßOVA e bm1.Gli innesti di isole ßOVA hanno dimostrato che, nonostante risposte OT-I simili nel LN renale drenante, l’espansione di OT-I è stata ridotta di sei volte in bm1.ßOVA rispetto a B6.Innesti ßOVA (media=4.7 × 104 rispetto a 2,6 × 105 diviso OT-I; P=0,0153 t-test a due code spaiato con correzione di Welch; Fig. 2 bis). Questa espansione meno efficiente delle cellule OT-I infiltranti bm1.Gli innesti di ßOVA hanno suggerito che le interazioni affini con le cellule insulari innestate hanno contribuito all’espansione locale delle cellule T.

Analisi di citometria a flusso di cellule OT-I (CD45.1+CD8+Va2+ gate vitali) 6 giorni dopo l’innesto. (a) Totale diviso OT-I nel LN renale drenante e trapianto dopo aver ricevuto un singolo innesto di 400 B6.ßOVA o bm1.Isole ßOVA. Dati per B6.ßOVA topi innestati sono un sottoinsieme di quello mostrato in Fig. 1b. Ogni punto rappresenta un singolo mouse. I dati raccolti da due esperimenti indipendenti sono mostrati in ogni pannello: n = 5 destinatari di B6.ßOVA innesti, e n = 6 destinatari di bm1.Innesti ßOVA. Le barre orizzontali sono mezzi, i valori P sono stati calcolati mediante test t a due code spaiati con correzione di Welch. (b) Schema del modello bipolare dell’innesto in cui gli innesti di 200 isolotti sono disposti ai poli opposti dello stesso rene e condividono un LN renale drenante comune. Totale diviso OT-I in c) B6.ßOVA e KbKO.ßOVA innesti bipolari e (d) B6.ßOVA e B6 innesti bipolari (n = 5 topi riceventi raggruppati da due esperimenti indipendenti in ciascuno di c e d) I dati per lo stesso topo sono collegati da linee tratteggiate: i valori P sono stati calcolati dal rapporto accoppiato t-test.
Per eliminare qualsiasi contributo da H-2Kbm1 alloantigen abbiamo generato KbKO.Topi ßOVA che esprimono l’antigene degli OVULI nelle cellule beta delle isole ma mancano di alloantigene o H-2Kb (Tabella supplementare 1). Abbiamo quindi utilizzato un “modello di innesto bipolare” per confrontare le risposte a B6.ßOVA e KbKO.Gli innesti dell’isolotto ßOVA posti ai poli opposti dello stesso rene in un topo ospite B6 in modo tale che le cellule T infiltranti l’innesto sono state derivate da cellule T innescate nello stesso LN (Fig. 2 ter). C’erano 10-100 volte più cellule T presenti in B6.ßOVA di KbKO.Innesti ßOVA (Fig. 2 quater). Utilizzando il rapporto di OT-I diviso ai poli opposti del rene calcolato per i singoli topi, abbiamo derivato un rapporto di risposta relativa (RRR). L’RRR ha indicato che l’espansione locale delle cellule T era 26 volte maggiore quando si verificava l’impegno cognato con le cellule dell’innesto (RRR=26,4±14,1 in B6.ßOVA: KbKO.ßOVA innesti, P = 0,0025, rapporto accoppiato t-test, Fig. 2 quater).
Abbiamo anche confrontato le risposte al bipolare B6.Innesti ßOVA e B6 (senza antigene) (Fig. 2d). Pochissimi OT-I potrebbero essere rilevati all’interno di innesti B6 (Fig. 2d) e riteniamo probabile che molti di questi erano circolanti OT-I derivato dalla contaminazione del sangue. Pertanto, l’infiammazione non specifica associata al trapianto di innesti privi di antigene non porta ad un’espansione efficiente delle cellule T all’interno del tessuto infiammato. Al contrario, la risposta a B6.Gli innesti ßOVA erano di nuovo molto potenti e più di 900 volte superiori a quelli degli innesti B6 (RRR=950±252 per B6.ßOVA: innesti B6, P < 0,0001, rapporto accoppiato t-test, Fig. 2d).
Insieme questi esperimenti hanno indicato che l’espansione delle cellule T CD8 all’interno del tessuto bersaglio infiammato è stata significativamente promossa dalla presentazione locale dell’antigene. Ciò non esclude necessariamente altri contributi all’espansione delle cellule T, ad esempio, presentando CC ospite nell’innesto. Abbiamo solo aver che l’interazione affine tra le cellule T e le cellule isolette si traduce in una sostanziale espansione delle cellule T.
Non è richiesta l’interazione affine con i leucociti residenti
Le isole sono gruppi complessi di cellule che includono cellule β, cellule endoteliali e leucociti residenti nell’isolotto (IRL). Pertanto, abbiamo cercato di chiarire quali cellule isolette presentavano l’antigene alle cellule T infiltranti per guidare l’espansione delle cellule T. Il candidato più ovvio sarebbe IRL. Queste cellule CD45+ sono state variamente definite come DC o macrofagi, co-esprimono CD11c e F4 / 80 e hanno dimostrato di elaborare e presentare antigeni 20,21,22,23. Abbiamo quindi esaminato il ruolo dell’IRL donatore nel guidare l’espansione locale delle cellule T CD8. B6.I topi ßOVA sono stati incrociati con CD11c. DTR.Topi GFP per ottenere CD11c. DTR.GFP.Topi ßOVA le cui cellule β esprimono gli OVULI e le cui cellule CD11c + potrebbero essere ablate mediante iniezione di tossina difterica (DT) 8. Abbiamo prima testato da FACS che isolotti isolati da CD11c. DTR.I topi GFP trattati con DT erano esauriti di cellule CD11c + (Fig. 3 bis, lettera b). CD11c + IRL nei topi di controllo non trattati sono stati identificati mediante colorazione per CD45 e CD11c e la loro espressione del reporter GFP e sono stati chiaramente esauriti dal trattamento DT (Fig. 3a, b, P=0,0002, test t a due code spaiato con correzione di Welch). Abbiamo anche confermato che il CD11c + IRL co-espresso F4/80 e H-2 Kb MHC classe I (Fig. 2a) e di conseguenza le cellule F4/80 + sono state esaurite anche dalle isole di topi trattati con DT (Fig. 2 ter). CD11C.DTR.GFP.Isole ßOVA isolate da topi non trattati e trattati con DT sono state innestate ai poli opposti dello stesso rene. Il numero OT-I diviso era simile tra gli innesti, indicando che la deplezione dell’IRL non aveva alcun effetto sull’espansione delle cellule T CD8 + nel sito dell’innesto (Fig. 3 quater). Per confermare che l’IRL non era importante per l’espansione locale delle cellule T CD8, abbiamo eseguito una seconda serie di esperimenti. KbKO.I topi ßOVA sono stati irradiati e ricostituiti con midollo osseo KbKO o B6 (BM) per generare una fonte di isole ßOVA in cui l’espressione di H-2Kb era assente da tutte le cellule o ripristinata selettivamente in IRL (Fig. 3d). Il confronto di tali isolotti nel modello di innesto bipolare ha mostrato livelli simili di espansione delle cellule OT-I in entrambi gli innesti (Fig. 3 e). Quindi, gli IRL non sono i principali driver dell’espansione locale delle cellule T CD8.

Analisi di citometria a flusso che mostra l’esaurimento di CD11c + IRL in CD11c. DTR.Topi GFP trattati con DT: (a) Grafici rappresentativi che mostrano il gating di CD11c+IRL nelle isole da topi di controllo non trattati e il loro esaurimento il giorno successivo a un singolo trattamento DT e (b) enumerazione di CD11c+IRL in topi non trattati e trattati DT. Ogni punto rappresenta una preparazione individuale di isolette contenente isolotti raggruppati da 1 a 8 topi, n = 5 preparati di isolotti non trattati e 6 preparati di isolotti trattati DT raggruppati da quattro esperimenti indipendenti. Valore P calcolato mediante test t non accoppiato a due code con correzione di Welch. (c) Totale diviso OT-I a 6 giorni dopo l’innesto bipolare di isolotti ottenuti da CD11c.DTR.GFP.Topi ßOVA non trattati o trattati con DT (n = 6 topi riceventi raggruppati da due esperimenti indipendenti). I dati per lo stesso mouse sono collegati da linee tratteggiate; Valori P calcolati dal rapporto accoppiato t-test. d) Grafici rappresentativi che mostrano assenza o presenza di espressione di H-2Kb su CD11C+IRL di topi KbKO ricostituiti rispettivamente con KbKO o B6 BM. Su cellule vitali. (e) Totale diviso OT-I a 6 giorni dopo l’innesto bipolare di isolotti ottenuti da topi chimerici (n=3 topi riceventi da un singolo esperimento). I dati per lo stesso mouse sono collegati da linee tratteggiate; Valori P calcolati per rapporto accoppiato t-test.
L’interazione affine con le cellule parenchimali è importante
B6.I topi RIP-Kb esprimono transgenicamente H-2Kb nelle cellule β sotto il controllo del promotore dell’insulina di rato24. Incrociando questi topi a KbKO.ßOVA topi abbiamo generato KbKO.ßOVA.Topi ßKb in cui l’espressione di H-2Kb era limitata alle cellule β (Tabella supplementare 1). L’espressione di H-2Kb sulle cellule β è stata confermata dall’analisi FACS delle isole (Fig. 4 bis). Abbiamo gated sulle cellule ematopoietiche dell’isolotto (CD45+) e sulle cellule endoteliali (CD31+) e abbiamo dimostrato che H-2Kb non è stato espresso su queste cellule in entrambi i KbKO.ßOVA o KbKO.ßOVA.Topi ßKb rispetto all’espressione forte nei topi B6 (Fig. 4 bis). Le restanti cellule CD45-CD31 sono autofluorescenti positive e arricchite nelle cellule endocrine. Analisi FACS di isolotti da KbKO.ßOVA.I topi ßKb hanno mostrato un’espressione di H-2Kb all’interno della popolazione autofluorescente arricchita con cellule β a livelli simili a quelli osservati nelle isole B6 (Fig. 4 bis). Il confronto nel modello di innesto bipolare ha indicato che l’espansione di OT-I era 14 volte maggiore quando l’antigene affine era espresso su cellule β (RRR=14,0±4,1 per KbKO.ßOVA.KbKO.ßOVA innesti, P = 0.0008, rapporto accoppiato t-test, Fig. 4 ter).

(a) Diagrammi di citometria a flusso (gated su cellule vitali) che mostrano il ripristino selettivo dell’espressione di H-2Kb sulle cellule parenchimali. Gli istogrammi rappresentano isolotti da KbKO (ombreggiato), B6 (tratteggiato) o KbKO.ßKb (bold) topi. (b) Totale diviso OT-I a 6 giorni dopo l’innesto bipolare di KbKO.ßOVA e KbKO. ßOVA.ßKb. isolotti (n = 6 topi riceventi raggruppati da tre esperimenti indipendenti). I dati per lo stesso mouse sono collegati da linee tratteggiate; Valori P calcolati dal rapporto accoppiato t-test.
Le cellule T proliferano nel sito di infiammazione
I nostri risultati di cui sopra indicano che c’era proliferazione locale nel sito bersaglio. Al fine di rilevare cellule proliferanti attivamente abbiamo incrociato topi OT-I /CD45.1 a topi FucciRG per generare FucciRG/OT-I/CD45.1 topi (abbreviato FucciOT-I). In tali topi, le cellule fluorescono rosso (FucciR) durante G0/G1 e verde (FucciG) durante le fasi del ciclo cellulare S/G2/m25,26. La degradazione graduale e l’accumulo dei reporter FucciR e FucciG durante la transizione tra le fasi del ciclo consente di effettuare ulteriori distinzioni: espressione FucciR più intensa nelle cellule G0 quiescenti rispetto alle cellule G1 cicliche, doppie cellule FucciR−G negative nei primi G1 e cellule FucciR+G+ debolmente doppie positive in G1/S (refs 26, 27). Le cellule FucciOT-I quiescenti di topi non innestati erano FucciG – (Fig. 5a, pannello superiore, ungrafted). Per evitare interferenze con i coloranti Fucci abbiamo sostituito CFSE con CTV. Nei topi che avevano ricevuto B6.Gli innesti ßOVA, l’analisi della diluizione CTV ha indicato che il FucciOT-I diviso era presente nel LN renale drenante e alcuni di questi erano FucciG + indicativi di divisione cellulare attiva (Fig. 5a, pannello superiore, drenante LN). Nel sito di innesto, abbiamo rilevato FucciOT-I che aveva subito molte divisioni (CTV non più rilevabile) e molti di questi erano FucciG+ supporto della proliferazione in corso (Fig. 5a, pannello superiore, innesto fresco). Confronto della proporzione di cellule FucciG + all’interno della popolazione OT-I divisa (Fig. 5c) ha indicato che la proliferazione in corso all’interno di innesti freschi (26,8±8,8% FucciG+) ha superato quella nel LN renale drenante (7,3±1,6%, P=0,008, test t a due code non accoppiato con correzione di Welch) o LN renale non drenante (2,1±2,1%, P=0,003, test t a due code non accoppiato con correzione di Welch). Infatti, l’esame sia dell’espressione FucciG che di quella FucciR indicava che la maggior parte degli OT-I infiltranti l’innesto si divideva attivamente, cioè pochissime cellule mostravano un’alta espressione di FucciR che era una caratteristica delle cellule quiescenti nel LN dei topi non innestati (Fig. 5a, pannelli inferiori). Sebbene abbiamo ipotizzato che questa proliferazione nel sito dell’infiammazione sia stata generata in situ, non abbiamo potuto scartare completamente la possibilità che ciò riflettesse semplicemente il recente arrivo di cellule proliferanti. Per chiarire questo, abbiamo raccolto gli innesti bipolari di B6.ßOVA isolotti per analizzare un innesto subito dopo l’asportazione, e coltura l’altro innesto per 1 giorno (Fig. 5 bis). Mentre il numero di OT-I non è aumentato durante il periodo di coltura (Fig. 5b), presumibilmente riflettendo la morte cellulare in condizioni ex-vivo non ottimali, molte cellule FucciG + OT-I hanno continuato a essere rilevate (14,2±4,2% FucciG+, Fig. 5 quater). Il profilo dell’innesto coltivato, senza possibile reclutamento per un giorno, indicherebbe che c’era un’alta proliferazione de novo nell’innesto.

(a) Diagrammi di citometria a flusso schematica e rappresentativa (gated su linfociti CD45.1+CD8+Va2+ vitali) che mostrano la risposta delle cellule FucciOT-I in LNs renale o bipolare B6.Innesti ßOVA. LNs e l’innesto da un polo sono stati esaminati immediatamente (fresco a 6 giorni dopo l’innesto) mentre l’innesto dal polo opposto è stato coltivato per 1 giorno prima dell’analisi. LN da un topo non grafted è stato incluso per mostrare assenza di divisione e espressione FucciG (pannello superiore) e predominanza di celle alte FucciR (pannello inferiore) in FucciOT-I quiescente. (b) FucciOT-I diviso totale in innesti freschi e coltivati. Media + s. d., n=5, valori P calcolati dal rapporto a due code accoppiato t-test. (c) % FucciG+ diviso OT-I in innesti renali freschi non drenanti e drenanti per innesto, nonché innesti freschi e coltivati. Media + s. d., n=5 ad eccezione di LN non drenante per cui n=4 a causa della perdita di un LN durante la lavorazione. I valori di P sono stati calcolati mediante test t spaiato a due code con correzione di Welch. I dati sono raggruppati da due esperimenti indipendenti.
L’interazione cognata con le cellule parenchimali spinge la proliferazione
Abbiamo poi approfittato del modello FucciOT-I per valutare il ruolo di un altro potenziale driver locale della proliferazione delle cellule T nell’innesto, APC derivato dall’ospite come DC infiammatorio. Al fine di eliminare qualsiasi contributo di host APC abbiamo prima derivato uno sfondo KbKO. Poiché i topi KbKO rifiutavano le cellule OT-I, abbiamo creato KbKO BM in chimere B6 da utilizzare come host; quindi le cellule ematopoietiche mancavano di H-2Kb ma erano permissive delle cellule OT-I. A queste chimere sono state somministrate cellule FucciOT-I T e innesti bipolari di KbKO.Isole ßOVA (prive di espressione H-2Kb e quindi della capacità di presentare l’antigene OVULI) e KbKO.ßOVA.Isole ßKb (sia l’antigene H-2Kb che l’antigene OVA erano limitati alle cellule β). Poiché la chimaera mancava di APC H-2Kb positivo, è stato necessario somministrare OVA257-264 cellule della milza rivestite di peptidi per avviare la risposta OT-I. Il successo di questo priming è stato dimostrato dalla diluizione CTV nelle cellule FucciOT-I nel LN renale, sebbene al momento del raccolto queste fossero FucciG− e non sembrassero essere attivamente divise (0.1±0.0% FucciG+, Fig. 6 bis, lettera d). Pochissimi OT-I si sono infiltrati nel KbKO.Gli innesti ßOVA ma sono stati chiaramente espansi all’interno di KbKO.ßOVA.Innesti ßKb (RRR di 61,4±26,6 per KbKO.ßOVA.KbKO.ßOVA, Fig. 6b, P = 0.0008, rapporto a due code accoppiato t-test). Pertanto, anche in assenza di antigene affine sull’APC ospite, l’antigene affine sulle cellule β parenchimali era sufficiente a guidare l’espansione delle cellule T CD8 nel sito dell’innesto. Le poche cellule FucciOT-I T presenti in KbKO.Gli innesti ßOVA assomigliavano a quelli del LN sia in termini di progressione inefficiente verso la frazione altamente divisa (Fig. 6a, c, 7,5±0,9% altamente diviso in LN e 19,3±3,3% altamente diviso in KbKO.ßOVA innesti) e la mancanza di espressione FucciG (Fig. 6a, d, 0,1±0,0% in LN e 0,1±0,1% in KbKO.ßOVA innesti) suggerendo che la piccola proliferazione di OT-I si è verificata nel sito dell’innesto in assenza di antigene affine. Al contrario, l’OT – I all’interno di KbKO.ßOVA.Gli innesti ßKb erano prevalentemente altamente divisi (92,3±1,0%, Fig. 6a, c) e alcuni di questi erano FucciG+ e quindi attivamente proliferanti (Fig. 6a, d, 5,0±1,2% FucciG+). Quindi, la presentazione dell’antigene affine da parte delle cellule β parenchimali dell’isolotto è stata in grado di guidare la proliferazione de novo di FucciOT-I in situ.

Risposta FucciOT-I agli innesti in KbKO BM in topi ospiti B6 in cui le cellule ematopoietiche ospiti mancano di espressione H-2Kb. I topi innestati hanno ricevuto cellule di milza rivestite di peptide il giorno dell’innesto per avviare l’innesco OT-I. (a) Diagrammi rappresentativi di citometria a flusso (gated sui linfociti vitali CD45.1+CD8+Va2+). Il pannello superiore mostra la mancanza di divisione e l’espressione FucciG in OT-I quiescente in LN di un topo che non è stato né innestato né innescato. I tre pannelli inferiori mostrano le risposte in un topo bipolare innestato e innescato: drenante renale LN, KbKO.ßOVA e KbKO.ßOVA.Innesti ßKb. Le cellule divise nei topi innestati sono state divise in due settori con le cellule altamente divise che cadono nel settore in cui il CTV è stato diluito oltre il limite di rilevamento. (b) Totale diviso FucciOT-I in KbKO.ßOVA e KbKO.ßOVA.ßKb innesti bipolari, valori P calcolati dal rapporto a due code accoppiato t-test. (c) % altamente diviso e (d) % FucciG+ OT-I nel drenaggio LN renale e innesti di topi bipolari innestati. I valori P sono stati calcolati mediante test t accoppiati a due code. I risultati per i singoli topi sono collegati da linee tratteggiate, n = 6 topi riceventi raggruppati da due esperimenti indipendenti.
IL-2 è più importante nel sito di infiammazione
Dimostriamo che l’espressione di IL-2Ra era più importante per la proliferazione e l’accumulo di cellule T CD8+ all’interno del parenchima periferico (innesti di isole) rispetto al sito di adescamento nel drenaggio LN (Fig. 7 bis). Inoltre, abbiamo analizzato la risposta in un secondo sito distante dal sito di priming, cioè non drenante LN. Le cellule T CD8 + etichettate con CTV da topi OT-I. IL-2RaKO (IL-2ra−CD45.2+) e OT-I/Ly5.1 (IL-2Ra+, CD45.1+CD45.2+) sono state co-trasferite in topi host B6.CD45.1 (CD45.1+) prima di ricevere un singolo innesto di B6.Isole ßOVA. Le distinte firme alleliche CD45 di ciascuna delle popolazioni di cellule T trasferite (in combinazione con la colorazione per CD8 e Va2) ci hanno permesso di quantificare e confrontare il rapporto tra WT diviso: IL-2RaKO OT – I (Fig. 7a, Fig. supplementare 3). IL-2RA WT ha chiaramente superato IL-2ra KO OT-I nel sito dell’innesto rispetto al drenaggio (P=0,025, test t accoppiato a due code) o al non drenaggio (P=0,044, test t accoppiato a due code) LN. Ciò è coerente con una maggiore dipendenza delle cellule T CD8 + su IL-2 al momento dell’incontro secondario con l’antigene nel sito di infiammazione rispetto a durante l’adescamento iniziale nel LN drenante.
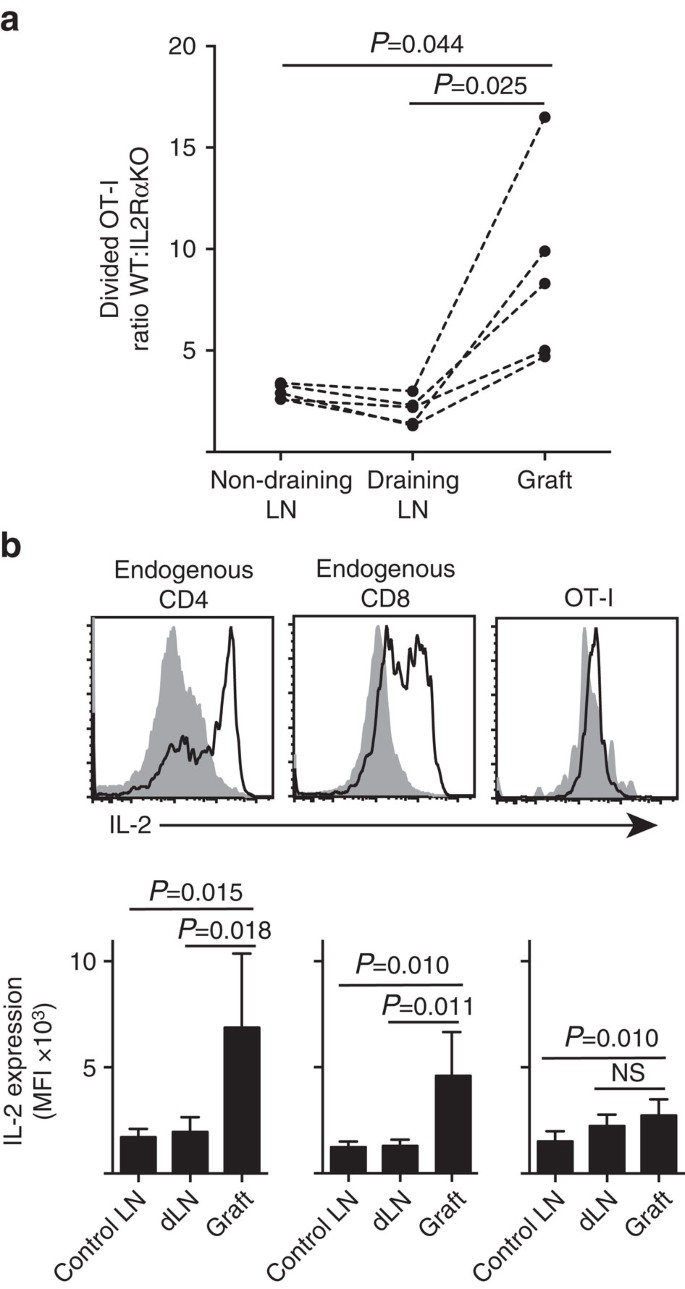
(a) Rapporto tra IL-2RA diviso in peso:cellule IL-2RA KO OT-I recuperate da B6.ßOVA islet graft, drenante LN renale e non drenante LN inguinale dopo co-trasferimento (106 di ciascuno) in topi ospiti B6.CD45.1. I rapporti sono stati calcolati per singoli organi con risultati per singoli topi collegati da linee tratteggiate e confrontati con test t accoppiati a due code. Risultati mostrati per n = 5 topi riceventi e rappresentativi di tre esperimenti indipendenti. (b) espressione di IL-2 in cellule CD4+ e CD8+ endogene e cellule OT-I trasferite in B6 riceventi di B6.ßOVA innesti isolotto. I pannelli superiori mostrano diagrammi rappresentativi di citometria a flusso per innesto drenante LN renale (grigio solido) e innesto (linea nera). I pannelli inferiori riassumono l’intensità fluorescente media (MFI) dell’espressione di IL-2 per LNs renali prelevati da non innestati (LN di controllo), così come l’innesto e il drenaggio LN renale (dLN) di topi innestati. Risultati mostrati come media + s. d., n = 6 raggruppati da due esperimenti indipendenti e confrontati da test t spaiati a due code con la correzione di Welch.
L’accresciuta dipendenza da IL-2 per la proliferazione delle cellule T CD8+ nel sito di infiammazione ha dedotto un requisito per la produzione locale di IL-2. Quindi, abbiamo esaminato il potenziale di varie cellule T (CD4+ e CD8 + derivati dall’ospite endogeno e cellule T CD8 + trasferite OT-I) per la capacità di produrre IL-2 (Fig. 7 ter). Le sospensioni cellulari preparate da innesti o LN sono state brevemente (4 h) restimulate con PMA e ionomicina prima della colorazione per l’espressione di IL-2 intracellulare. L’esame delle cellule T CD4+ e CD8+ derivate dall’ospite endogeno ha fornito prove convincenti della produzione di IL-2 nel sito di infiammazione del trapianto con un chiaro aumento della MFI della colorazione di IL-2 rispetto all’LN drenante o non drenante. I livelli di IL-2 nelle cellule T OT-I CD8+ nel sito di infiammazione erano moderatamente aumentati rispetto a quelli nel LN non drenante, ma non differivano significativamente da quelli nel LN drenante. Un’interpretazione di questi dati è che l’interazione affine di OT – I con le cellule parenchimali induce una rapida proliferazione ma una scarsa produzione di IL-2, tale che gli OT-I dipendono dalla paracrina IL-2 derivata dalle cellule T CD4+ e CD8+ endogene nell’ambiente locale dell’innesto. Tuttavia, un ulteriore esperimento ha indicato che IL-2 esogeno in assenza di antigene parenchimale non poteva guidare l’espansione cellulare OT-I CD8+. IL-2 (HIL-2 ricombinante, 25.000 UI) è stato somministrato per via intraperitoneale a topi B6 che hanno ricevuto innesti bipolari di B6.Isole ßOVA e B6. Il confronto del recupero di OT-I in organi recuperati da IL-2 o topi trattati con veicoli al giorno 6 dopo l’innesto non ha mostrato un aumento significativo dell’accumulo di cellule OT-I divise in due siti privi di antigene parenchimale, vale a dire innesti di isole B6 (3±3 nel veicolo trattato rispetto a 49±64 nei topi trattati con IL-2, P=0.342) e LN inguinale non drenante (1.648+633 nel veicolo trattato rispetto a 1.660+1.023 nei topi trattati con IL-2, P=0,987, media±s.d., n=3, test t spaiato a due code con correzione di Welch).