Una guida ai tumori congiuntivali
I tumori congiuntivali includono uno spettro di neoplasie benigne e maligne.1-5 I tipi differiscono in base all’età e alla razza, allo stato immunitario sistemico e alle esposizioni a lungo termine. Un ampio studio su 5.002 casi da un centro di oncologia oculare ha rivelato che il 52% era benigno, il 18% era premaligno e il 30% era maligno (Tabella 1).1,2 Anche se questo rapporto proveniva da un centro di oncologia oculare e le neoplasie maligne potrebbero essere sovrarappresentate, è importante che i medici comprendano la varietà dei tumori congiuntivali.
I cinque tumori più comuni erano nevo (23%), neoplasia squamosa superficiale oculare (OSSN, 14%), melanosi acquisita primaria (PAM, 12%), melanoma (12%) e tumore linfoide (9%).5 Tumori maligni sono stati osservati più spesso negli adulti e includevano melanoma (12%), carcinoma a cellule squamose (SCC, 9%), linfoma (7%), sarcoma di Kaposi (<1%), metastasi (<1%) e altri.1 I tumori congiuntivali nei bambini dimostrano malignità solo il 3% delle volte.5
Questa recensione dei tumori congiuntivali più comuni ti preparerà a gestirli in modo appropriato, sia nel tuo ufficio che attraverso il rinvio.
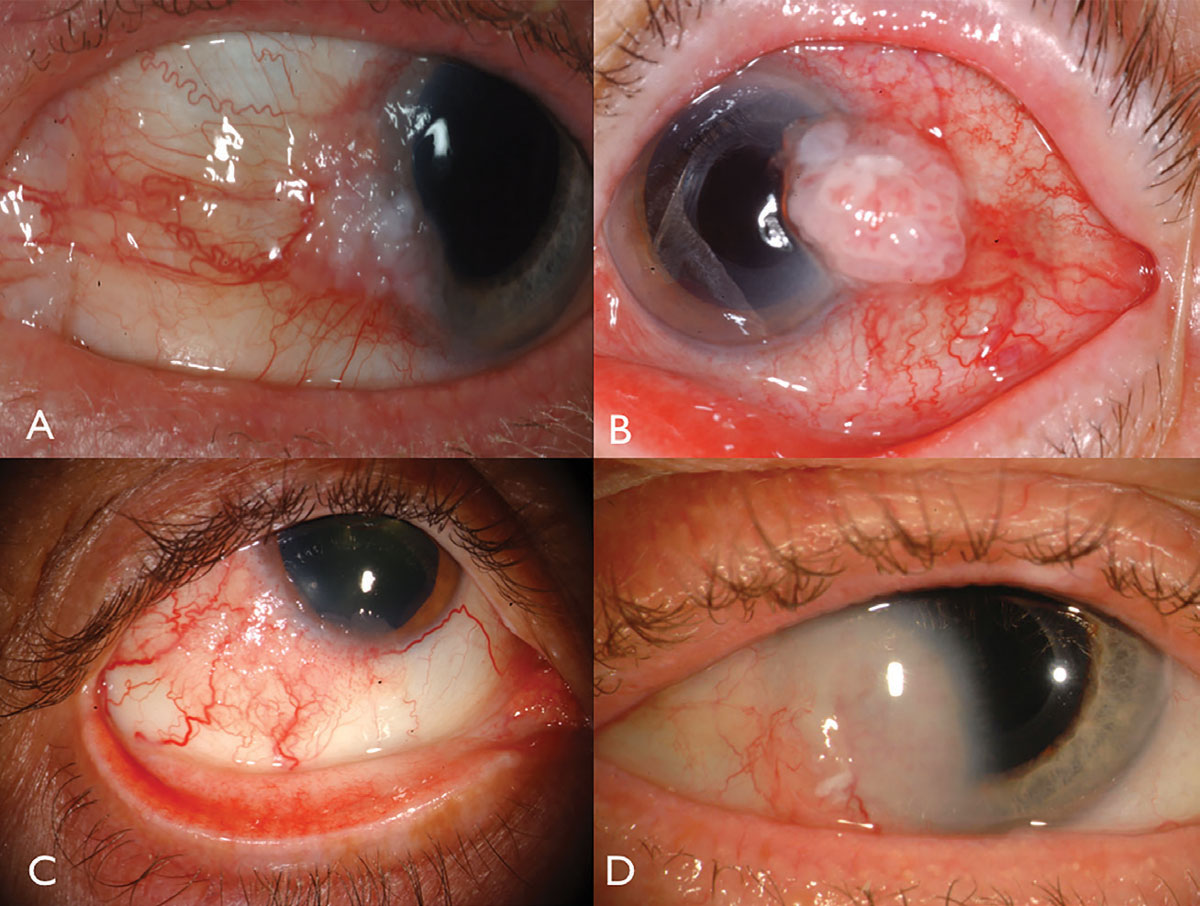
Fig. 1. OSSN limbale: con leucoplachia e coinvolgimento corneale (A), con vascolarizzazione intrinseca prominente e vasi di alimentazione (B), in un paziente HIV (C) e con invasione corneale profonda che richiede resezione e radioterapia a placche (D). Clicca sull’immagine per ingrandirla.
Neoplasia squamosa della superficie oculare
Il termine clinico generale di OSSN include uno spettro di neoplasie maligne che va da lievi alterazioni displastiche epiteliali, come la neoplasia intraepiteliale congiuntivale (CIN), a carcinoma invasivo più grave che invade attraverso la membrana basale nella substantia propria, come il carcinoma a cellule squamose.
Caratteristiche cliniche. L’OSSN congiuntivale si verifica classicamente nei maschi caucasici più anziani, in particolare quelli con esposizione cronica al sole. Negli Stati Uniti, la SCC congiuntivale è cinque volte più comune nei maschi e nei caucasici. Tuttavia, in Africa, SCC congiuntivale è quasi altrettanto comune negli uomini e nelle donne, e si verifica in età più giovane che negli Stati Uniti.6
La neoplasia squamosa della superficie oculare di solito si presenta come una massa gelatinosa vascolarizzata unilaterale, situata nella congiuntiva esposta al sole al limbus nasale o temporale (Figura 1). La leucoplachia sovrastante, i vasi di alimentazione dilatati e l’infiltrazione schiumosa dell’epitelio corneale adiacente possono verificarsi e raramente possono invadere il globo o l’orbita.
Fare clic su tabella per ingrandire.
Fattori predisponenti. I fattori ambientali più importanti per OSSN includono l’esposizione cronica al sole e l’esposizione al fumo di sigaretta. Due fattori predisponenti chiave dell’ospite includono la carnagione chiara e il virus dell’immunodeficienza umana sottostante (HIV) e il papillomavirus umano.6 I pazienti con immunodeficienza, in particolare quelli con HIV, sono a rischio di OSSN e possono avere tumori avanzati, bilaterali e invasivi.1 Questo è particolarmente visto in Africa, dove l’HIV è prevalente e OSSN si verifica sia nei maschi che nelle femmine e in età più giovane.6 Altre disregolazioni immunitarie possono predisporre un paziente all’OSSN, tra cui immunosoppressione da trapianto di organi, eczema / atopia, pemfigoide cicatriziale oculare, xeroderma pigmentoso e condizioni autoimmuni.7
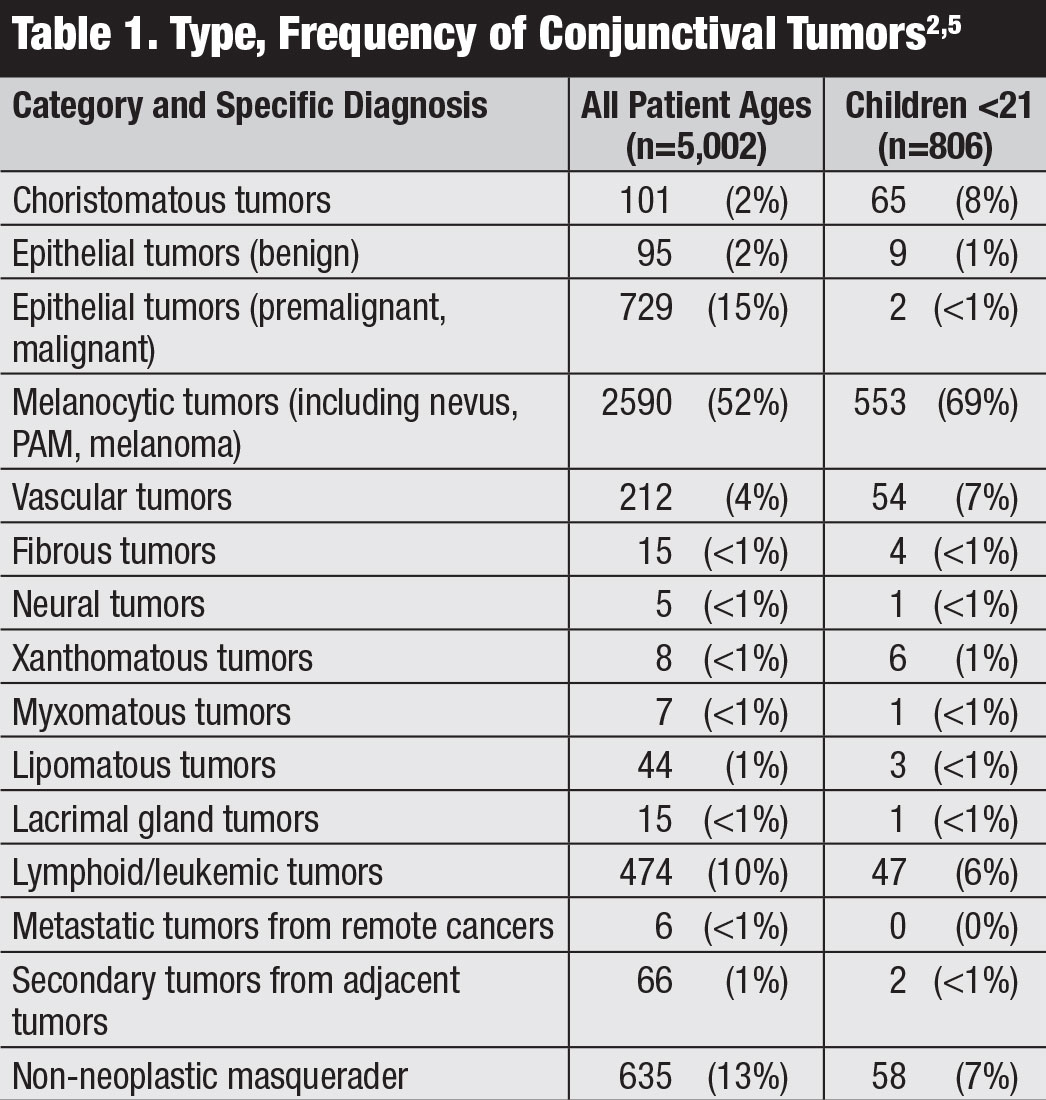
Classificazione. Il manuale dell’8a edizione dell’ American Joint Committee on Cancer (AJCC) fornisce la classificazione più recente per il carcinoma congiuntivale, inclusi SCC e CIN (Tabella 2).8
Gestione. Ciò comporta la resezione chirurgica utilizzando la tecnica “no-touch” o terapie non chirurgiche come la chemioterapia topica con mitomicina C (MMC) o 5-fluorouracile (5-FU), l’immunoterapia topica o iniettata con interferone alfa-2b (IFN), il farmaco antivirale topico (cidofovir) o la terapia fotodinamica.7,9-11
La tecnica chirurgica no-touch prevede una valutazione dettagliata del tumore utilizzando la biomicroscopia a lampada a fessura per visualizzare tutti i margini del tumore, compresi i componenti bulbari, forniceali e tarsali, per comprendere l’intera estensione del tumore e consentire al clinico di disegnare a mano una registrazione del modello.9 Questo modello poi è preso nella chirurgia per assicurare l’intero tumore è rimosso.
Al momento dell’intervento chirurgico, solo il tessuto normale circostante viene tenuto con una pinza e il tumore non viene mai toccato per evitare la semina del tumore. Inoltre, la soluzione salina bilanciata non viene impiegata durante l’intervento chirurgico per evitare la dispersione liquida delle cellule tumorali. Dopo la rimozione del tumore, la chiusura con strumenti puliti è fondamentale. Usando questa tecnica per OSSN, la persistenza o la ricorrenza del tumore si trova in meno del 5% dei casi.
Fare clic su tabella per ingrandire.
La chemioterapia topica con 5-FU o MMC è efficace nella risoluzione dell’OSSN, spesso entro due o quattro settimane di terapia, sebbene esista un rischio di carenza di cellule staminali. La nostra preferenza terapia topica è l’immunoterapia con IFN, in quanto è ben tollerato con un buon controllo del tumore, spesso più di tre mesi e con poche complicazioni e solo congiuntivite follicolare minore.10,11 Questi farmaci possono essere localmente tossici per l’epitelio corneale, ma meno con l’interferone, e i pazienti devono essere seguiti da vicino mentre sono su di essi. Se il costo è un fattore per il paziente, topico 5-FU è il meno costoso, seguito da MMC e poi IFN.
Tumori linfoidi congiuntivali
Le neoplasie linfoidi vanno da tumori di basso a alto grado e derivano dalla proliferazione monoclonale dei linfociti. I tumori linfoidi che si verificano nella regione perioculare spesso coinvolgono diversi tessuti come la congiuntiva, l’orbita e la palpebra e sono definiti tumori linfoidi “annessiali oculari”, tra cui iperplasia linfoide reattiva benigna (BRLH) e linfoma.
Il BRLH e il linfoma si trovano agli estremi opposti dello spettro, con il BRLH che appare clinicamente come “patch di salmone” localizzato e istopatologicamente benigno, mentre il linfoma appare anche come “patch di salmone” ma con caratteristiche istopatologiche più aggressive, con attività mitotica e classificato come maligno.
I tumori linfoidi annessiali oculari sono tipicamente di origine delle cellule B. Uno studio multicentrico su 268 pazienti con linfoma congiuntivale ha trovato i quattro tipi più comuni inclusi linfoma extranodale a zona marginale (ENMZL, precedentemente definito tessuto linfoide associato alla mucosa) nel 68%, linfoma follicolare (FL) nel 16%, linfoma a cellule mantellari (MCL) nel 7% e linfoma diffuso a grandi cellule B (DLBCL) nel 5%.12 Altri tipi di linfoma congiuntivale includono linfoma linfoplasmacitico e plasmocitoma.
Caratteristiche cliniche. Il linfoma congiuntivale di solito si presenta nei pazienti più anziani di età compresa tra 60 e 70 anni. Questo tumore può manifestarsi come linfoma primario, limitato alla regione perioculare, o come linfoma secondario con malattia altrove. La maggior parte dei linfomi primari si verifica con ENMZL e FL e linfoma secondario con DLBCL e MCL. Un’analisi di 117 pazienti con linfoma congiuntivale ha rilevato un coinvolgimento sistemico nel 31%, il più delle volte in quelli con linfoma annessiale oculare multifocale bilaterale.13
Il linfoma congiuntivale si manifesta classicamente come una massa subcongiuntivale color salmone rosa, a superficie liscia, a volte con vasi di alimentazione (Figura 2). Questa massa liscia e multilobulata può assomigliare alla congiuntivite follicolare o papillare. Questo tumore si trova più spesso nel fornice congiuntivale (44%) o nella regione midbulbare (42%) e, raramente, nel caruncolo (7%) o nel limbus (7%).13 Oltre alla congiuntiva, il linfoma può essere trovato infiltrando l’orbita, la palpebra o l’uvea.13 La maggior parte dei pazienti con linfoma congiuntivale non presenta una componente intraoculare, ma se presente, risiede generalmente nell’uvea e non nella retina o nel vitreo.
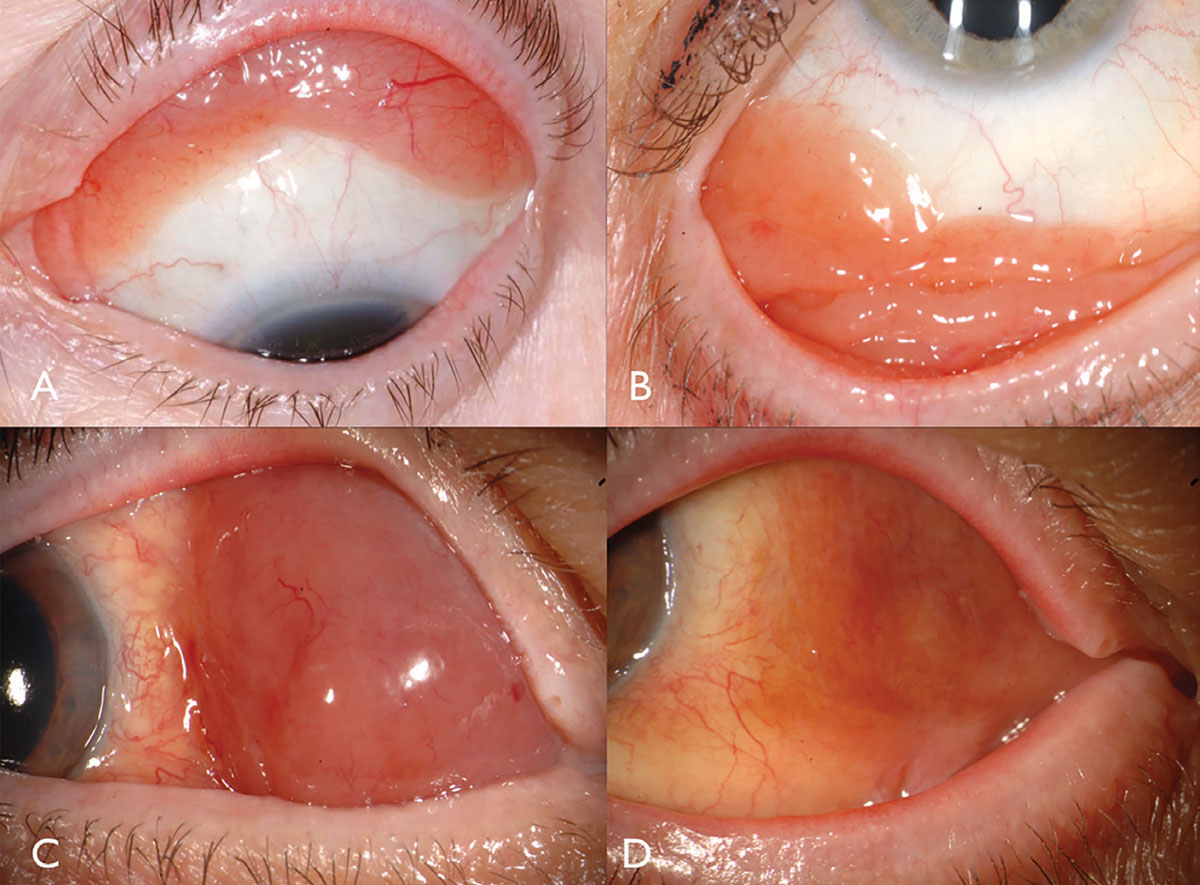
Fig. 2. Conjunctival lymphoma can be salmon-pink (A) or multilobulated forniceal (B). Medial forniceal conjunctival lymphoma before (C) and after (D) ritiximab. Click image to enlarge.
Predisposing factors. Immune dysfunction and autoimmune conditions, as well as infective etiologies such as Helicobacter pylori and Chlamydia psittaci are all predisposing factors for conjunctival lymphoma. BRLH può essere un potenziale precursore di linfoma e, mentre prevalentemente trovato negli adulti, può occasionalmente verificarsi nei bambini.5 Infatti, più giovane è il paziente al momento della diagnosi di un tumore linfoide congiuntivale, più è probabile che sia BRLH e non linfoma.
Classificazione. Esistono diverse classificazioni per il linfoma congiuntivale, tra cui Ann Arbor, Organizzazione Mondiale della Sanità e AJCC 8a edizione staging (Tabella 3).8 La stadiazione clinica AJCC si basa sulla posizione del tumore, sul linfonodo regionale e sul coinvolgimento a distanza.8
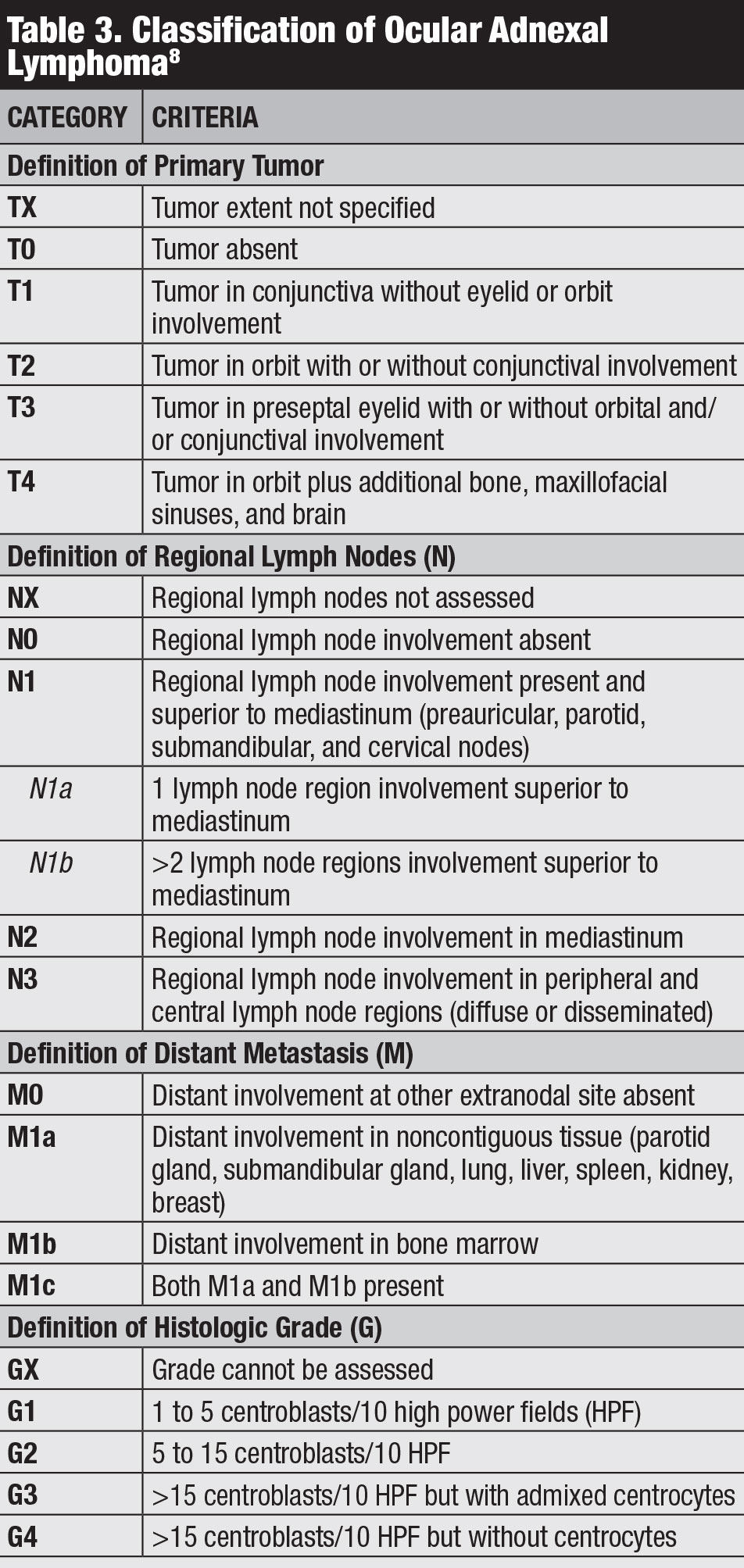
Fare clic su tabella per ingrandire.
Gestione. La cura dei pazienti con linfoma congiuntivale dipende principalmente dall’entità del coinvolgimento perioculare, dal coinvolgimento sistemico e dalla loro salute generale. Nei pazienti con solo linfoma congiuntivale e nessun coinvolgimento sistemico, il trattamento è focalizzato sulla resezione chirurgica completa. Il trattamento con radioterapia a fascio esterno o rituximab sono opzioni se il tumore non è resecabile. Per quelli con linfoma perioculare e sistemico, il trattamento con rituximab sistemico o l’aggiunta di chemioterapia sono considerazioni.
La prognosi sistemica con linfoma congiuntivale è direttamente correlata a ciascun sottotipo, poiché uno studio ha rilevato che la sopravvivenza a cinque anni era del 97% per ENMZL, dell ‘ 82% per FL, del 55% per DLBCL e solo del 9% per MCL.12
Melanoma congiuntivale
I tumori melanocitici congiuntivali sono indiscutibilmente comuni, rappresentando più del 50% dei casi in una grande serie di tumori congiuntivali da un’unità di oncologia oculare.1,2 Questa classe di tumori melanocitici comprende molti tipi come nevo, melanosi correlata alla carnagione, PAM, melanosi acquisita secondaria, melanoma e metastasi.1-5 In alcuni continenti in cui i pazienti hanno carnagioni scure, anche OSSN può apparire melanocitico. Di queste lesioni, il nevo congiuntivale rappresenta il 45% e il melanoma congiuntivale primario rappresenta il 23% di tutti i tumori melanocitici in una pratica oncologica oculare.2
Negli Stati Uniti, l’incidenza aggiustata per età del melanoma congiuntivale è raddoppiata tra il 1973 e il 1999 da 0,27 per milione a 0,54 per milione.14,15 L’incidenza è aumentata 295% negli uomini bianchi negli Stati Uniti nello stesso periodo di 27 anni, specialmente tra gli uomini di età pari o superiore a 60 anni.14 Ricercatori ipotizzano che il tasso crescente possa essere correlato all’esposizione alla luce ultravioletta.
Caratteristiche cliniche. Il melanoma congiuntivale è una neoplasia pigmentata o non pigmentata che può derivare da PAM, nevo o de novo.16 Il melanoma può essere trovato sulla congiuntiva limbale, bulbare, forniceale o palpebrale e spesso dimostra alimentatore dilatato, tortuoso e vasi intrinseci tipicamente circondati da PAM piatto (Figura 3). In generale, i tumori che misurano uno spessore superiore a 2 mm sono a rischio significativo di metastasi linfonodali. L’invasione tumorale nell’orbita è particolarmente grave con un rischio metastatico sostanziale.
Recidiva tumorale locale o nuovo tumore si trova nel 50% dei casi, spesso legati alla nuova trasformazione PAM. Metastasi a distanza – spesso alla catena preauricolare, sottomandibolare o linfonodale cervicale-si trova nel 25% dei pazienti. La biopsia del linfonodo sentinella può aiutare i medici a valutare l’infiltrazione del linfonodo subclinico. Le recidive multiple, specialmente quelle che coinvolgono l’orbita, richiedono l’esenterazione orbitale.
Fattori predisponenti. Il fattore predisponente più importante per il melanoma congiuntivale è la presenza di nevo congiuntivale di lunga data o PAM.16-18 Studiando l’origine del melanoma congiuntivale mediante istopatologia, i ricercatori hanno scoperto che l’origine era PAM nel 74%, de novo nel 19% e nevo nel 7%.16 Studi clinici stimano che uno su 300 nevi si sviluppi in melanoma.17,18
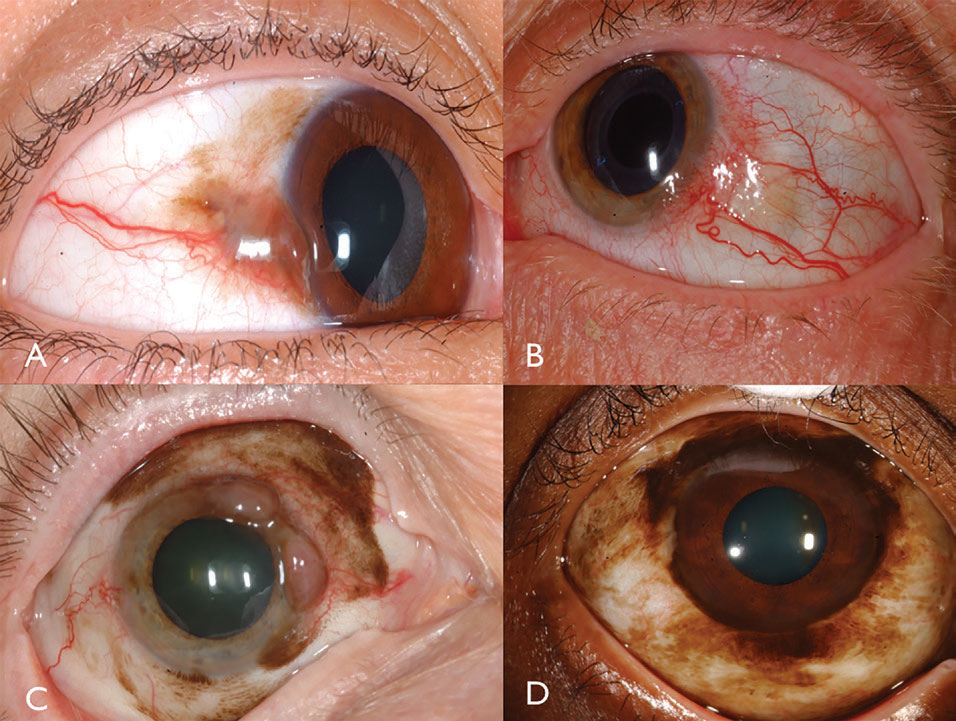
Fig. 3. Il melanoma congiuntivale pigmentato può derivare da PAM (A). Il melanoma congiuntivale non pigmentato può avere una vascolarizzazione intensa (B). PAM potrebbe anche causare melanoma congiuntivale misto pigmentato / non pigmentato (C). PAM ha causato melanoma limbare in questo paziente afro-americano (D). Clicca sull’immagine per ingrandirla.
Un ampio studio clinico ha rilevato che il rischio di 10 anni per la trasformazione di PAM in melanoma era di circa il 9% e la maggiore estensione di PAM promuoveva un maggiore rischio di trasformazione in melanoma.19 Quindi, è importante identificare PAM e trattare questa condizione con escissione chirurgica, crioterapia e persino cheratectomia superficiale (se c’è coinvolgimento corneale) con l’intenzione di prevenire il melanoma.
La differenziazione del nevo congiuntivale dal melanoma può essere impegnativa. In una recente analisi di 510 casi di nevo congiuntivale vs. melanoma nei bambini, il melanoma era più comune nei bambini più grandi, con un rischio relativo (RR) di 4.80, maggiore spessore del tumore (RR di 1.14), maggiore base (RR di 4.92), emorragia tumorale (RR di 25.30) e privo di cisti intrinseche (RR di 5.06).5 I ricercatori hanno assegnato queste caratteristiche, predittive del melanoma congiuntivale nei bambini, a un mnemonico: CATCH Melanoma, che rappresenta: Bambini di età superiore, Spessore / base maggiore, Cisti carente, Emorragia per il melanoma.5
La differenziazione di PAM dal melanoma può anche essere impegnativa; tuttavia, il melanoma ha uno spessore e PAM è completamente piatto. In un’analisi di 1.224 casi di PAM vs. melanoma in tutte le età, il melanoma con significativamente maggiore in base all’età media del paziente (54 vs. 61 anni); sesso maschile (35% vs. 49%); posizione in fornix (2% vs. 6%) e tarso (1% vs. 4%); più grande diametro basale mediano (6mm vs. 8mm), spessore (<1mm vs. 48%) e vasi intrinseci (4% vs. 33%); e emorragia (<1% vs. 3%).2
I biomarcatori tissutali sono importanti per la valutazione del melanoma congiuntivale e comprendono la mutazione BRAF, la mutazione TERT promoter e la mutazione PTEN.1 L’identificazione di questi biomarcatori è fondamentale quando si pianifica una terapia sistemica per il trattamento o la prevenzione delle metastasi, poiché sono disponibili terapie mirate contro alcuni biomarcatori, come vemurafenib per la neoplasia maligna mutata da BRAF.
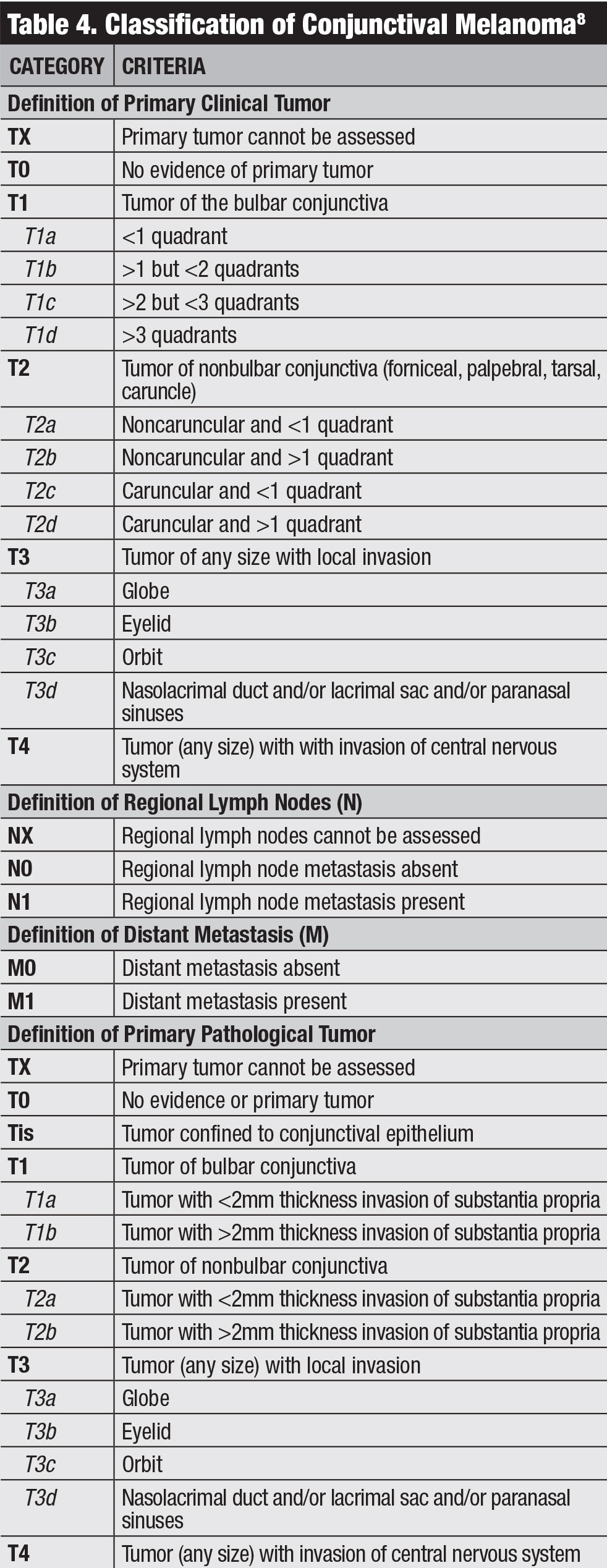
Fare clic su tabella per ingrandire.
Classificazione. La classificazione clinica dell’AJCC per il melanoma congiuntivale si basa sull’estensione del tumore per quadranti, posizione del tumore e caratteristiche invasive (Tabella 4).8 Il nostro team ha studiato i risultati del melanoma congiuntivale sulla base dell’AJCC 7th edition e ha scoperto che questa stadiazione era altamente predittiva della prognosi.20 Il melanoma classificato come T2 e T3 (rispetto a T1) ha mostrato tassi significativamente più elevati di recidiva locale, metastasi linfonodali regionali, metastasi a distanza e morte.
Gestione. La cura per il melanoma congiuntivale comprende basicamente la resezione chirurgica completa facendo uso della tecnica di no-tocco per evitare la semina del tumore. Il primo intervento chirurgico è il più importante, poiché la delicata rimozione dell’intero tumore senza semina tumorale è la chiave per prevenire future recidive e metastasi.16
Il melanoma al limbus corneosclerale viene rimosso al microscopio operatorio anche con la tecnica no-touch. La componente corneale piatta viene rimossa con alcool assoluto, epiteliectomia superficiale senza interruzione della membrana di Bowman. La porzione congiuntivale viene rimossa con margini da 2 mm a 3 mm e rilasciata al limbus mediante dissezione episclerale piatta. Se è presente un’invasione sclerale, viene applicata la radioterapia della placca. Tutti i margini congiuntivali sono trattati con crioterapia a doppio congelamento-disgelo.
La ricostruzione comporta tecniche di chiusura primaria, lembo rotazionale o trapianto di membrana amniotica, spesso con anello symblepharon con drappeggio di membrana amniotica. Il melanoma che si estende nell’orbita richiede l’esenterazione orbitale o, più recentemente, l’immunoterapia con inibizione del checkpoint.21
I pazienti con melanoma congiuntivale devono essere monitorati da un oncologo oculare per la recidiva locale e da un oncologo sistemico per la malattia metastatica, in particolare con palpazione linfonodale regionale e biopsia linfonodale sentinella. Le metastasi compaiono inizialmente nei linfonodi preauricolari o sottomandibolari, poi più tardi nel polmone e nel cervello. Nuove prove suggeriscono che la metastasi del melanoma potrebbe essere sensibile agli inibitori di BRAF o agli inibitori del checkpoint immunitario.21,22
I tumori congiuntivali comprendono un ampio spettro di tumori. I tumori maligni più comuni includono OSSN, linfoma e melanoma. Riconoscere le caratteristiche cliniche classiche, comprendere i precursori e una gestione tempestiva e appropriata di queste neoplasie sono importanti per i migliori risultati del paziente.
Drs. Shields, Lally e Shields lavorano nel servizio di oncologia oculare presso il Wills Eye Hospital, Thomas Jefferson University, a Philadelphia. Supporto fornito da Eye Tumor Research Foundation, Philadelphia.
1. Il sito utilizza cookie tecnici e di terze parti. Tumori congiuntivali: revisione delle caratteristiche cliniche, dei rischi, dei biomarcatori e dei risultati. Il 2017 J. Donald M. Gass Lezione. Asia Pac J Ophthalmol. 2017;6:109-20.
2. I nostri prodotti sono disponibili su richiesta. Tumori congiuntivali in 5002 casi. Analisi comparativa di controparti benigne contro maligne. Il 2016 James D. Allen Lezione. Am J Ophthalmol. 2017;173:106-33.
3. Scudi CL, Scudi JA. Tumori della congiuntiva e della cornea. Surv Ophthalmol. 2004;49:3-24.
4. Grossniklaus HA, Verde WR, Luckenbach M, et al. Lesioni congiuntivali negli adulti. Una revisione clinica e istopatologica. Cornea. 1987;6:78-116.
5. Shields CL, Sioufi K, Alset AE, et al. Tumori congiuntivali nei bambini. Caratteristiche che differenziano i tumori benigni da quelli maligni. JAMA Ophthalmol. 2017;135:215-24.
6. Gichuhi S, Sagoo MS, Weiss HA, et al. Epidemiologia della neoplasia squamosa della superficie oculare in Africa. Trop Med Int Salute. 2013;18:1424-43.
7. Shields CL, Ramasubramanian A, Mellen P, Shields JA. Carcinoma a cellule squamose congiuntivale che si manifesta in pazienti immunosoppressi (trapianto di organi, infezione da virus dell’immunodeficienza umana). Oculistico. 2011;118:2133-7.
8. Amin MB, Bordo S, Greene F, et al., eds. AJCC Cancro Staging Manuale. 8a ed. Chicago; Springer International Publishing: 2017.
9. Scudi JA, Scudi CL, De Potter PV. Approccio chirurgico ai tumori congiuntivali. La conferenza di Lynn B. McMahan del 1994. Arco oftalmolo. 1997;115:808-15.
10. I nostri servizi sono sempre disponibili. Interferone per neoplasia squamosa della superficie oculare in 81 casi: risultati basati sul Comitato congiunto americano sulla classificazione del cancro. Cornea. 2013;32(3):248-56.
11. Karp CL, Galor A, Chhabra S, et al. Interferone ricombinante subcongiuntivale/perilesionale a2b per neoplasia squamosa della superficie oculare: una revisione di 10 anni. Oculistico. 2010;117(12):2241-6.
12. Kirkegaard MM, Rasmussen PK, Coupland SE, et al. Linfoma congiuntivale-Uno studio retrospettivo multicentrico internazionale. JAMA Ophthalmol. 2016;134:406-14.
13. Scudi CL, Scudi JA, Carvalho C, et al. Tumori linfoidi congiuntivali: analisi clinica di 117 casi e relazione con il linfoma sistemico. Oculistico. 2001;108:979-84.
14. I nostri servizi sono a vostra disposizione. Melanoma congiuntivale: È in aumento negli Stati Uniti? Am J Ophthalmol. 2003;135:800-6.
15. Tuomaala S, Kivela T. Corrispondenza riguardante il melanoma congiuntivale: sta aumentando negli Stati Uniti? Am J Ophthalmol. 2003;136:1189-90.
16. Il sito utilizza cookie tecnici e di terze parti. Melanoma congiuntivale. Risultati basati sull’origine del tumore in 382 casi consecutivi. Oculistico. 2011;118:389-95.
17. Shields CL, Fasiuddin AF, Mashayekhi A, et al. Nevi congiuntivali: caratteristiche cliniche e decorso naturale in 410 pazienti consecutivi. Arco oftalmolo. 2004;122:167-75.
18. Gerner N, Norregaard JC, Jensen OA, Prause JU. Naevi congiuntivale in Danimarca 1960-1980. Uno studio di follow-up di 21 anni. Acta Ophthalmol Scand. 1996;74:334-7.
19. Shields JA, Shields CL, Mashayekhi A, et al. Melanosi acquisita primaria della congiuntiva: rischi per la progressione al melanoma in 311 occhi. Il 2006 Lorenz E. Zimmerman lecture. Oculistico. 2008;115:511-9.
20. I nostri prodotti sono disponibili su richiesta. American Joint Committee on Cancer (AJCC) Classificazione clinica predice i risultati del melanoma congiuntivale. Ophthalm Plast Reconstr Surg. 2012; 5:313-23.
21. Il suo nome deriva dal greco antico, “Thakar”, “Kandl TJ” e “Kandl TJ”. Immunoterapia con inibitori della morte cellulare programmata 1 per 5 pazienti con melanoma congiuntivale. JAMA Ophthalmol. 2018 Novembre 1;136 (11):1236-41.
22. Dalvin LA, Shields CL, Orloff M, et al. Terapia immunitaria dell’inibitore del checkpoint. Indicazioni sistemiche ed effetti collaterali oftalmici. Retina. 2018;6:1063-78.