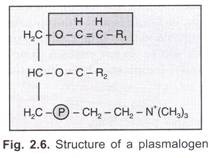
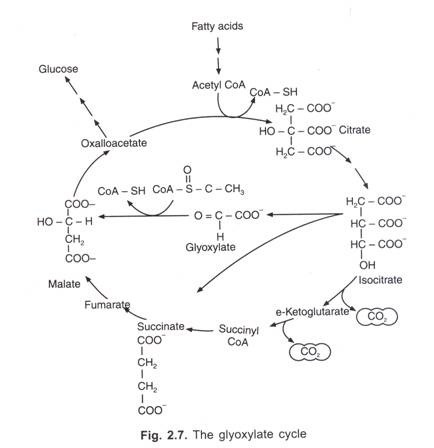
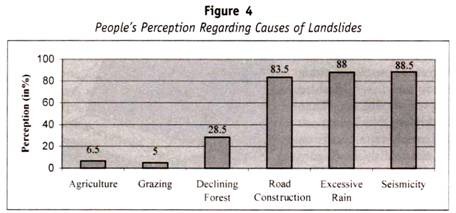
Klassifizierung von menschlichem Blut / Immunologie
WERBUNG:
Menschliches Blut kann in verschiedene Blutgruppensysteme eingeteilt werden, z. B. ABO-Blutgruppe, MN-Blutgruppe und Rh-Blutgruppe.
Alle diese Blutgruppen im Menschen stehen unter genetischer Kontrolle, wobei jede Reihe von Blutgruppen unter der Kontrolle von Genen an einem einzigen Ort oder von Genen steht, die eng miteinander verbunden sind und sich in der Vererbung so verhalten, als wären sie an einem einzigen Ort.
- ABO Blutgruppe:
- Genetik der ABO-Blutgruppe:
- Unterteilungen der Blutgruppen A, AB und B:
- Art der Vererbung:
- Spezielle genetische Fälle der ABO-Blutgruppe:
- MN-Blutgruppen:
- Rh-Faktor:
- Klinische Bedeutung:
- Details zum Rh-Faktor:
- Genetische Kontrolle der antigenen Struktur:
- Ein schematischer Vergleich der Wiener- und Fisher-Race-Konzepte:
- Das Weiner-Konzept von Rh:
- Das Fischer-Race-Konzept von Rh:
- Vererbung der Rh-Blutfaktoren:
- Bedeutung der Entwicklung des korrekten Konzepts der genetischen Beziehungen der Rh-Antigene:
ABO Blutgruppe:
Wenn wir die Immunitätsreaktionen im Zusammenhang mit der ABO-Blutgruppe betrachten, dann finden wir, dass einige von ihnen ‘natürliche’ Antikörper gegen einige andere enthalten.
ANZEIGEN:
Es folgt der Antikörpergehalt der ABO-Blutgruppe:

In ähnlicher Weise, wenn wir das Vorhandensein von Antigen in den roten Blutkörperchen von verschiedenen ABO Blutgruppe Menschen betrachten, dann finden wir: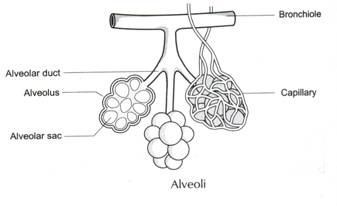
Aufgrund des Vorhandenseins verschiedener Antigene und Antikörper in den Blutgruppen von A, B,
WERBUNG:
AB und O, alle Arten von Blut können aufgrund ihrer Agglutinationsreaktion wie folgt nicht miteinander vermischt werden:

Wenn eine Bluttransfusion durchgeführt wird, schadet es nicht, wenn das Blut des Spenders Antikörper gegen das des Empfängers enthält, da das Blut des Spenders im Vergleich zum Gesamtvolumen des Empfängers gering ist und daher die Antikörper verdünnt werden.
Aber es würde schaden anrichten, wenn das Blut des Empfängers die Antikörper hätte, da jetzt die Antikörpermenge relativ groß ist. Eine Person der Blutgruppe O, zum Beispiel, könnte kein Empfänger von Blut aus einer anderen Gruppe als seiner eigenen sein, da sein Serum alle Blutkörperchen außer seinen eigenen agglutiniert, obwohl er ein Spender für jede Gruppe sein könnte, da niemandes Blut Antikörper gegen seine Blutkörperchen enthält.
Genetik der ABO-Blutgruppe:
Wir wissen nicht, welche der vier Blutgruppen die normale ist. In der Genetik ist es allgemein anerkannt, dass Individuen mit normalen Merkmalen am zahlreichsten sind als in allen anderen. Zum leichteren Verständnis, wenn wir die O-Gruppe als normal betrachten, dann A und B-Gruppe entstand aus O-Gruppe als Ergebnis von zwei dominanten Mutationen (eine für jede Gruppe), das mutierte Gen kann die Symbole A und B gegeben werden, beziehungsweise. Beide Gene entstanden am selben Ort aus einem der normalen Gene in der O-Gruppe.
Wenn wir das normale Gen mit dem Symbol + bezeichnen, dann drei Gene +. A und B besetzen den gleichen Locus und sind mehrere Allele. Da das + -Gen rezessiv ist, muss die O-Gruppe für +/+ homozygot sein, und da die A- und B-mutierten Gene dominant sind, sind die Kombinationen für eine Gruppe entweder A / A oder +/A und ähnlich für die B-Gruppe, B / B oder +/ B. Blutgruppe AB hingegen ist immer der
Hybrid, A / B (Dies ist ein Beispiel für die phänotypische Expression der Co-Dominanz).
Einige Genetiker schlugen auch vor, dass die Vererbung der Blutgruppe A, B, AB und O beim Menschen durch eine Reihe von drei allelomorphen Genen bestimmt wird, von denen i für kein Antigen, IA für Antigen A, IB für Antigen B. IA & IB zeigen vollständige Dominanz über i.
Unterteilungen der Blutgruppen A, AB und B:
WERBUNG:
Die Blutkörperchen einer Blutgruppe wurden in zwei Untergruppen unterteilt, die als A1 und A2 bekannt sind, aber von diesen beiden Untergruppen ist A2 weniger häufig. Es wurde gefunden, dass A1-Körperchen nicht durch A2-Serum agglutiniert werden, noch umgekehrt; aber sowohl A1- als auch A2-Körperchen werden durch B-Serum und O-Serum agglutiniert.
Es wurde auch weiter bemerkt, dass zwei weitere Untergruppen von A (abgesehen von A1 und A2) identifiziert wurden, die A3 und A4 sind, aber beide dieser Gruppen sind seltener als A2. Jede der A-Untergruppen wird durch ein separates Gen bestimmt und die Gene für alle vier Untergruppen sind Allele.
In ähnlicher Weise enthält das Serum der Gruppe B mindestens zwei Arten von Antikörpern, von denen einer die Blutkörperchen der A1- und A2-Gruppe agglutiniert und der andere nur A1 agglutiniert. Die AB-Blutgruppe wurde auch in A1B, A2B, A3B und A4B unterteilt.
Das Gen ‘I’ ist also ein multiples Allel (das die Antigenproduktion bestimmt) und kann 15 Genotypen und 10 Phänotypen von Blutgruppen produzieren, die:
Art der Vererbung:
Wenn beide Elternteile einer bestimmten Familie der O-Blutgruppe angehören, müssen alle Kinder von ihnen wie ihre Eltern die O-Blutgruppe haben. Wenn andererseits beide Elternteile einer Gruppe angehören und beide zufällig hybride sind (A / +), haben sie möglicherweise einige Kinder mit O-Blutgruppe.
Wenn wir also die Blutgruppen eines Kindes und seiner Mutter kennen, können wir die wahrscheinliche Blutgruppe des Vaters des Kindes legitim beanspruchen oder testen.
Folgende Tabelle ist die zusammengefasste Form medicolegal Anwendung der Blutgruppen :
WERBUNG:
WERBUNG:
Die folgende Tabelle (Tabelle 13.1) ist die Art der Vererbung der Blutgruppe an die Kinder von den Eltern:
Spezielle genetische Fälle der ABO-Blutgruppe:
Es wurde festgestellt, dass einige Personen auch A- oder B-Antigene in ihren Körpersekreten haben (aus Augen, Nase, Speicheldrüse und Brustdrüse) und als Sekretoren bekannt sind. Personen, die Sekretoren sind, haben wasserlösliches Antigen, das aus den roten Blutkörperchen austreten kann und somit in den Körpersekreten vorhanden ist.
Aber im Falle von Nicht-Sekretoren sind Antigene nur alkohollöslich und können nicht in den Sekreten gelöst werden. So können die Sekrete sowohl durch Tests am Blut als auch an den Körpersekreten identifiziert werden. Dieses Sekretormerkmal wird als dominantes Gen ‘S’ vererbt, während das Nicht-Sekretormerkmal vom homozygoten rezessiven Allel ‘s’ vererbt wird. Es wurde geschätzt, dass fast 77% der US-Bevölkerung Sekrete sind.
In ähnlicher Weise wurde ein anderes Antigen, das als ‘H’-Antigen bekannt ist, ebenfalls auf den Erythrozyten identifiziert, was durch Agglutinationen durch Anti-H-Serum nachgewiesen werden kann. Es wird angenommen, dass dieses Antigen ein Zwischenprodukt zwischen Antigen A und B. Das dominante Gen H ist verantwortlich für die Produktion von H-Antigen und die Geotypen sind wie folgt :
Es ist interessant festzustellen, dass die Personen, deren Blut keine Reaktion mit Anti-A oder Anti-B oder Anti-H gibt, zu einer sehr seltenen Gruppe gehören und als “Bombay-Phänotyp” bekannt sind, weil es zuerst in einer sehr kleinen Gruppe von Menschen in der Stadt Bombay beschrieben wurde.
MN-Blutgruppen:
Die Blutkörperchen verschiedener Personen können entweder das eine oder das andere oder sowohl M als auch N enthalten, und diese Antigene haben keine Beziehung zu ABO-Blutgruppen. Das heißt, eine Person der A – Blutgruppe könnte zu einer der drei (M, N oder MN) MN-Blutgruppen gehören. Das Gen, das für die Produktion von M- und N-Antigenen verantwortlich ist, ist dominant und Allele.
ANZEIGEN:
Das heterozygote für M- und N-Gen zeigte eine Kodominanz. Diese drei Klassen (M, N und MN) treten jedoch nicht in einem einfachen Mendelschen Verhältnis in der Allgemeinbevölkerung auf, und der Prozentsatz jeder Klasse variiert von Rasse zu Rasse. Die MN-Blutgruppe hat bei der Bluttransfusion keine Bedeutung, aber medizinisch-rechtliche Bedeutung, z.B. Vaterschaftstest. Die folgende Tabelle (Tabelle 13.2) zeigt den Vaterschaftstest für die MN-Blutgruppe.
Rh-Faktor:
Ein wichtiges Agglutinogen wurde (1940) in menschlichen roten Blutkörperchen auch von Landsteiner und Wiener nachgewiesen. Es ist Agglutinogen des Rhesusaffen und ist in 85% der weißen Menschen vorhanden. Obwohl die Informationen begrenzt sind, ist der Anteil unter Indern und Ceylonesen noch größer (etwa 95% oder mehr). Es gibt kein entsprechendes Agglutinin im menschlichen Plasma.
Neuere Studien zeigen, dass der Rh-Faktor keine einzige Einheit ist. Es gibt sechs Rh-Agglutinogene – C, c; D, d; E, e; von diesen, D und wagen die häufigsten. Diese beiden liefern drei Untergruppen – D, Dd und d. D ist mendelsch dominant, während d rezessiv ist. Daher sind die Gruppen D und Dd (zusammen D-Gruppe genannt) Rh-positiv (Rh +) und d rh-negativ (Rh ~). Praktisch alle Rh-positiven Personen gehören zur D-Gruppe und rh-negative Personen zur Gruppe d.
Klinische Bedeutung:
1. Wenn Rh + Blut an einen Rh” -Patienten transfundiert wird, entwickelt sich in etwa 12 Tagen ein Anti-Rh-Faktor im Blut des Patienten. Wenn einem solchen Patienten nach dieser Zeit eine zweite Transfusion desselben Blutes verabreicht wird, findet eine Hämoagglutination der Blutkörperchen des Spenders statt. Mit anderen Worten, Blut, das vorher kompatibel war, ist jetzt inkompatibel geworden. Vor der Transfusion sollte der Test auf Rh-Faktor sorgfältig durchgeführt werden.
2. Während der Schwangerschaft kann der Fötus Rh+ sein, während die Mutter Rh-. Das Rh-Agglutinogen (das auch im Plasma leicht vorhanden ist) des Fetus gelangt in das mütterliche Blut und stimuliert die Bildung des Anti-Rh-Faktors. Dieser Antikörper gelangt in das fetale Blut und zerstört die roten Blutkörperchen des Fötus. Der Fötus kann sterben (Fehlgeburt verursachen) oder, wenn er lebend geboren wird, an schwerer Anämie leiden. Diese Krankheit ist als Erythro-Blastosis foetalis bekannt.
3. Eine solche Mutter wird für den Rh-Faktor sensibilisiert. Wenn sie in Zukunft eine Transfusion von ansonsten kompatiblem Blut erhält, das jedoch Rh-Faktor enthält, findet eine Agglutination statt.
4. Aus dem gleichen Grund sollte eine Rh” -Frau vor den Wechseljahren keine Transfusion von Rh + -Blut erhalten. Denn falls sie mit Rh-positivem Fötus schwanger wird, das Problem wie unter Nr. (2) wird umso akuter werden.
Die spezifischen Agglutinine sind im fetalen Plasma nicht vorhanden. Mütterliche Agglutinine, die durch die Plazenta gefiltert werden, werden jedoch im fötalen Plasma gefunden. Nur 50% der Neugeborenen zeigen eine nennenswerte Menge dieses Agglutinin.
Spezifische Agglutinine treten ab etwa dem 10.Tag nach der Geburt auf und steigen etwa im 10. Agglutinine werden wie andere Antikörper in der Globulinfraktion des Serums gefunden. Sie sind auch in geringen Verdünnungen in Körperflüssigkeiten vorhanden, die reich an Proteinen sind, wie Milch, Lymphe Exsudate und Transsudate. Sie werden nicht im Urin und in der Zerebrospinalflüssigkeit gefunden. Hämoagglutinine nehmen während der Serumkrankheit vorübergehend zu und sind bei Leukämie reduziert.
Wie bei anderen Antikörpern variiert die Konzentration von spezifischem Agglutinin in jedem Alter von Mensch zu Mensch und sogar bei demselben Individuum unter verschiedenen Bedingungen. Sie wirken am besten bei einer niedrigeren Temperatur.
Die Blutgruppe eines bestimmten Subjekts hat einen festen Charakter und variiert nicht mit dem Alter oder der Krankheit.
Manchmal können unspezifische Agglutinine im Blut auftreten, die bei Kälte (bei 0 ° -5 ° C oder F) und nicht bei Körpertemperatur wirken. Diese kalten Agglutinine können manchmal ausreichend hoch sein, um eine Autoagglutination bei Körpertemperatur zu verursachen. Aus diesem Grund kann es zu einer intravaskulären Hämolyse kommen, die zu einer Hämoglobinurie (paroxysomale Hämoglobinurie) führt.
Details zum Rh-Faktor:
1. Rh-Agglutinogene:
Es gibt drei Paare von Rh-Agglutinogenen C, c; D, d; und E, e; C, D und E sind Mendelsche Dominanten und c, d und e sind rezessiv.
2. Menschliche rote Blutkörperchen (RBC):
R.B.C. wird immer drei Agglutinogene tragen – eines von jedem Paar, aber sie werden niemals beide Mitglieder eines Paares tragen. Somit sind ODE, CDe und cDE möglich, cDC und CDd jedoch nicht.
3. Rh-Gruppen (Genotypen):
Daraus folgt, dass es 8 mögliche Kombinationen gibt, von denen jede von beiden Elternteilen getragen werden kann. Daher gibt es mathematisch 64 mögliche Kombinationen (Genotypen). Von diesen 28 identischen sind 36 Untergruppen biologisch verfügbar. Von diesen wiederum werden nur 5 häufig gefunden, nämlich CDe / CDe, CDe / cDe, CDe / cde, cDe / cde und cde / cde. Andere sind selten.
4. Rh+ und Rh- Gruppen:
Diese Gruppen, die die dominanten Agglutinogene enthalten — d. h. C, D, E – sind Rh+. Aber da C und E selten ohne D bleiben, enthalten praktisch alle Rh + -Fälle D, d. H. Gehören zu
Gruppe D. Die Rh- Fälle enthalten die rezessiven Agglutinogene – c, d und e und aus ähnlichen Gründen state4 oben gehören zur Gruppe d. Jeder Mann trägt etwas Rh-Agglutinogen. Die meisten haben D und sind von Rh +. Der Rest trägt d und ist von Rh- . Alle Rh-inkompatiblen Reaktionen sind auf Wechselwirkungen zwischen Gruppe D (Spender) und Gruppe d (Empfänger) zurückzuführen.
5. Rh-Antikörper:
a) Jedes der sechs Agglutinogene hat eine antigene Eigenschaft, d.h. Sie können die Antikörperbildung stimulieren. Die entsprechenden Antikörper sind als Anti-C, Anti-D usw. bekannt. D ist stark antigenisch, andere sind sehr schwach.
b) Wenn D-Zellen wiederholt in ein Rh” -Subjekt injiziert werden, entwickelt sich Anti-D. Dieser Antikörper kann von zwei Arten sein – “früh” und “spät”. Das frühe Anti-D wird zuerst gebildet und wird kompletter Antikörper genannt. Es kann D-Zellen in vitro agglutinieren, wenn sie entweder in Kochsalzlösung oder Albuminlösung suspendiert sind. Daher ist es auch als Salzagglutinin bekannt. Das späte Anti-D wird später gebildet und wird unvollständiger Antikörper genannt.
Es kann D-Zellen in vitro agglutinieren, wenn sie nur in Albuminlösungen und nicht in Salzlösungen suspendiert sind. Daher wird es auch Albumin-Agglutinin genannt. Im letzteren Fall sind die D-Zellen zwar nicht agglutiniert, aber dennoch etwas modifiziert. Denn diese Zellen werden, sobald sie auf diese Weise behandelt wurden, nicht durch frühes Anti-D-Serum agglutiniert, selbst wenn sie in Albuminlösung suspendiert sind. Daher wird das späte Anti-D auch als blockierender Antikörper bezeichnet.
c) Wie oben erwähnt, ist D sehr stark antigen. Es bewirkt auch durch intramuskuläre Injektion eine Anti-D-Bildung; so dass wiederholte intramuskuläre Injektionen von Vollblut — wie in der medizinischen Praxis oft ohne Anpassung der Blutgruppen — nicht unbedingt ein sicheres Verfahren sind. Daher ist ein direkter Abgleich vor jeder solchen Verpflichtung der einzig sicherste Schutz.
6. Rassenverteilung:
Indianer – 85% Rh+, von denen D – 35%, Dd – 48% und die restlichen 2% auch D zusammen mit einem anderen Agglutinogen enthalten. Inder, Ceylonesen – 95% Rh+, Japaner etwa 100% Rh + Daher sind Rh-Inkompatibilitätsreaktionen bei letzteren äußerst selten.
7. Hämolytische Erkrankung des Neugeborenen:
Diese Erkrankung ist auf die Zerstörung des Rh + R.B.C. im Fötus durch ein im Serum der Mutter vorhandenes Anti-Rh-Agglutinin zurückzuführen, das während der Schwangerschaft durch die Plazenta gefiltert wurde. Die Inkompatibilität zwischen dem Blut von Mutter und Kind wird durch die Vererbung des Rh-Faktors verursacht. Die folgende Tabelle (Tabelle 13.3) gibt die Wahrscheinlichkeiten der Rh-Gruppe bei Kindern an.
Bei dieser Krankheit führt die Zerstörung des normalen R.B.C. zum Vorhandensein von abnormalem kernigem R.B.C. im Kreislauf. Ein paar Stunden nach der Geburt gibt es Anämie, akute Gelbsucht und verwandte Symptome.
Bedeutung der Blutgruppe:
1. Bluttransfusion.
2. Bestimmte Blutkrankheiten.
3. Vaterschaftstest.
4. In der forensischen Medizin.
5. Ethnologische Studien.
6. Anthropologische Studien.
7. Verschiedene experimentelle Zwecke.
Eine Unverträglichkeit des Blutes kann nur in Fällen auftreten, die mit einem Sternchen (*) gekennzeichnet sind, da die Mutter in diesen beiden Gruppen in der Lage ist, ein Anti—Rh-Agglutinin zu produzieren, um das im Fötus vorhandene Rh + R.B.C. zu zerstören.
Genetische Kontrolle der antigenen Struktur:
Die Rh-Antigene:
Die beiden bisher diskutierten unabhängigen Sätze allelischer Blutgruppengene sind relativ einfache Beispiele für die genetische Kontrolle von Blutgruppensubstanzen. Ein letzter Fall wird detailliert dargestellt, um die komplexeste Situation beim Menschen zu veranschaulichen, die durch ein Verständnis verständlich gemacht wurde – der Beziehungen von Genen und Antigenen.
Dieser Fall ist der der Rhesus-Substanzen, die eine Reihe von Antigenen darstellen, die unabhängig von den MN- und ABO-Antigenen vererbt werden und die durch Gene bestimmt werden, die auf einem weiteren Chromosomenpaar vorkommen. Die Antigenserie leitet ihren Namen Rh vom Rhesusaffen (Macaca mulatta) ab, bei dem das erste Mitglied der Serie 1940 von Landsteiner und Winner entdeckt wurde.
Levine und Stetson (1939) hatten festgestellt, dass die hämolytische Erkrankung von Neugeborenen, die als Erythroblastosis foetalis bezeichnet wird, auf die Isoimmunisierung von Müttern gegen ein unbekanntes Antigen auf den roten Blutkörperchen ihrer Kinder zurückzuführen ist. Kurz nach der Beschreibung der Rh-Antigene stellten Levine, Katsin und Burnham (1941) fest, dass dies das Antigen war, das für die Krankheit verantwortlich war, die sie untersuchten.
Diese Entdeckungen leiten eine intensive Untersuchung der Rh-Antigene ein, die seitdem fortgesetzt wird. Diese Untersuchung hat nicht nur eine Lösung für viele mit der Krankheit verbundene Probleme geliefert, sondern auch die Konzepte der Art der Vererbung von Blutgruppensubstanzen im Allgemeinen erheblich weiterentwickelt.
Es wurden zwei Haupthypothesen aufgestellt, um den genetischen Mechanismus zu erklären, der die Rh-Antigene steuert. Eines davon, vorgeschlagen von Wiener, postuliert eine Reihe von Allelen an einem einzigen Locus m ein Chromosomenpaar, das sich von denen unterscheidet, die andere Gene für Blutgruppenantigene tragen.
Die andere, von Fisher und Race vorgebrachte, stimmt mit dem Vorstehenden überein, indem sie besagt, dass die beteiligten Gene auf ihrem eigenen Chromosomenpaar liegen, widerspricht jedoch darin, dass sie drei Paare eng miteinander verbundener Allele an drei getrennten Loci postuliert.
Die Verknüpfung wird als so eng angesehen, dass Kreuzungen mit so niedrigen Frequenzen auftreten, wie sie noch nie beobachtet wurden. Leider sind die genetischen Vorhersagen dieser beiden Hypothesen in so vielen Aspekten lebendig, dass es noch nicht möglich war, endgültig festzustellen, welche richtig ist.
Ein schematischer Vergleich der Wiener- und Fisher-Race-Konzepte:
Einer der grundlegenden Punkte ist, ob es eine Eins-zu-Eins-Beziehung zwischen der Anzahl der Arten von Rh-Antikörpern gibt, mit denen eine Zelle kombiniert wird, und der Anzahl der Arten von Genen, die die antigenen Spezifitäten bestimmen, die für diese Kombination verantwortlich sind.
Dieser Punkt wird veranschaulicht, indem Zellen (eines genetisch homozygoten Individuums) betrachtet werden, die in der Lage sind, sich mit drei verschiedenen Arten von Antikörpern zu kombinieren, Anti-1, Anti-2 und Anti-3. Weiners Hypothese würde das Konzept erlauben, dass alle drei Antikörper mit verschiedenen Teilen eines einzelnen Moleküls von Antigenen kombiniert wurden, deren komplexe Spezifitäten durch eine einzige Art von Gen bestimmt wurden.
Die Fisher-Race-Hypothese würde dieses Konzept nicht zulassen, sondern visualisiert jeden Antikörper, der sich mit einem Molekül Antigen mit nur einer einzigen Spezifität verbindet, die durch ein einzelnes Gen bestimmt wird. Das beigefügte Diagramm skizziert die Art des Kontrasts zwischen diesen beiden Konzepten.

Es sollte sorgfältig darauf geachtet werden, dass das Wiener Konzept nicht im Widerspruch zu der Ein-Gen-Ein-Antigen-Beziehung steht, auf die zu Beginn dieses Kapitels Bezug genommen wird. Vielmehr ist es ohne weiteres denkbar, dass das durch ein einzelnes Gen bestimmte Antigen eine komplexe topographische Struktur aufweisen kann, die mehr als eine Art von Antikörper induziert und mit ihm kombiniert, und zwar auf eine Weise, die der bei der Untersuchung von “künstlichen” Antigenen beobachteten entspricht; Mit anderen Worten, das Konzept einer Eins-zu-Eins-Beziehung zwischen einem Gen und der antigenen Spezifität, die sein Produkt ist, erfordert überhaupt keine Eins-zu-Eins-Beziehung zwischen dieser antigenen Spezifität und den Antikörpern, die es erzeugt.
Das Weiner-Konzept von Rh:
Weiners Konzept postuliert eine grundlegende Reihe von 8 Allelgenen (zusätzliche Mitglieder wurden zu dieser Reihe hinzugefügt, aber diese müssen hier nicht berücksichtigt werden), von denen zwei in einem einzigen heterozygoten Individuum auftreten können. Jedes dieser Gene bestimmt ein Antigen, das in der Lage ist, ein bis drei (und mehr) Arten von Antikörpern zu induzieren und zu kombinieren.
Die beteiligten antigenen Spezifitäten treten in verschiedenen Kombinationen auf, die durch das jeweilige Allel bestimmt werden, das für ein bestimmtes Antigen verantwortlich ist. (Die in dieser Forschung verwendeten Antikörper werden im Allgemeinen von isoimmunisierten Menschen erhalten, entweder freiwilligen oder Müttern, die ein Kind haben, das an einer hämolytischen Erkrankung leidet; Wieners Symbole für die verschiedenen Gene, die Antigene, die sie bestimmen, und die Reaktionen dieser Antigene auf ausgewählte Antiseren finden Sie in Tabelle 13.4. Ein solches Gen wird als einzelner Buchstabe geschrieben, gefolgt von einem hochgestellten, während das Antigen, das jedes bestimmt, als zwei Buchstaben geschrieben wird, gefolgt von einem tiefgestellten oder hochgestellten. Die verschiedenen Antigene werden nun betrachtet.

Das Symbol Rho wird groß geschrieben, weil es das erste Rh-Antigen darstellt, das entdeckt wurde und das bei hämolytischen Erkrankungen immer noch das bedeutendste ist. Die Symbole rh’ und rh” stehen für nachträglich gefundene zusätzliche Antigene. Die Symbole Rh1 und Rh2 stehen für komplexe Antigene, die aus zwei Spezifitäten bestehen. Rhj setzt sich aus den Einheiten Rho und rh’ zusammen; Rh2 setzt sich aus den Einheiten Rho und rh” zusammen. Die zusätzlichen Symbole Rhz und rhy stehen für Antigene mit Mehrfachspezifitäten wie angegeben. Das Symbol rh erfordert einen besonderen Kommentar.
Ursprünglich stand dieses Symbol für das Fehlen bekannter antigener Spezifitäten (dh Rh0, rh’ und rh”). Die Entdeckung von zwei neuen Arten von Antiseren hat jedoch die Existenz von zwei zusätzlichen Arten von antigenen Spezifitäten offenbart. Diese treten in verschiedenen Kombinationen mit den anderen, soeben beschriebenen Besonderheiten auf.

Das erste dieser Antiseren, das ursprünglich von Levine und seinen Mitarbeitern gefunden wurde, identifiziert eine Spezifität, die jetzt als hr bezeichnet wird und auf allen Zellen auftritt, denen die rh-Spezifität fehlt. Die zweite davon identifiziert eine Spezifität, die als hr” bezeichnet wird und bei allen Zellen auftritt, denen die rh” -Spezifität fehlt. (Das antigene Gegenstück des Rh0-Antigens, Hr0, muss noch mit Sicherheit identifiziert werden.) Diese historisch komplizierte Situation hat zur Anerkennung des rh-Symbols als ein komplexes Antigen mit den hr’- und hr”-Spezifitäten geführt.
Darüber hinaus haben die beiden neuen Antiseren die Beschreibung der anderen Rh-Symbole erweitert. Diese Zusammenhänge sind in Tabelle 13.5 dargestellt. Um diese (und die bereits in Tabelle 13 dargestellten) zu verstehen.4) der Schüler sollte einige Diagramme ähnlich den zuvor gezeigten erstellen und die verwendeten Zahlen durch die Wiener-Symbole ersetzen.
Um das Wiener Schema zusammenzufassen, erlauben die fünf hier betrachteten Antiseren den Nachweis variabler Cluster einer Reihe von antigenen Spezifitäten (einzeln als Blutfaktoren bezeichnet), die aus der Rh-Blutgruppe einer bestimmten Person stammen. Diese Cluster werden von Generation zu Generation weitergegeben, wobei ihre spezifische und strukturelle Kontinuität durch das jeweilige Allel bestimmt wird, dessen Produkt sie sind. Weitere Überlegungen zur Vererbung dieser Faktoren werden in einem späteren Abschnitt gegeben.
Das Fischer-Race-Konzept von Rh:
Das Fischer-Race-Konzept hat seinen Ursprung in der analytischen Einsicht des britischen Genetikers und Mathematikers R. A. Fischer. Er schlug in einem von Race 1944 vorgelegten Vorschlag vor, dass die damals bekannten Rh-Antigene als Produkte der Wirkung einer Reihe von drei Paaren sehr eng miteinander verbundener Allele betrachtet werden könnten, wobei jedes Gen in jedem Paar ein einzelnes Antigen mit der Fähigkeit zur Induktion und Reaktion mit nur einer Art von Antikörper.
Die vorgeschlagenen Allelpaare von Genen wurden als C, c symbolisiert; D, d; und E, e. Jedes wurde gehalten, um ein unterschiedliches Antigen zu produzieren, das mit demselben Buchstaben bezeichnet wurde. Durch die Verwendung von Groß- und Kleinbuchstaben wird keine Dominanz impliziert, Diese werden nur ausgewählt, um ihren Allelismus zu zeigen.
Die formalisierten Beziehungen dieser mehreren Gene auf den Chromosomen eines einzelnen Heterozygoten für alle von ihnen ist:
CDE / cde
Andere Kombinationen von drei Allelen auf bestimmten Chromosomen treten natürlich auf, z. B. CDE, CDE, CDE usw. (einige Behörden schreiben die Buchstabenfolge als D. C. E in Anerkennung genetischer Überlegungen zur Verknüpfung und möglichen Deletion; Dies sind jedoch Überlegungen, die hier nicht relevant sind.)
Zum Zeitpunkt der Etablierung des Fisher-Race-Konzepts waren Antiseren für die Antigene C, c, D und E bekannt. Die zusätzlichen Antiseren für die Antigene d und e wurden vorhergesagt, von denen Anti-e nun mit Sicherheit etabliert ist.
Darüber hinaus wurde die Existenz des damals unbekannten Chromosoms c (d) E vorhergesagt und anschließend gefunden. Der Erfolg dieser Vorhersagen sowie die relative Einfachheit der verwendeten Terminologie und Konzepte führten zu einer breiten Akzeptanz des Fisher-Race-Schemas, insbesondere bei Klinikern und europäischen Forschern.
Zusammenfassend erkennt das britische Konzept eine Reihe von Chromosomen, die unterschiedliche Kombinationen der sehr eng miteinander verbundenen C-, D- und E-Allelle tragen. Es wird angenommen, dass diese Kombinationen als Ergebnis eines Überkreuzens entstehen, so selten, dass sie nicht erkannt wurden.
Das Symbol D entspricht dem von Rho, und weitere Parallelen in den beiden Terminologien sind in Tabelle 13.6 dargestellt. In ähnlicher Weise können die beiden Symbolsätze für die fünf Arten von Rh-Antikörpern wie folgt in Beziehung gesetzt werden:

Vererbung der Rh-Blutfaktoren:
Es ist offensichtlich, dass die Rh-Blutfaktoren in Abwesenheit von Dominanz, Mutationskreuzung und Epistose (von denen im Verlauf genetischer Studien zu Rh-Antigenen noch keine aufgetreten ist) von Generation zu Generation als charakteristische Cluster wieder auftreten.
Zum Beispiel kann eine Kreuzung zwischen einem Vater des Genotyps R2r (CDE / cde) und einer Mutter des Genotyps ϒR” (Cde / cdE) möglicherweise vier Arten von Kindern hervorbringen, wie leicht durch die Verwendung von Punnetts Quadrat gezeigt wird:

Zwei der gezeigten Kinder würden das Antigen RhofD) besitzen, das ihrer Mutter fehlt. In der klassischen Verwendung der Rh-Begriffe wäre ihre Mutter “Rh-negativ”, während sie “Rh-positiv” wäre. Dieses Beispiel zeigt auch, dass die Definition von Rh-Positivität und Negativität relativ ist und in Bezug auf die beteiligten Antigene vorgenommen werden muss.
Theoretisch ist jedes Kind, das Rh-Antigene besitzt, die seiner Mutter fehlen, in Bezug auf diese Antigene positiv, während seine Mutter in Bezug auf sie negativ ist. In der Praxis wurde jedoch festgestellt, dass das Rho (D) -Antigen am häufigsten an hämolytischen Erkrankungen beteiligt ist, wobei rh'(C) das nächste ist, wobei die anderen Blutfaktoren viel seltener beteiligt sind.
Bedeutung der Entwicklung des korrekten Konzepts der genetischen Beziehungen der Rh-Antigene:
Die vorstehenden Abschnitte haben gezeigt, dass entweder das Weiner- oder das Fisher-Race-System der Nomenklatur verwendet werden kann, um die Rh-Antigene und Antikörper zu beschreiben. Dieser Punkt wird vom National Institute of Health anerkannt, die verlangen, dass beide Systeme auf die Kennzeichnung von kommerziell hergestellten Antiserum angewendet werden.
Dies sollte jedoch die Aufmerksamkeit nicht von der Notwendigkeit ablenken, die Gültigkeit des einen oder anderen dieser Nomenklatur zugrunde liegenden Konzepts zu bestimmen, auch wenn dies “akademisch” erscheinen mag und in der klinischen Arbeit nicht direkt von Belang ist.
Allein ein Grund für die Notwendigkeit fortgesetzter Bemühungen zur Lösung dieses Problems ist, dass Antigene, wie bereits oft erwähnt, die direkten Produkte der Gene zu sein scheinen, die sie produzieren. Die Antikörper, die sie induzieren, werden daher aufgrund ihrer feinen Spezifitäten zu den empfindlichsten Indikatoren für Variationen der Genwirkung, die bekannt sind.
Dies macht es unerlässlich, dass ein genaues konzeptionelles Schema gefunden wird, das die Produktion von Antigenen mit jenen Schemata in Verbindung bringt, die in Bezug auf die Beziehung von Genen zu Enzymen und der Nukleinsäurestruktur zu dem “genetischen Code” entwickelt werden, der bei der erblichen Übertragung von-Nachrichten verwendet wird”.
Eine detaillierte Betrachtung dieser Zusammenhänge geht weit über den Rahmen dieses Textes hinaus, wobei der interessierte Leser auf die populären Berichte von Crick, Gamow und Beadle verwiesen wird, um eine Einführung in die beteiligten Geschichten zu erhalten.
Stomont hat die Gründe für die wachsende Tendenz einiger führender Genetiker zusammengefasst, das Wiener Konzept trotz seiner schwierigeren Terminologie zu bevorzugen. Seine Zusammenfassung, die zu weit fortgeschritten ist, um sie hier zu präsentieren, basiert auf Parallelen zwischen dem Verhalten der Rh-Antigene beim Menschen und der B- und C-Reihe von Allelen, die die Blutgruppen beim Rind bestimmen.
Diese Reihen von Allelen steuern bei weitem das komplexeste Array von Blutfaktoren, das es gibt, ein Array, dessen Beziehungen vernünftigerweise nur in Bezug auf mehrere Allele und nicht in Reihen von verknüpften Genen erklärt werden können. Weitere Einzelheiten zu Rinderblutgruppen werden später in diesem Kapitel gegeben. Race und Sanger und Levine präsentieren Diskussionen und weitere Referenzen der Fisher-Sichtweise.
Der Student sollte erkennen, dass die führenden Befürworter beider Schemata Forschungen durchgeführt haben, die in den Annalen der Biologie selten übertroffen wurden, und dass experimentelle Lösungen ihrer Differenzen weder eine einfache noch eine triviale Angelegenheit sein werden.