12.4: parowanie i kondensacja
parowanie
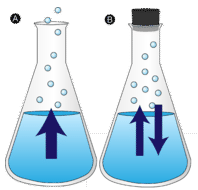
kałuża wody pozostawiona bez przeszkód ostatecznie znika. Cząsteczki cieczy uciekają do fazy gazowej, stając się parą wodną. Parowanie to proces, w którym ciecz jest przekształcana w gaz. Odparowanie to konwersja cieczy do jej pary poniżej temperatury wrzenia cieczy. Jeśli zamiast tego woda jest przechowywana w zamkniętym pojemniku, cząsteczki pary wodnej nie mają szans na ucieczkę do otoczenia, a więc poziom wody nie zmienia się. Ponieważ niektóre cząsteczki wody stają się parą, równa liczba cząsteczek pary wodnej kondensuje się z powrotem do stanu ciekłego. Kondensacja to zmiana stanu z gazu na ciecz.
aby cząsteczka cieczy mogła uciec do stanu gazowego, cząsteczka musi mieć wystarczającą energię kinetyczną, aby przezwyciężyć międzycząsteczkowe siły przyciągania w cieczy. Przypomnijmy, że dana próbka cieczy będzie miała cząsteczki o szerokim zakresie energii kinetycznej. Cząsteczki cieczy, które mają tę pewną progową energię kinetyczną, wydostają się z powierzchni i stają się parą. W rezultacie cząsteczki cieczy, które teraz pozostają, mają niższą energię kinetyczną. W miarę parowania temperatura pozostałej cieczy maleje. Zaobserwowałeś efekty chłodzenia wyparnego. W upalny dzień cząsteczki wody w pocie pochłaniają ciepło ciała i odparowują z powierzchni skóry. Proces parowania pozostawia pozostałą chłodnicę potu, która z kolei pochłania więcej ciepła z twojego ciała.
dana ciecz odparuje szybciej po podgrzaniu. Dzieje się tak, ponieważ proces ogrzewania powoduje, że większa część cząsteczek cieczy ma niezbędną energię kinetyczną do ucieczki z powierzchni cieczy. Poniższy rysunek przedstawia rozkład energii kinetycznej cząsteczek cieczy w dwóch temperaturach. Liczby cząsteczek, które mają wymaganą energię kinetyczną do odparowania, są pokazane w zacienionym obszarze pod krzywą po prawej stronie. Ciecz o wyższej temperaturze \(\left( t_2 \right)\) ma więcej cząsteczek, które są zdolne do ucieczki do fazy parowej niż ciecz o niższej temperaturze \(\left (T_1 \right)\).
na wysokości 29 029 stóp \(\left( 8848 \: \text{m} \right)\), Mount Everest w Himalajach na granicy Chin i Nepalu jest najwyższym punktem na ziemi. Jego wysokość stwarza wiele praktycznych problemów wspinaczkom. Zawartość tlenu w powietrzu jest znacznie niższa niż na poziomie morza, co sprawia, że konieczne jest doprowadzenie zbiorników z tlenem (chociaż kilku wspinaczy osiągnęło szczyt bez tlenu). Innym problemem jest gotowanie wody do gotowania żywności. Chociaż woda gotuje się na \(100^ \ text{o} \ text {C}\) na poziomie morza, temperatura wrzenia na szczycie Mount Everestu wynosi tylko około \(70^\text{o} \text{C}\). Ta różnica sprawia, że bardzo trudno jest uzyskać przyzwoitą filiżankę herbaty (co zdecydowanie sfrustrowało niektórych brytyjskich wspinaczy).