17.3: Tworzenie jonów złożonych
wpływ tworzenia jonów złożonych na rozpuszczalność
co się dzieje z rozpuszczalnością soli trudno rozpuszczalnej, jeśli do roztworu dodaje się ligand, który tworzy stabilny jon kompleksowy? Jednym z takich przykładów jest konwencjonalna fotografia czarno-biała. Przypomnijmy, że czarno-biała folia fotograficzna zawiera światłoczułe mikrokryształy AgBr lub mieszaniny AgBr i innych halogenków srebra. AgBr jest solą trudno rozpuszczalną, o Ksp 5,35 × 10-13 w temperaturze 25°C. Kiedy migawka aparatu otwiera się, światło fotografowanego obiektu uderza w niektóre kryształy na filmie i inicjuje reakcję fotochemiczną, która przekształca AgBr w czarny Ag metal. Dobrze uformowane, stabilne obrazy negatywne pojawiają się w odcieniach szarości, odpowiadających liczbie ziaren AgBr przekonwertowanych, a obszary narażone na najbardziej jasne są najciemniejsze. Aby utrwalić obraz i zapobiec przekształceniu większej ilości kryształów AgBr w metal Ag podczas obróbki folii, niezreaktywowany AgBr na folii jest usuwany za pomocą reakcji kompleksowania w celu rozpuszczenia trudno rozpuszczalnej soli.
reakcja rozpuszczania bromku srebra wygląda następująco:
\
z
\
równowaga leży daleko w lewo, a stężenia równowagowe jonów Ag+ I Br-są bardzo niskie (7,31 × 10-7 M). W rezultacie usunięcie nieaktywnego AgBr z nawet jednej rolki folii przy użyciu czystej wody wymagałoby dziesiątek tysięcy litrów wody i dużo czasu. Zasada Le Chateliera mówi nam jednak, że możemy skierować reakcję na prawo, usuwając jeden z produktów, co spowoduje rozpuszczenie się większej ilości AgBr. Jon bromkowy jest trudny do chemicznego usunięcia, ale jon srebra tworzy wiele stabilnych kompleksów dwurzędowych z neutralnymi ligandami, takimi jak amoniak, lub z ligandami anionowymi, takimi jak cyjanek lub tiosiarczan (s2o32−). W obróbce fotograficznej nadmiar AgBr rozpuszcza się za pomocą stężonego roztworu tiosiarczanu sodu.
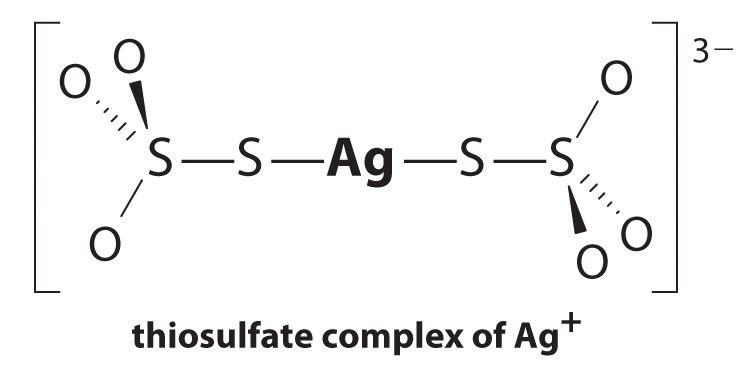
reakcja Ag+ z tiosiarczanem jest następująca:
\^{3−}_{(AQ)} \label{17.3.5A}\]
z
\
wielkość stałej równowagi wskazuje, że prawie wszystkie jony Ag+ w roztworze zostaną natychmiast skompleksowane przez tiosiarczan, tworząc 3−. Możemy zobaczyć wpływ tiosiarczanu na rozpuszczalność AgBr, pisząc odpowiednie reakcje i dodając je razem:
\\ \mathrm{Ag^+(AQ)}+\mathrm{2s_2o_3^{2-}(AQ)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f& = 2.9 \ czasy10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 15 \ end{align} \ label{17.3.6}\)
porównanie K z Ksp pokazuje, że tworzenie się jonu kompleksowego zwiększa rozpuszczalność AgBr o około 3 × 1013. Dramatyczny wzrost rozpuszczalności w połączeniu z niskim kosztem i niską toksycznością wyjaśnia, dlaczego tiosiarczan sodu jest prawie powszechnie stosowany do tworzenia czarno-białej folii. W razie potrzeby srebro można odzyskać z roztworu tiosiarczanu za pomocą dowolnej z kilku metod i poddać recyklingowi.
jeśli jon kompleksowy ma duży Kf, tworzenie jonu kompleksowego może znacznie zwiększyć rozpuszczalność trudno rozpuszczalnych soli.
przykład \(\PageIndex{2}\)
ze względu na wspólne działanie jonów, możemy oczekiwać, że sól taka jak AgCl będzie znacznie mniej rozpuszczalna w stężonym roztworze KCl niż w wodzie. Takie założenie byłoby jednak błędne, ponieważ ignoruje fakt, że Jon srebra ma tendencję do tworzenia dwurzędowego kompleksu z jonami chlorkowymi (AgCl2 -). Oblicz rozpuszczalność AgCl w każdej sytuacji:
- w czystej wodzie
- w 1,0 m roztworze KCl, ignorując tworzenie jakichkolwiek jonów złożonych
- tego samego roztworu, co w części (b), z wyjątkiem uwzględnienia tworzenia jonów złożonych, zakładając, że AgCl2− jest jedynym kompleksem Ag+, który tworzy się w znaczących stężeniach
w 25°C, Ksp = 1,77 × 10-10 dla AgCl i Kf = 1.1 × 105 dla AgCl2−.
podano: KSP AgCl, KF AgCl2-i stężenie KCl
zapytano o: rozpuszczalność AgCl w wodzie i w roztworze KCl z i bez tworzenia jonów złożonych
Strategia:
- napisz wyrażenie produktu rozpuszczalności dla AgCl i Oblicz stężenie Ag+ i Cl-w wodzie.
- Oblicz stężenie Ag+ w roztworze KCl.
- napisz zrównoważone równania chemiczne do rozpuszczania AgCl i do tworzenia kompleksu AgCl2. Dodaj dwa równania i Oblicz stałą równowagi dla równowagi ogólnej.
- napisz wyrażenie stałej równowagi dla ogólnej reakcji. Rozwiąż stężenie jonu kompleksowego.
rozwiązanie
- a jeśli pozwolimy, aby x było równe rozpuszczalności AgCl, to w równowadze = = x M. podstawiając tę wartość do wyrażenia iloczynu rozpuszczalności,
tak więc rozpuszczalność AgCl w czystej wodzie w temperaturze 25°C wynosi 1,33 × 10-5 M.
- B Jeśli x równa się rozpuszczalności AgCl w roztworze KCl, to w równowadze = x M i = (1,0 + x ) M. podstawiając te wartości do wyrażenia produktu rozpuszczalności i zakładając, że x << 1.0,
gdyby wspólny efekt jonowy był jedynym ważnym czynnikiem, przewidywalibyśmy, że AgCl jest około pięć rzędów wielkości mniej rozpuszczalny w 1,0 m roztworze KCl niż w wodzie.
- C aby uwzględnić skutki powstawania jonów złożonych, musimy najpierw napisać równania równowagi zarówno dla rozpuszczania, jak i tworzenia jonów złożonych. Dodanie równań odpowiadających Ksp i Kf daje nam równanie opisujące rozpuszczenie AgCl w roztworze KCl. Stała równowagi reakcji jest zatem iloczynem Ksp i Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2CL^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K_\textrm f& = 1.1 \ times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 1.9 \ times10^{-5} \ end{align}\)
D jeśli pozwolimy, aby x było równe rozpuszczalności AgCl w roztworze KCl, to w równowadze = x i = 1.0 − x. podstawiając te ilości do wyrażenia stałej równowagi dla reakcji netto i zakładając, że x << 1.0,
oznacza to, że AgCl rozpuszcza się w 1,0 M KCl, aby uzyskać 1,9 × 10-5 M roztworu jonu kompleksowego AgCl2. Tak więc przewidujemy, że AgCl ma w przybliżeniu taką samą rozpuszczalność w roztworze 1,0 M KCl, jak w czystej wodzie, która jest 105 razy większa niż przewidywana w oparciu o wspólny efekt jonowy. (W rzeczywistości zmierzona rozpuszczalność AgCl w 1,0 M KCl jest prawie o 10 większym czynnikiem niż w czystej wodzie, w dużej mierze ze względu na tworzenie innych kompleksów zawierających chlorki.)
ćwiczenia \(\PageIndex{2}\)
Oblicz rozpuszczalność jodku rtęci (II) (HgI2) w każdej sytuacji:
- czysta woda
- 3,0 M roztwór NaI, zakładając, że 2-jest jedynym gatunkiem zawierającym Hg występującym w znacznych ilościach
Ksp = 2,9 × 10-29 dla HgI2 i Kf = 6,8 × 1029 dla 2−.
Odpowiedz
- 1.9 × 10-10 M
- 1.4 M
środki kompleksujące, cząsteczki lub jony, które zwiększają rozpuszczalność soli metali poprzez tworzenie rozpuszczalnych kompleksów metali, są powszechnymi składnikami detergentów do prania. Długołańcuchowe kwasy karboksylowe, główne składniki mydeł, tworzą nierozpuszczalne sole z Ca2+ i Mg2+, które występują w wysokich stężeniach w “twardej” wodzie. Wytrącanie tych soli wytwarza pierścień wanny i nadaje szare zabarwienie odzieży. Dodanie środka kompleksującego, takiego jak Pirofosforan (O3POPO34− lub P2O74−) lub trifosforan (p3o105 -) do detergentów, zapobiega wytrącaniu się soli magnezu i wapnia, ponieważ stała równowagi dla tworzenia jonów złożonych jest duża:
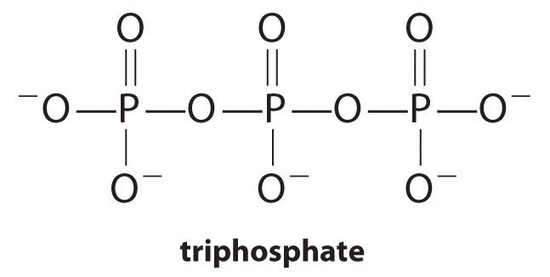
z
jednak fosforany mogą powodować szkody dla środowiska poprzez promowanie eutrofizacji, wzrostu nadmiernych ilości glonów w zbiorniku wodnym, co może ostatecznie doprowadzić do znacznego obniżenia poziomu rozpuszczonego tlenu, który zabija ryby i inne organizmy wodne. W związku z tym wiele stanów w Stanach Zjednoczonych zakazało stosowania detergentów zawierających fosforany, a Francja zakazała ich stosowania od 2007 roku. Detergenty “wolne od fosforanów” zawierają różne rodzaje czynników kompleksujących, takich jak pochodne kwasu octowego lub innych kwasów karboksylowych. Rozwój substytutów fosforanów jest obszarem intensywnych badań.
komercyjne zmiękczacze wody wykorzystują również czynnik kompleksujący do leczenia twardej wody poprzez przepuszczanie wody przez żywice jonowymienne, które są złożonymi solami sodowymi. Gdy woda przepływa przez żywicę, jon sodu rozpuszcza się, a nierozpuszczalne sole wytrącają się na powierzchnię żywicy. Woda oczyszczona w ten sposób ma bardziej słony smak ze względu na obecność Na+, ale zawiera mniej rozpuszczonych minerałów.
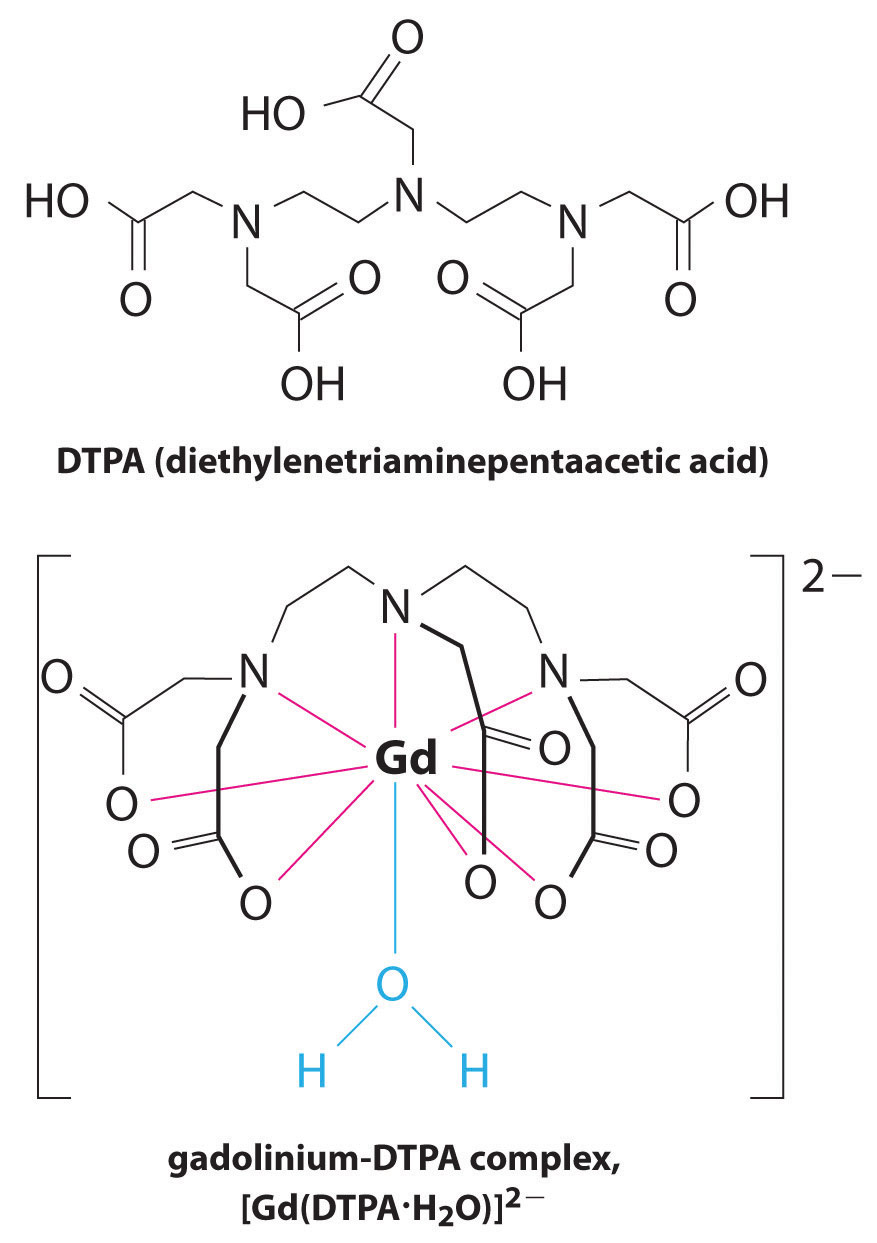
inne zastosowanie czynników kompleksujących znajduje się w medycynie. W przeciwieństwie do promieni rentgenowskich, rezonans magnetyczny (MRI) może dać stosunkowo dobre obrazy tkanek miękkich, takich jak narządy wewnętrzne. MRI opiera się na właściwościach magnetycznych 1h jądra atomów wodoru w wodzie, która jest głównym składnikiem tkanek miękkich. Ponieważ właściwości wody nie zależą zbytnio od tego, czy znajduje się ona wewnątrz komórki, czy we krwi, trudno jest uzyskać szczegółowe obrazy tych tkanek, które mają dobry kontrast. Aby rozwiązać ten problem, naukowcy opracowali klasę kompleksów metali znanych jako ” środki kontrastowe MRI.”Wstrzyknięcie środka kontrastowego MRI pacjentowi selektywnie wpływa na właściwości magnetyczne wody w komórkach prawidłowych tkanek, w guzach lub w naczyniach krwionośnych i pozwala lekarzom” zobaczyć ” każdy z nich osobno (rysunek \(\PageIndex{2}\)). Jednym z najważniejszych jonów metali w tym zastosowaniu jest Gd3+, który z siedmioma niesparowanymi elektronami jest wysoce paramagnetyczny. Ponieważ Gd3+(AQ) jest dość toksyczny, musi być podawany jako bardzo stabilny kompleks, który nie dysocjuje w organizmie i może być wydalany w stanie nienaruszonym przez nerki. Czynnikami kompleksującymi stosowanymi w gadolinie są ligandy, takie jak dtpa5− (dietylenotriamina pentaoctowy kwas), którego w pełni protonowana forma jest tutaj pokazana.
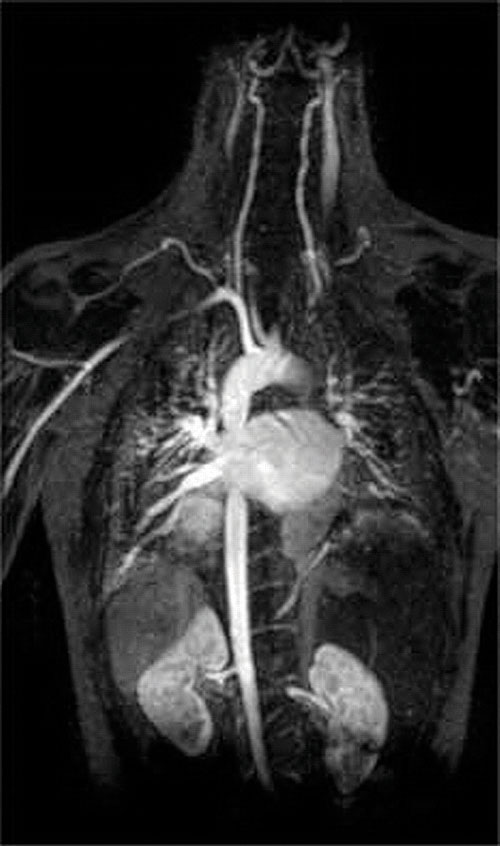
rysunek \(\PageIndex{2}\): obraz MRI serca, tętnic i żył. Gdy pacjentowi wstrzykuje się paramagnetyczny kation metalu w postaci stabilnego kompleksu znanego jako środek kontrastowy MRI, właściwości magnetyczne wody w komórkach ulegają zmianie. Ponieważ różne środowiska w różnych typach komórek reagują inaczej, lekarz może uzyskać szczegółowe obrazy tkanek miękkich.