2.3: tlenek węgla i backbonding
Ogólne właściwości
CO jest celowniczym ligandem typu L, który nie wpływa na stan utleniania centrum metalu podczas wiązania, ale zwiększa całkowitą liczbę elektronów o dwie jednostki. Ostatnio widzieliśmy, że w ligandzie karbonylowym istnieją naprawdę dwie interakcje wiązania: interakcja ligand-metal n → dσ i interakcja metal-ligand DN → π*. Ta ostatnia interakcja nazywa się backbondingiem, ponieważ metal przekazuje gęstość elektronów z powrotem do ligandu. Aby przypomnieć sobie o istnieniu backbondingu, lubię używać prawej struktury rezonansowej, gdy tylko jest to możliwe; jednak ważne jest, aby pamiętać o traktowaniu CO jako ligand typu L, bez względu na to, jaka forma rezonansu jest narysowana.

interakcje orbitalne W M = C = O.
CO jest silnym σ-dawcą (lub σ-zasadą) i dobrym π-akceptorem (lub π-kwasem). Właściwości ligowanego CO zależą głęboko od tożsamości centrum metalu. Dokładniej, właściwości elektroniczne centrum metalu dyktują znaczenie backbondingu w metalowych kompleksach karbonylowych. Najbardziej dosadnie, bardziej bogate w elektrony centra metali są lepsze w backbonding do CO. Dlaczego ważne jest, aby ustalić siłę backbonding?
spektroskopia w podczerwieni jest znana jako empiryczne wsparcie idei backbondingu. Poniższa tabela porządkuje niektóre kompleksy karbonylowe metali w porządku “okresowym”i podaje częstotliwość odpowiadającą trybowi rozciągania C = O. Zauważ, że bez wyjątku, każde skompleksowane CO ma częstotliwość rozciągania niższą niż free co. To wina backbondingu! Kolejność wiązania C-O W skompleksowanym tlenku węgla jest (prawie zawsze) niższa niż w przypadku wolnego co.

C = O częstotliwości rozciągania w kompleksach metal-karbonylowych. Coś tu nie gra?
powyższy rysunek przedstawia wyraźny wzrost częstotliwości (wzrost kolejności wiązania C–O), gdy poruszamy się od lewej do prawej po układzie okresowym. To odkrycie może wydawać się dziwne, jeśli weźmiemy pod uwagę, że liczba elektronów d w neutralnym metalu wzrasta, gdy poruszamy się od lewej do prawej. Czy centra metali z większą liczbą elektronów d nie powinny być lepsze w backbondingu (i bardziej “bogate w elektrony”)? Co tu się dzieje? Przypomnijmy okresowy trend w energii orbitalnej. Gdy poruszamy się od lewej do prawej, Energie orbitali d zmniejszają się, a energie orbitali DN i π* oddzielają się. W rezultacie, oddziaływanie orbitalne backbonding staje się gorsze (pamiętaj, że silne oddziaływania orbitalne wymagają dobrze dopasowanych energii orbitalnych), gdy idziemy w kierunku bardziej elektroujemnych metali późnego przejścia! Możemy narysować analogię do enamin i eterów enolowych z chemii organicznej. Bardziej elektroujemny atom tlenu w eterze enolowym jest gorszym donorem elektronów niż atom azotu enaminy.

znaczenie backbondingu zależy od elektroujemności metalu i jego gęstości elektronów.
oczywiście nie można również zapomnieć o wkładzie innych ligandów na metalowym środku do backbondingu. Logicznie, ligandy oddające elektrony będą miały tendencję do silniejszego backbondu (sprawiają, że metal jest lepszym dawcą elektronów), podczas gdy ligandy wycofujące elektrony pogorszą backbonding. Dodanie bogatych w elektrony ligandów fosfinowych do centrum metalu, na przykład, zmniejsza częstotliwość rozciągania CO z powodu ulepszonego backbondingu.
ligandy karbonylowe są doskonale zdolne do mostkowania wielu ośrodków metalowych. Wiązanie w mostkowanych kompleksach karbonylowych może być “tradycyjne” lub delokalizowane, w zależności od struktury kompleksu i sposobu mostkowania. Różnorodność trybów mostkowania wynika z różnych donorów i akceptorów elektronów obecnych na co ligandzie (oraz możliwości delokalizacji wiązania). Znane tryby pomostowania przedstawiono na rysunku poniżej.
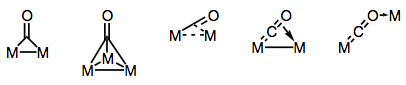
budowanie mostów z ligandami karbonylowymi!