25.6: koenzym B12 – Witamina B12
kobalamina, czyli witamina B12, jest największą i najbardziej złożoną spośród wszystkich rodzajów witamin. Odkrycie kobalaminy zostało dokonane, gdy naukowcy starali się znaleźć lekarstwo na niedokrwistość złośliwą, chorobę anemiczną spowodowaną brakiem wewnętrznego czynnika w żołądku. Kobalaminę badano, oczyszczano i gromadzono w małe czerwone kryształy, a jej strukturę krystalizacyjną określono podczas eksperymentu analizy rentgenowskiej przeprowadzonego przez naukowca Hodkina. Struktura cząsteczkowa kobalaminy jest prosta, ale zawiera wiele różnych odmian i kompleksów, jak pokazano na fig. Badanie struktury molekularnej witaminy pomaga naukowcom lepiej zrozumieć, w jaki sposób organizm wykorzystuje witaminę B12 do budowania czerwonych krwinek i zapobiegania zespołom niedokrwistości złośliwej.
1
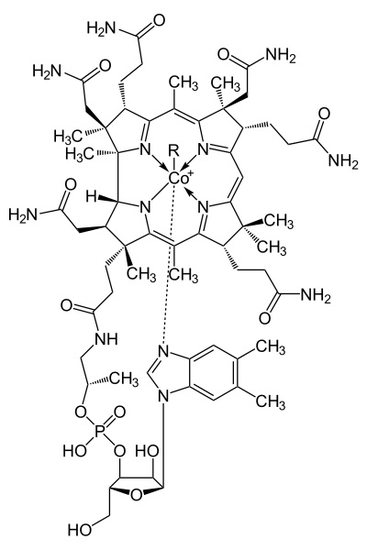
metaloenzymowa struktura kobalaminy przedstawia pierścień korrynowy z kobaltem, jedynym metalem w cząsteczce, umieszczony w środku struktury przez cztery skoordynowane wiązania azotu z czterech grup pirolowych. Te cztery grupy podjednostek są rozdzielone równomiernie na tej samej płaszczyźnie, bezpośrednio naprzeciwko siebie. Są one również połączone ze sobą przez ogniwo metylenowe C-CH3 po drugiej stronie, przez C-H po jednej stronie i przez dwa pirole bezpośrednio łączące się ze sobą. Razem tworzą doskonały pierścień Corrina, jak pokazano na fig. Piąty ligand połączony z kobaltem to azot pochodzący z 5,6-dimethylobenzimidazolu. Przedstawia się jako osiowa biegnąca prosto w dół od kobaltu tuż pod pierścieniem Corrina. Ten benzimidazol jest również połączony z cukrem pięciowęglowym, który ostatecznie przyłącza się do grupy fosforanowej, a następnie łączy się z resztą struktury. Ponieważ osiowy jest rozciągnięty w dół, wiązanie między kobaltem a 5,6-dimetylobenzimidazolem jest słabe i może być czasami zastąpione przez pokrewne cząsteczki, takie jak 5-hydrozylo-benzimidazol, adenina lub inna podobna grupa. W szóstej pozycji powyżej pierścienia Corrina, miejsce aktywne kobaltu może bezpośrednio łączyć się z kilkoma różnymi rodzajami ligandów. Może łączyć się z CN tworząc Cyjanokobalami, z grupą metylową tworząc metylokobalaminę, z grupą 5 ‘ – deoksyadenozy tworząc adenozylokobalaminę i OH, Hydroksykobalaminę. Kobalt jest zawsze gotowy do utlenienia ze zmiany 1+ na 2 + i 3+, aby dopasować się do tych grup R, które są z nim połączone. Na przykład Hydroksykobalamina zawiera kobalt, który ma ładunek 3+, podczas gdy Metyloadenozyl zawiera kobalt, który ma ładunek 1+.
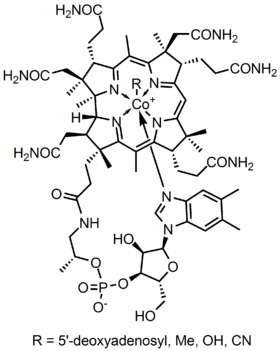
Rysunek 2
konfiguracją grupy punktowej kobalaminy jest C4v. aby określić tę symetrię, należy zobaczyć, że struktura jest w stanie obrócić się cztery razy i ostatecznie powrócić do pierwotnej pozycji. Ponadto nie ma płaszczyzny sigma h i prostopadłej osi C2. Jednakże, ponieważ istnieją płaszczyzny sigma v, które przecinają cząsteczki na parzyste części, jasne jest ustalenie, że struktura kobalaminy jest C4v. z kobaltem będącym centralnym metalem cząsteczki, kobalamina miała zniekształconą konfigurację oktaedryczną. Osiowy, który łączy kobalt z 5,6 dimetyl benzimidazolem jest rozciągnięty aż do dna. Jego odległość jest kilkukrotnie większa niż odległość od kobaltu i dołączonej nad nim grupy R. Czasami można to również określić jako strukturę tetragonalną. Cały kształt jest podobny do ośmiościanu, ale dwie grupy osiowe są różne i podzielone na nierówne odległości. Ponieważ w systemie jest tylko jedno centrum metaloenzymu, wspomniana grupa punktowa i konfiguracja są również przypisane do struktury jako całości. Ponieważ struktura metalokoenzymu jest rozciągnięta, jest ona dość słabo skoordynowana i może zostać rozerwana lub zastąpiona innymi grupami, jak wspomniano powyżej.
naukowcy wykazali, że zarówno spektroskopia IR, jak i Raman zostały użyte do określenia struktury cząsteczki. Jest to określone przez obserwację tabel znaków grupy punktowej C4v, symetrii grupy punktowej kobalaminy. Po stronie IR widać, że istnieją grupy takie jak drz, (x, y), (rz, ry). Z drugiej strony, po stronie Ramana, istnieją grupy takie jak x kwadrat +y kwadrat, z kwadrat, x kwadrat – y kwadrat, xy, xz, yz. Strona Ramanowa wskazywała, że w cząsteczce występują tryby rozciągania i odnosi się do rozciągania osiowego 5,6 dimetylu benzimidazolu, który łączy się bezpośrednio pod metalem kobaltu. Rozciąganie można zobaczyć na rysunku 3.
3
enzymy kobalaminy mogą katalizować kilka różnych rodzajów reakcji. Jednym z nich jest reakcja Wewnątrzcząsteczkowych rearanżacji. Podczas tej przegrupowania koenzym jest wymieniany na dwie grupy przyłączone do sąsiednich atomów węgla. Inna reakcja polega na przeniesieniu grupy metylowej w pewnych reakcjach metylacji, takich jak konwersja homocysteiny do metioniny, biosynteza choliny i tyminy itp. Interakcje te mogą przynieść korzystne wartości organizmom biologicznym.
kobalamina ma wiele korzystnych efektów w odniesieniu do istnienia biologicznego. Odgrywają one rolę w utrzymaniu zdrowego systemu ciała i pomagają w produkcji materiałów genetycznych organizmu. Cyjanokobalamina, jeden rodzaj kobalaminy, działa w celu generowania tworzenia czerwonych krwinek i leczy wiele różnych uszkodzeń układu nerwowego. Kobalamina pełni również istotną rolę w metabolizmie kwasów tłuszczowych niezbędnych do utrzymania mieliny. Badania wykazały, że osoby z niedoborem witaminy B12 ujawnią nieregularne niszczenie żyłki, co prowadzi do parlizy i śmierci. Niektóre z innych objawów braku kobalaminy to słaby wzrost, megaloblastyczny szpik kostny, zmiany w przewodzie pokarmowym, Leukoopenia i hiper segmentowane nutrofile, zmiany zwyrodnieniowe w rdzeniu kręgowym i układzie nerwowym oraz wydalanie kwasu metylomalonowego i homocystyny z moczem.
przez lata Witamina B12 okazała się niezbędna do funkcjonowania układu nerwowego i produkcji czerwonych krwinek. Badanie przeprowadzone przez naukowców z National Institutes of Health, Trinity College Dublin, zasugerowało, że niedobór witaminy B12 może zwiększyć ryzyko defektu cewy nerwowej u dzieci (Miller). Dlatego badając strukturę i funkcję kobalaminy, naukowcy mogą eksperymentować i tworzyć witaminę B12 w swoich laboratoriach i służyć społeczności jako całości.