7.4: Kompleks III
Kompleks III przyjmuje elektrony zarówno z kompleksu i, jak i kompleksu II. elektrony przybywają w postaci ubichinolu, UQH2, który dostarcza dwa elektrony i dwa protony i jest przekształcany z powrotem do ubichinonu, UQ. Ubichinon następnie wraca do kompleksu I lub kompleksu II, aby zebrać więcej elektronów.
- Kompleks III jest miejscem docelowym dla elektronów przybywających zarówno z kompleksu i, jak i kompleksu II.
- Kompleks III wykorzystuje energię uwalnianą podczas przenoszenia elektronów w dół do pompowania większej ilości protonów przez wewnętrzną błonę mitochondrialną.
- gradient protonu w błonie jest używany do napędzania tworzenia ATP w kompleksie V.
- Kompleks III następnie wysyła swoje elektrony do kompleksu IV.
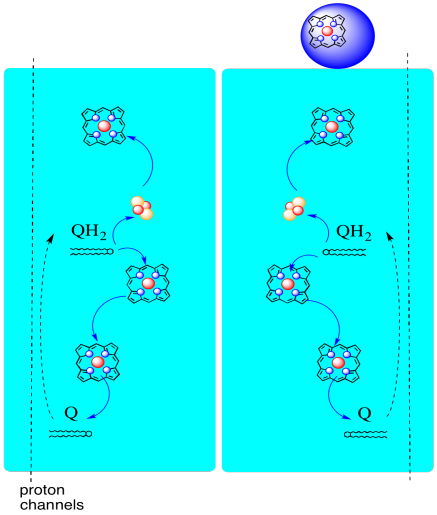
droga elektronów przez kompleks III jest pokazana poniżej. Zauważ, że kompleks jest strukturą dimeryczną, z dwiema równoważnymi ścieżkami: jedną pokazaną po lewej i drugą po prawej stronie. Elektrony są dostarczane z uqh2, ubichinolu, w środku obrazu, podróżując w górę do ruchomego cytochromu c na górze. Drugi szlak elektronowy umożliwia podróż w dół na obrazie, w kierunku innej cząsteczki ubichinonu, która przetwarza elektrony w pętli.
- Kompleks III charakteryzuje się niezwykłym, rozbieżnym szlakiem elektronów.
- jeden elektron porusza się w kierunku cytochromu c.
- drugi elektron jest ostatecznie zawracany do innego ubichinolu.
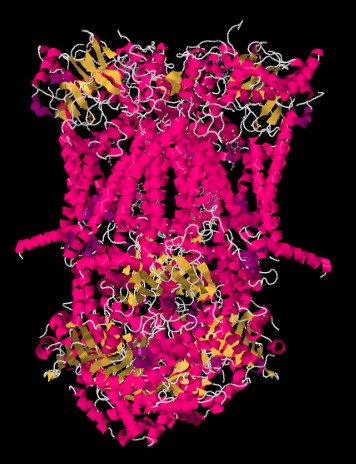
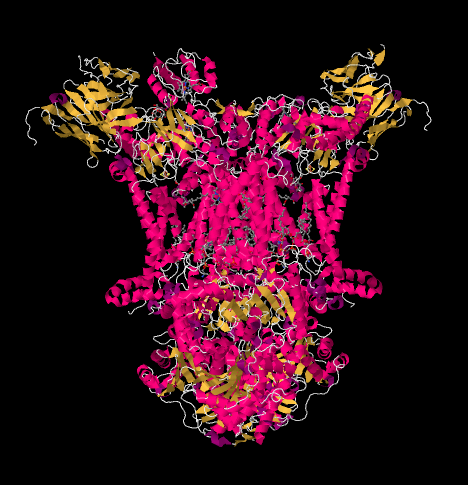
struktura rentgenowska kompleksu III przedstawiona jest w formie rysunkowej poniżej. Wewnętrzna błona mitochondrialna przecinałaby górną środkową część kompleksu. Większość złożonych projektów poniżej, w matrycy (na dole obrazu, w tej orientacji), choć znaczna ilość również wystaje w Przestrzeń międzymałżonkową.
Kompleks III kontynuuje łańcuch transportu elektronów, wysyłając elektrony do wyższego potencjału redukcji (i niższej energii swobodnej) i w kierunku spotkania z cząsteczkowym tlenem w kompleksie IV. Protony są również pompowane z macierzy mitochondrialnej, przez wewnętrzną błonę mitochondrialną i do przestrzeni międzybłonowej. W tym samym czasie, druga droga elektronów skutkuje skutecznym recyklingiem połowy elektronów, które wchodzą do kompleksu, zwiększając liczbę protonów pompowanych na elektron docierający do kompleksu III.
- zasugerowano, że pętla recyklingu elektronów zapewnia mechanizm pobierania większej ilości protonów z matrycy.
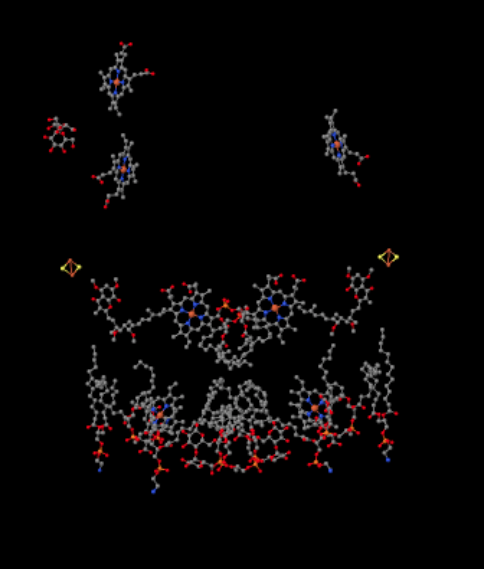
możemy zobaczyć ten niezwykły układ, jeśli zignorujemy białka, aby ujawnić ligandy, poniżej. Kompleks może być wyraźniej postrzegany jako dimer; lewa połowa obrazu jest dokładnie taka sama jak prawa, chociaż odbija się w przeciwnym kierunku. Elektrony wchodzą do kompleksu za pośrednictwem ruchomego nośnika, ubichinolu, widocznego po prawej i lewej stronie obrazu mniej więcej w połowie drogi w dół; można zobaczyć pierścień i zwisający z niego łańcuch.
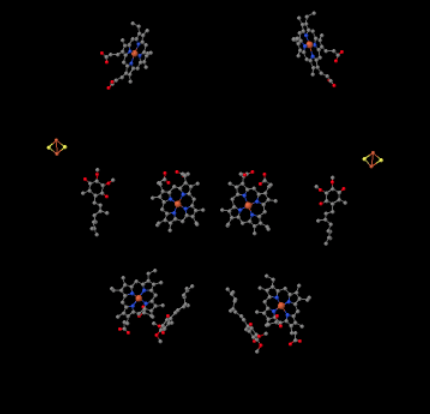
gdy Uqh2 wiąże się z kompleksem III, jeden elektron jest wysyłany do gromady FeS, podczas gdy drugi jest wysyłany do centrum hemu żelaza, zwanego hem BL. Gromada FeS widoczna jest tuż nad ubichinolem i na krawędzi obrazu. Hem BL jest w kierunku środka obrazu.
chociaż nie widać tego na zdjęciu rentgenowskim, ta gromada FeS jest inna niż te, które widziałeś wcześniej. Ten jest utrzymywany w miejscu z różnymi łańcuchami bocznymi aminokwasów. Nie widać tego na zdjęciu, ponieważ całe białko zostało pominięte, wraz z aminokwasami wiążącymi się z klastrem. Podczas gdy większość klastrów FeS jest utrzymywana wyłącznie przez cysteiny, klaster ten jest utrzymywany w miejscu przez dwa cysteiny z jednej strony, ale przez dwie histydyny z drugiej. Ta osobliwa Gromada FeS nazywana jest gromadą Rieske.
klastry Rieske są ważne, ponieważ są “klastrami Fes o wysokim potencjale”. Oznacza to, że mają wyjątkowo pozytywny potencjał redukcji w porównaniu do innych klastrów FeS. Potencjał redukcji dowolnego ligandu w białku jest w dużym stopniu zależny od jego środowiska, a więc w większości przypadków istnieje szeroki zakres wartości. To prawda dla klastrów żelaza i siarki; normalne mają potencjały redukcyjne w zakresie od -1,0 V do około +0,05 V. klastry Rieske mają potencjały w zakresie od około 0 V do około 0,4 V.
z klastra FeS elektron jest wysyłany do innego centrum hemu żelaza w jednostce związanej z błoną zwaną cytochromem c1. Cytochrom c1 widać u góry obrazu. Ponieważ ten obraz jest zorientowany w taki sam sposób, jak inne struktury rentgenowskie kompleksu oddechowego, widzimy, że elektron jest transportowany w górę w kierunku przestrzeni międzybłonowej. Wreszcie, ten elektron jest przenoszony do innego hemu, ale ten hem jest związany w małym, ruchomym białku, zwanym cytochromem C. cytochrom c jest kolejnym mobilnym nośnikiem elektronów. Przenosi elektron do kompleksu IV. wrócimy do cytochromu c nieco później.
zanim do tego dojdziemy, gdzie idzie drugi elektron? Z hemu BL drugi elektron przechodzi do innego kompleksu Żelazowej porfiryny, hemu BH. To jest w kierunku dołu obrazu, więc elektron jest wysyłany z powrotem w kierunku matrycy. Czekając na Hem BL, istnieje jednak inny ubichinon, UQ. Czeka na elektron. W rzeczywistości będzie czekać na dwa, a następnie opuścić stację dokującą i wrócić do miejsca wiązania ubichinolu (UQH2), aby ponownie dostarczyć elektrony.
po co się męczyć? Dlaczego po prostu nie wysłać elektronów w drodze prawidłowo za pierwszym razem? Wygląda na to, że z jakiegoś powodu są poddawane recyklingowi. Uważa się, że ta dywersja pozwala na pompowanie dodatkowych protonów przez błonę mitochondrialną. Kiedy drugi ubichinon zostaje zredukowany do ubichinolu poprzez akceptację dwóch elektronów, odbiera on jeszcze dwa protony z matrycy poniżej. Protony te zostaną ostatecznie przekazane w kierunku przestrzeni międzybłonowej, gdy ubichinol zostanie ponownie utleniony. Ten recykling i wyciskanie kilku dodatkowych protonów w celu zwiększenia gradientu protonów nazywa się pętlą Q.
zaletę pętli Q wyjaśniono na poniższym diagramie. Na diagramie, wejścia do kompleksu III są pokazane na Czerwono, wyjścia są pokazane na niebiesko, a elementy pochodzące z recyklingu są na Zielono. Jeśli jeden ubichinol po prostu dostarczyłby swoje elektrony i protony, to na ubichinol dostarczono by dwa protony. To jeden proton na elektron, który był na wejściu.
drugi ubichinol zrobiłby dokładnie to samo. Będą cztery protony wyjściowe dla czterech elektronów początkowo wejściowych. To wciąż jeden proton na elektron, który był na wejściu.
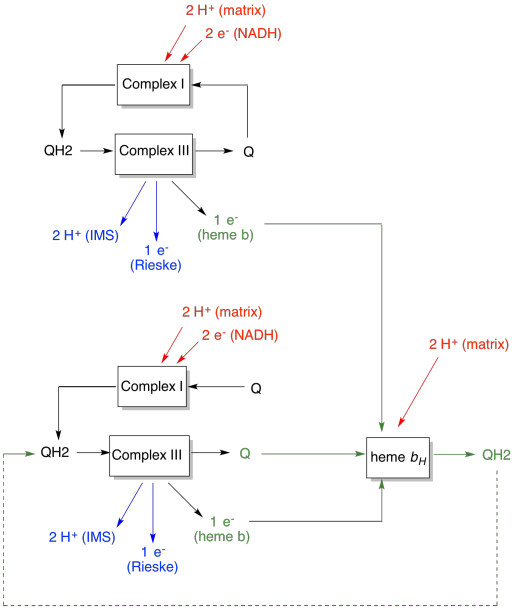
jeśli zamiast tego jeden elektron jest zawracany za każdym razem, to co drugi ubichinol prowadzi do dostarczenia dodatkowej pary protonów. To dlatego, że pobierając elektrony, ubichinon musiał wrócić do matriksowej strony membrany i zebrać jeszcze dwa protony. Ogólnie rzecz biorąc, oznacza to, że sześć protonów jest dostarczanych na wejście czterech elektronów, lub 1,5 protonów na wejście elektronu. Ponieważ gradient protonu jest tym, co wytwarza ATP, to poprzez zwiększenie liczby protonów pompowanych na jeden elektron, zwiększa się wydajność.
- pętla Q zwiększa liczbę protonów pompowanych na jeden elektron wejściowy do układu.
wróćmy teraz do wychodzącego nośnika elektronów, cytochromu c, który przenosi elektrony do kompleksu IV. Na poniższym zdjęciu, z innej struktury krystalicznej rentgenowskiej, kompleks został znaleziony z cyktochromem c w miejscu wiązania. Cytochrom c jest różowym białkiem kulistym przyłączonym u góry obrazu, po lewej stronie dimeru. Znajduje się na skraju przestrzeni międzymięśniowej, która jest wodnym medium. W przeciwieństwie do ubichinonu, który prześlizguje się przez dwuwarstwę lipidową błony, cytochrom c zwija się lub ślizga lub pływa na szczycie do miejsca przeznaczenia.
ten sam widok jest pokazany poniżej bez białka. Dolna część obrazu jest dość zaśmiecona lipidami, a w lewym górnym rogu wisi cukier, ale na samej górze widać żelazną porfirynę, która znajduje się wewnątrz cytochromu c.
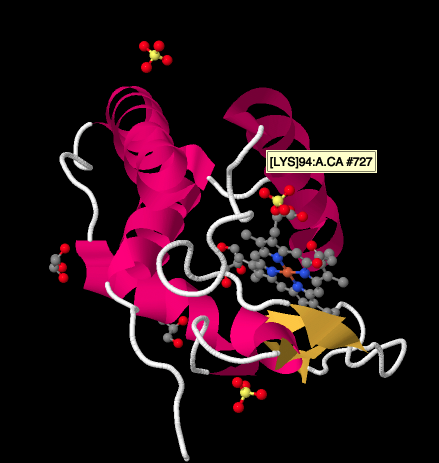
bliższe spojrzenie na strukturę rentgenowską cyktochromu c, poniżej, pokazuje stosunkowo prosty obraz w porównaniu do kompleksów, na które patrzyliśmy. Istnieje kilka helisy, kilka arkuszy, kilka pętli, i że żelaza porfiryny lub hemu ponownie. W pobliżu krąży kilka jonów siarczanowych, a także kilka cząsteczek glicerolu, prawdopodobnie wprowadzonych podczas oczyszczania lub krystalizacji białka. Zauważ, że hem znajduje się na krawędzi białka. Ta lokalizacja może ułatwić przenoszenie elektronów z kompleksu III lub do kompleksu IV.
- cytochrom c jest końcowym miejscem przeznaczenia elektronów poruszających się przez kompleks III.
- cytochrom C jest ruchomym, jednoelektronowym nośnikiem.
- cytochrom c jest w rzeczywistości małym, hydrofilowym białkiem.
- cytochrom c znajduje się nad błoną mitochondrialną, na skraju przestrzeni międzybłonowej.
co powstrzymuje cyctochrom c przed wędrówką w Przestrzeń międzybłonową? Gdyby tak się stało, przerwałoby to efektywny przepływ elektronów. Możliwe jest, że cytochrom c porusza się tam i z powrotem pomiędzy kompleksem III i kompleksem IV za pomocą mechanizmu zwanego “sterowaniem”. W sterowaniu nośnik jest prowadzony wzdłuż ścieżki za pomocą ładunków uzupełniających. Na przykład, jeśli błona jest naładowana ujemnie z powodu grup biegunowych na powierzchni błony, to dodatnie ładunki na powierzchni cytochromu c mogą ograniczyć jej ruch do powierzchni błony. Samo to zmniejszyłoby jego ruchliwość z trzech wymiarów (w dowolnym miejscu przestrzeni międzybłonowej) do dwóch wymiarów (w dowolnym miejscu na powierzchni membrany). Możliwe jest, że dodatkowe interakcje zmniejszają jego mobilność jeszcze bardziej do jednowymiarowej ścieżki między dwoma kompleksami.
- sterowanie, oparte na ładunkach uzupełniających, zapobiega utracie cytochromu c w przestrzeni międzybłonowej.
ćwiczenia \(\PageIndex{1}\)
sugerują możliwe reszty aminokwasowe na powierzchni cytochromu c, które mogą pomóc mu pozostać na ujemnie naładowanej powierzchni błony.
Odpowiedz
Arginina i lizyna są naładowane dodatnio przy neutralnym pH.
ćwiczenia \(\PageIndex{2}\)
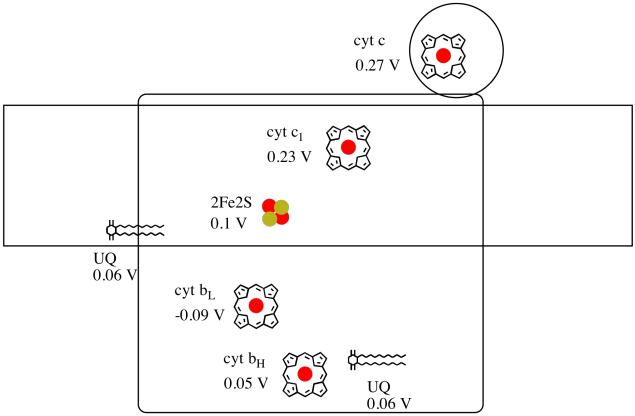
trudno jest zmierzyć potencjał redukcji pojedynczego miejsca w obrębie białka. Jednak naukowcy byli w stanie oszacować te wartości, mierząc widma EPR w różnych warunkach. Zakładając potencjały redukcji poniżej, narysuj diagram postępu reakcji dla transportu elektronu przez całą drogę od początkowego dawcy ubichinonu aż do cytochromu c.
 odpowiedź
odpowiedź
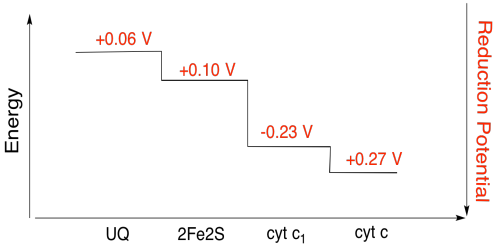
ćwiczenia \(\PageIndex{3}\)
korzystając z wartości na powyższym rysunku, obliczyć zmianę energii, gdy elektron jest przenoszony z klastra 2fe2s do cytochromu c1.
odpowiedź
zakładając, że potencjały redukcji wynoszą:
2fe2s(ox) + e- → 2fe2s(red) Eored = 0,10 V
cyt C1(ox) + e- → cyt C1(red) Eored = 0,230 V
wtedy różnica potencjałów reakcji, ΔEo = 0,23 – (
relacja Faradaya δg = – n f δeo daje
δg = – 1 x 96,485 j v-1 mol-1 x 0,13 v = 12,543 J mol-1 = 12.5 kJ mol-1
ćwiczenia \(\PageIndex{4}\)
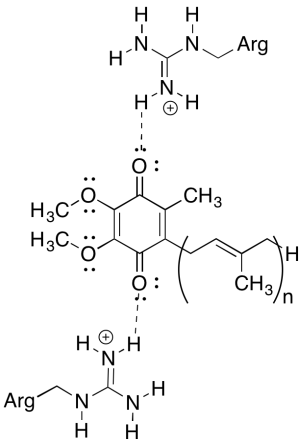
jedną z kłopotliwych rzeczy na temat tego kompleksu jest to, że w pętli recyklingu elektronów, transfer elektronów wydaje się iść z początkowego ubichinonu do końcowego ubichinonu, bez ogólnej siły napędowej. Jednak potencjały redukcji są bardzo wrażliwe na środowisko. Pokaż, jak pobliskie pozostałości argininy mogą zwiększyć potencjał redukcji ubichinonu.
odpowiedź
dodatnie reszty argininy nadawałyby częściowy ładunek dodatni ubichinonowi poprzez wiązanie wodorowe; w rezultacie ubichinon miałby bardziej pozytywny potencjał redukcji.
zobacz stronę poświęconą strukturze kompleksu III w Biochemia Online.
Struktura kryształu rentgenowskiego kompleksu III z: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. strukturalne podstawy redukcji chinonów w kompleksie BC1: analiza porównawcza struktur krystalicznych mitochondrialnego cytochromu bc1 z związanym substratem i inhibitorami w miejscu Qi. Biochemistry 2003, 4, 9067-9080. (1ntz)
Struktura kryształu rentgenowskiego kompleksu III ze związanym cytochromem c z: Solmaz, S. R., Hunte, C. struktura kompleksu III ze związanym cytochromem c w stanie zredukowanym i definicja minimalnego interfejsu rdzenia dla elektronransferu. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
X-ray crystal structure of cytochrom c from: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. Structural evidence for a proton transfer pathway coupled with haem reduction of cytochrom c ” from Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)