Claisen Rearrangement
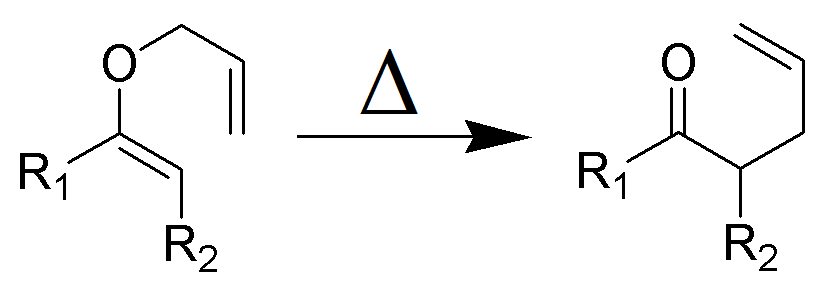
the Claisen rearrangement (nie mylić z kondensacją Claisena) to silna reakcja chemiczna tworząca Wiązanie węgiel–węgiel odkryta przez Rainera Ludwiga Claisenina w 1912 roku. Ogrzewanie eteru allilowego winylu zainicjuje przegrupowanie a-sigmatropowe, dając γ, δ-nienasycony karbonyl.
Rysunek 1: Wikimedia (Praca własna) – sigmatropic rearanżation.
rearanżacja Claisena jest egzotermiczną, zgodną (rozszczepienie wiązania i rekombinacja) reakcją pericykliczną. Zasady Woodwarda-Hoffmanna pokazują nadfazową, stereospecyficzną ścieżkę reakcji. Kinetyka jest pierwszego rzędu, a cała transformacja przechodzi przez wysoce uporządkowany cykliczny stan przejściowy i jest wewnątrzcząsteczkowa. Eksperymenty Crossover eliminują możliwość rearanżacji zachodzącej za pośrednictwem mechanizmu reakcji międzycząsteczkowej i są zgodne z procesem wewnątrzcząsteczkowym.
w przegrupowaniu Claisena obserwuje się znaczące efekty rozpuszczalnikowe, w których rozpuszczalniki polarne mają tendencję do przyspieszania reakcji w większym stopniu. Rozpuszczalniki wiążące Wodór dawały najwyższe stałe szybkości. Na przykład mieszaniny rozpuszczalników etanol/woda dają stałe szybkości 10-krotnie wyższe niż sulfolan. Wykazano, że trójwartościowe odczynniki metaloaluminium, takie jak trimetyloaluminium, przyspieszają tę reakcję.
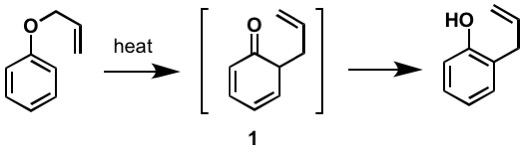
pierwsza zgłoszona rearanżacja Claisena to-sigmatropowa rearanżacja eteru allilofenylowego do pośredniego 1, który szybko tautomeryzuje do Orto-podstawionego fenolu.
Rysunek 2: Autor: Kchemyoung (Praca własna) , via Wikimedia Commons
rearanżacja Ireland-Claisen
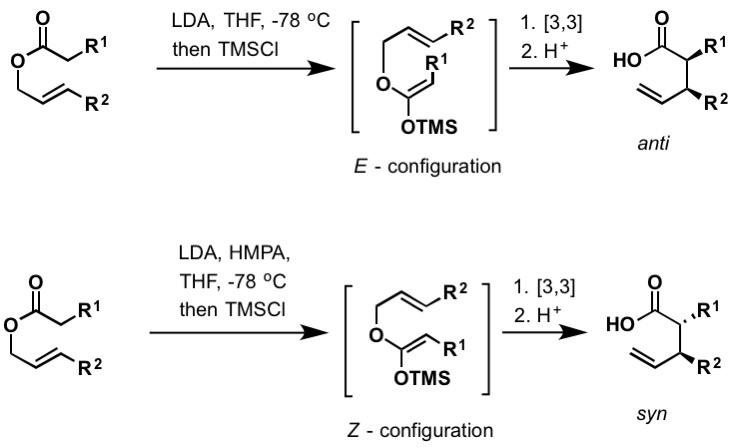
rearanżacja Ireland–Claisen jest reakcją karboksylanu allilowego z silną zasadą (taką jak diizopropyloamid litu) w celu uzyskania γ,δ-nienasyconego kwasu karboksylowego. Przegrupowanie przebiega przez Acetal sililoketenowy, który powstaje przez zatrzymanie enolanu litu za pomocą chlorotrimetylosilanu. Podobnie jak Bellus-Claisen (powyżej), rearanżacja Irlandii-Claisen może odbywać się w temperaturze pokojowej i powyżej. Acetale sililoketenu z konfiguracją E i Z prowadzą odpowiednio do produktów anty – i syntetycznych. Istnieje wiele przykładów enancjoselektywnych rearanżacji Irlandii-Claisena znalezionych w literaturze, które obejmują chiralne odczynniki boru i zastosowanie chiralnych środków pomocniczych.
Rysunek 5: zdjęcie użyte za zgodą (CC BY-SA 4.0; Kchemyoung)
przegrupowanie Johnsona-Claisena
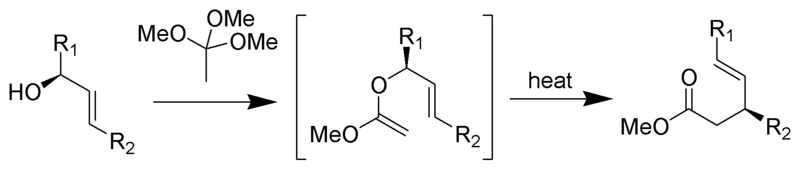
przegrupowanie Johnsona-Claisena jest reakcją alkoholu allilowego z ortoestrem, w wyniku której otrzymuje się γ, δ – nienasycony ester. Słabe kwasy, takie jak kwas propionowy, zostały użyte do katalizowania tej reakcji. Ta zmiana układu często wymaga wysokich temperatur (100 do 200 °C) i może trwać od 10 do 120 godzin. Jednak ogrzewanie wspomagane mikrofalowo w obecności KSF-gliny lub kwasu propionowego wykazało dramatyczny wzrost szybkości reakcji i wydajności.
Mechanizm:
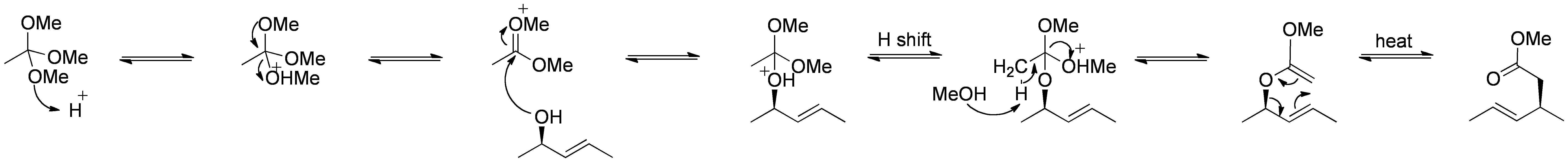
by self Made by RAN 10 ( – ), via Wikimedia Commons
Photo-Claisen rearrangement
Photo-Claisen rearrangement jest ściśle związany z Photo-Fries rearrangement, która przebiega przez podobny radykalny mechanizm. Etery arylowe ulegają fotoklasycznej rearanżacji, podczas gdy fotoklasyczna rearanżacja wykorzystuje estry arylowe.
Hetero-Claisens
Aza-Claisen
iminium może służyć jako jedno z Pi-wiązanych ugrupowań w przegrupowaniu.
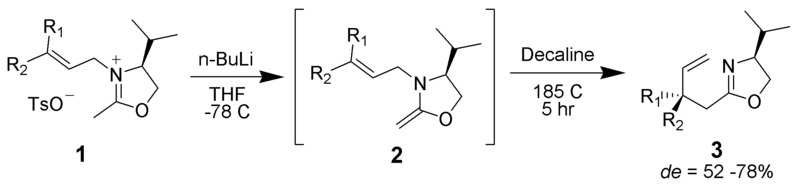
przez żadnego autora nadającego się do odczytu maszynowego. ~ K. (w oparciu o roszczenia autorskie). , via Wikimedia Commons
utlenianie chromu
chrom może utleniać alkohole allilowe do nienasyconych ketonów alfa-beta po przeciwnej stronie nienasyconego wiązania z alkoholem. Dzieje się tak poprzez wspólną reakcję hetero-Claisena, chociaż istnieją mechanistyczne różnice, ponieważ atom chromu ma dostęp do orbitali D – shell, które umożliwiają reakcję pod mniej ograniczonym zestawem geometrii.
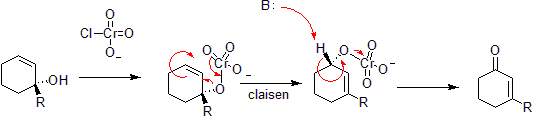
przez oryginalnego uploadera był takometr w Angielskiej Wikipedii-Phosphorimidate Rearrangement lub reakcja Staudingera-Claisena instaluje fosforyn w miejsce alkoholu i wykorzystuje redukcję Staudingera, aby przekształcić ją w iminę. Późniejsze Claisen wynika z faktu, że wiązanie podwójne P=O jest bardziej korzystne energetycznie niż wiązanie podwójne p = n.
.png?revision=1&size=bestfit&width=660&height=112)
przez Howcheng w en.wikipedia, via Wikimedia Commons
przegrupowanie Overmana
przegrupowanie Overmana (nazwane na cześć Larry ‘ ego Overmana) jest przegrupowaniem Claisena trichloroacetimidanów allilowych na trichloroacetamidy allilowe.
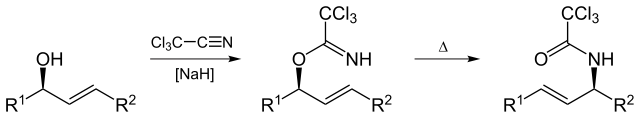
By Yikrazuul (Praca własna) , via Wikimedia Commons
Overman rearanżacja ma zastosowanie do syntezy vicinolu diamino comp z 1,2 vicinal Allyl diol.
zwitterionic Claisen rearrangement
w przeciwieństwie do typowych, wymagających ogrzewania, zwitterionic Claisen rearrangement ma miejsce w temperaturze pokojowej lub poniżej. Jony acylowo-amonowe są wysoce selektywne dla z-enolanów w łagodnych warunkach
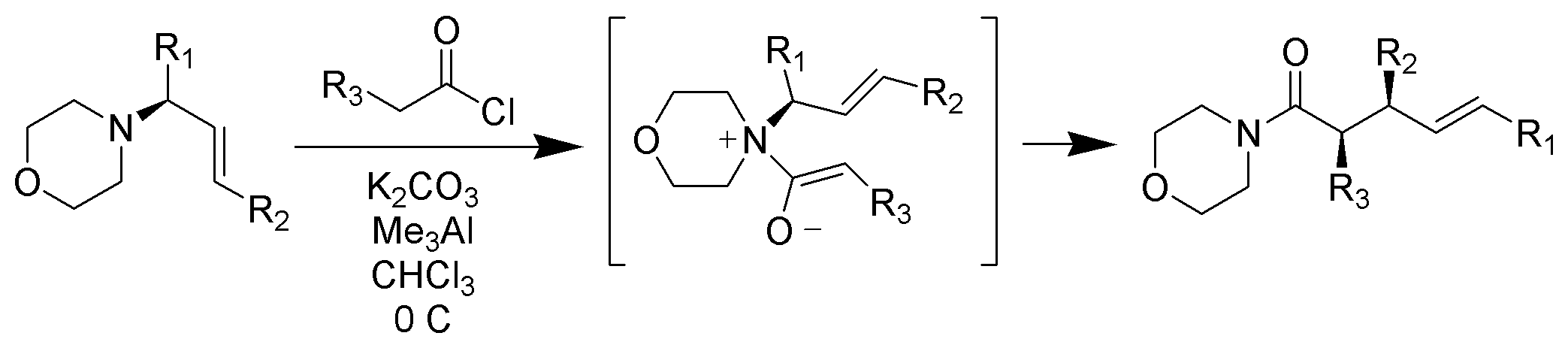
https://upload.wikimedia.org/wikiped…ent_Scheme.png
Claisen rearrangement in nature
the enzym Chorismate mutase (EC 5.4.99.5) katalizuje zmianę Claisena jonu chorismate do jonu prephenate, kluczowego związku pośredniego w szlaku kwasu shikimowego (szlak biosyntetyczny w kierunku syntezy fenyloalaniny i tyrozyny).
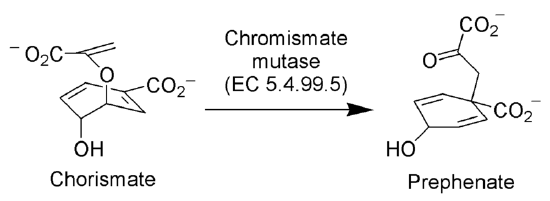
przez żadnego autora nadającego się do odczytu maszynowego. ~ K. (w oparciu o roszczenia autorskie). , via Wikimedia Commons