Co To jest Walidacja systemu komputerowego i jak to zrobić dobrze?

proces walidacji oprogramowania zapewnia, że system pasuje do zamierzonego zastosowania i działa tak, jak powinien. Walidacja systemów komputerowych (CSV) dla informatyki laboratoryjnej jest niezbędna, ponieważ regulowane przedsiębiorstwa muszą zapewnić bezpieczeństwo swoich produktów dla konsumentów, a ich systemy informatyki laboratoryjnej (LIMS, ELN, CDS) są integralną częścią tego. Biorąc pod uwagę jego znaczenie, Walidacja wydaje się być postrzegana jako myląca i trudna do prawidłowego wykonania. Oczywiście można to zrobić dobrze, a CSols ma na to dowód. W ciągu prawie 30 lat tworzenia CSV nie słyszeliśmy o żadnym z naszych klientów otrzymującym formularz FDA 483.
Walidacja jest częścią cyklu życia oprogramowania. Na tym blogu sprawdzimy, co to oznacza i jak to zrobić, aby Twój system był odporny na audyt regulacyjny.
podstawy walidacji systemów komputerowych
Żadna dyskusja na temat walidacji systemów komputerowych nie jest kompletna bez przeglądu otaczających ją przepisów. W Stanach Zjednoczonych Food and Drug Administration (FDA) reguluje określone branże, które bezpośrednio wpływają na zdrowie konsumentów, w tym farmaceutyki, kosmetyki oraz żywność i napoje. Branże te ponoszą dodatkową odpowiedzialność za zapewnienie bezpieczeństwa swoich produktów i danych. Odpowiednie przepisy dotyczące aspektów walidacji systemów komputerowych w Stanach Zjednoczonych pochodzą z kodeksu przepisów federalnych (CFR), w szczególności 21 CFR część 11 (Część 11), zajmującego się zapisami elektronicznymi i podpisami. Podobne agencje rządowe i przepisy obowiązują również w innych krajach.
Część 11 nakazuje, aby wymogi dotyczące elektronicznych zapisów i podpisów były uważane za dokładne, wiarygodne, łatwo dostępne i bezpieczne, aby legalnie zastąpić papierowe zapisy i odręczne podpisy. Walidacja systemu komputerowego jest podstawowym sposobem ustalenia, że zapisy elektroniczne i podpisy mogą być wykorzystywane w ten sposób.
Proces walidacji
Walidacja może przybrać wiele kształtów w trakcie cyklu życia systemu komputerowego, w zależności od tego, czy jest to nowa implementacja, czy aktualizacja do istniejącego systemu. W przypadku nowych systemów, które użytkownik ma nadzieję rozwiązać obecny problem, Walidacja odbywa się od podstaw. W przypadku istniejącego systemu, który wymaga aktualizacji lub rozszerza zakres zamierzonego zastosowania, konieczne jest utrzymanie systemu w stanie zatwierdzonym poprzez testowanie nowych możliwości przed wprowadzeniem ich do użytku produkcyjnego. Proces walidacji kończy się, gdy system zostanie wycofany, a jego dane zostaną pomyślnie przeniesione do nowego systemu lub zarchiwizowane. Poniższy rysunek pokazuje, w jaki sposób Walidacja wspiera cykl życia projektu.

plan główny walidacji
plan główny walidacji prowadzi użytkownika przez proces walidacji i staje się rodzajem listy sprawdzającej, aby upewnić się, że wszystko dzieje się tak, jak powinno. Po dokonaniu oceny stanu obecnego systemu główny plan walidacji obejmuje wszystkie inne kroki, które podejmiesz, aby upewnić się, że system jest walidowany w aktualnym stanie i nadaje się do zamierzonego zastosowania.

główny plan walidacji powinien uwzględniać zbieranie wymagań, ocenę ryzyka funkcjonalnego, matrycę śladową, protokoły IQ OQ PQ i testy oraz procedury kontroli zmian z okresowymi przeglądami. Każda część głównego planu walidacji jest wykonywana w określonej kolejności. Twoje wymagania powinny być kompletne i ocena ryzyka zrobić przed przejściem do opracowania matrycy śladowej, a następnie robi badania. W ten sposób zminimalizujesz ryzyko konieczności powrotu i opracowania nowych przypadków testowych na późnym etapie procesu.
związek między zbieraniem wymagań a testowaniem kwalifikacji
ważne jest, aby upewnić się, że wymagania i specyfikacje są dobrze zdefiniowane i zatwierdzone przed zatwierdzeniem systemu komputerowego. V-model walidacji jest powszechnie używany do wizualizacji zależności między wymaganiami i specyfikacjami oraz przeprowadzonych na nich testów (Patrz diagram poniżej). Testy kwalifikacyjne (po prawej stronie V) są zaprojektowane w oparciu o zamierzone zastosowanie i funkcjonalność wymaganą do spełnienia tego zastosowania (reprezentowane po lewej stronie V).
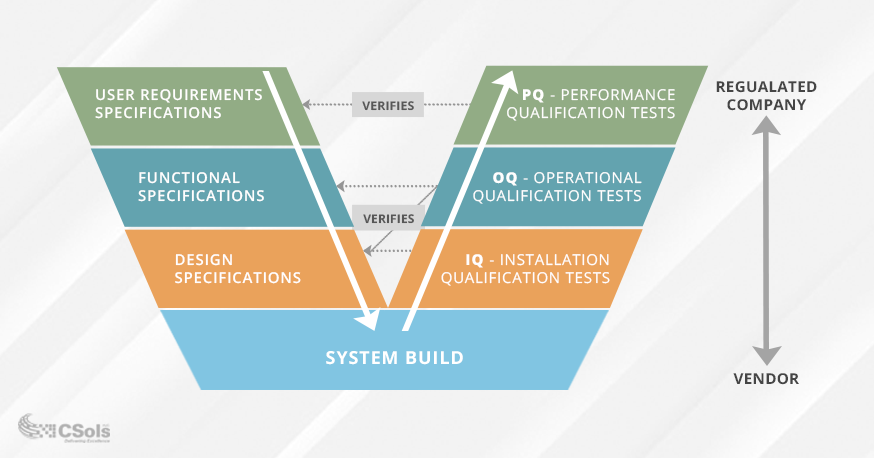
- Specyfikacja wymagań użytkownika dokumentuje, co użytkownicy potrzebują systemu do zrobienia, a PQ testing weryfikuje te wymagania.
- Specyfikacja wymagań funkcjonalnych dokumentuje funkcjonalność systemu wymaganą do spełnienia specyfikacji wymagań użytkownika, a testowanie OQ weryfikuje te specyfikacje.
- specyfikacje projektowe dokumentują projekt systemu (np. Moduły, jednostki itp.IQ testing sprawdza, czy instalacja systemu spełnia te wymagania projektowe.
testowanie IQ/OQ/PQ jest prawdopodobnie istotną częścią procesu walidacji. Pomyślne zakończenie testów sprawdzi, czy Twój system działa zgodnie z przeznaczeniem i jest odpowiedni do zamierzonego zastosowania w Twoim środowisku. Najlepszą praktyką jest zatwierdzanie wymagań użytkownika i specyfikacji funkcjonalnych przed testowaniem, aby uniknąć pełzania zakresu i ewentualnego ponownego testowania.
aby dowiedzieć się więcej o testach IQ OQ PQ, obejrzyj nasze webinarium.
osoby piszące i wykonujące twoje testy IQ/OQ/PQ powinny być dokładnie zaznajomione z Twoim laboratoryjnym systemem informatycznym (LIMS, ELN, CDS) i twoim przeznaczeniem. Jeśli twój wewnętrzny personel nie ma odpowiedniej przepustowości ani doświadczenia w odpowiednich testach, powinieneś współpracować z wykwalifikowanymi konsultantami CSV, takimi jak CSols, którzy mają wymagane doświadczenie w zakresie systemów informatycznych.
Alcoa+ i integralność danych
znaczenie danych z informatyki laboratoryjnej nie może być zaniżone. Gdy posiadasz dane w zweryfikowanym środowisku, musisz upewnić się, że Twoje dane pozostają bezpieczne i niezawodne. Akronim ALCOA określa pięć podstawowych zasad integralności danych: Dane muszą być przypisane, czytelne, równoczesne, Oryginalne i dokładne. Ostatnio dodano cztery dodatkowe zasady, dzięki czemu akronim jest teraz ALCOA+. Cztery dodatki są kompletne, spójne, trwałe i dostępne.

integralność danych jest integralną częścią wszystkich działań walidacyjnych. Przestrzeganie zasad ALCOA+ gwarantuje, że Twój system przechwytuje, produkuje, raportuje, przesyła i przechowuje dane, które są bezpieczne, dostępne do pobrania i niezawodne.
przyszłość CSV: Computer System Assurance
chociaż wciąż czekamy na FDA, aby opublikować swoje oczekiwane wytyczne dotyczące computer system assurance(CSA), nadchodzi. W swej istocie CSA wzmacnia podejście oparte na ryzyku, które rozszerza Zasady GAMP 5 dotyczące rozumienia produktów i procesów, zarządzania ryzykiem jakości i wykorzystywania działań dostawców. Ryzyko jest oceniane w oparciu o całościowy obraz całego procesu biznesowego. W ten sposób kładzie się większy nacisk na skuteczność testów, koncentrując się na testach, które zapewniają, że system jest odpowiedni do celu.
wyzwania związane z walidacją systemów komputerowych
Walidacja systemów komputerowych może wiązać się z wyzwaniami, w tym ryzykiem awarii systemu, restrykcyjnymi politykami firmy i coraz bardziej rygorystycznymi wymogami prawnymi. Innym istotnym problemem jest sytuacja, w której użytkownicy muszą zrównoważyć równanie ryzyka i kosztów po zdefiniowaniu kategorii ryzyka. Podejście oparte na Ryzyku do CSV może pomóc złagodzić niektóre z tych wyzwań.
dodatkowe kroki, które możesz podjąć, aby uniknąć problemów z walidacją, obejmują następujące czynności:
- zapewnienie kompletności planu głównego walidacji oraz przestrzeganie najlepszych praktyk i przepisów branżowych
- Definiowanie systemu komputerowego (tj. sprzętu, oprogramowania, ludzi i procesów), który ma zostać zatwierdzony
- zapewnienie jasnych limitów oczekiwanych wyników; tj., co jest dopuszczalne
- opisanie i spełnienie szczegółowych wymagań i specyfikacji dotyczących zamierzonego użytkowania oprogramowania
prawidłowe wykonanie walidacji systemu komputerowego jest zaangażowanym procesem, ale możesz to zrobić, gdy masz odpowiednią wiedzę. Jeśli nie masz pewności, że twój personel ma niezbędne doświadczenie w CSV, skontaktuj się z nami.