Cytrynianowe leczenie przeciwzakrzepowe w ostrym uszkodzeniu nerek
- ostre uszkodzenie nerek
- leczenie Aki – terapii nerkozastępczej dla AKI
- hemodializa, hemofiltracja i hemodiafiltracja
- rozpoczęcie i czas RRT dla Aki – przerywany w porównaniu z ciągłym RRT
- leczenie przeciwzakrzepowe podczas ciągłej terapii nerkozastępczej (CRRT)
- cytrynian-mechanizm jego działania przeciwzakrzepowego i jego zastosowanie w CRRT
- potencjalne zaburzenia metaboliczne podczas CYTRYNIANOWO-przeciwzakrzepowego CRRT
- monitorowanie biochemiczne pacjentów otrzymujących cytrynianowe leki przeciwzakrzepowe
ostre uszkodzenie nerek
ostre uszkodzenie nerek (Aki), zespół kliniczny z wieloma możliwymi przyczynami, jest po prostu definiowany jako nagłe zmniejszenie czynności nerek w ciągu kilku godzin lub dni, potwierdzone niedawnym zwiększeniem stężenia kreatyniny w surowicy i (lub) zmniejszeniem wydalania moczu .
różni się od przewlekłej choroby nerek (CKD), w której spadek czynności nerek postępuje powoli, ale nieodwracalnie, występując w okresie miesięcy i lat. AKI może oczywiście wystąpić u osób z CKD, a diagnoza AKI wiąże się z większym niż normalnie ryzykiem ewentualnej diagnozy CKD .
uzgodnione na szczeblu międzynarodowym wytyczne stwierdzają, że rozpoznanie AKI można postawić, jeśli:
• stężenie kreatyniny w surowicy zwiększy się o ≥ 0, 3 mg/dL (26, 5 µmol/l) w ciągu 48 godzin; lub
• w ciągu ostatnich 7 dni wystąpiło 50% lub większe zwiększenie stężenia kreatyniny w surowicy; lub
• objętość moczu wynosi
AKI obejmuje pełne spektrum nasilenia od łagodnego pogorszenia czynności nerek (Etap 1 AKI). do niewydolności nerek (etap 3 Aki). Stopień zaawansowania zależy od pomiaru stężenia kreatyniny w surowicy, z danymi wyjściowymi moczu lub bez (Tabela I)
|
etap |
stężenie kreatyniny w surowicy |
wydalanie moczu |
|
1 |
1.5-1.9 krotność początkowego wzrostu |
przez 6-12 godzin |
|
2 |
2.0-2.9 razy wartość wyjściowa |
⩾ 12 godziny |
|
3 |
3.0 |
przez ⩾ 24 godziny |
tabela I: trzy etapy nasilenia AKI (od ref. 1)
przyczyny AKI są konwencjonalnie klasyfikowane w trzech pozycjach: prerenal; nerkowy (wewnętrzny); i pourazowe, podkreślając fakt, że AKI może mieć specyficzną etiologię nerek, ale może również wynikać z pierwotnego problemu poza nerką.
każdy stan, który ma wpływ na zmniejszenie przepływu krwi do nerek (perfuzja nerek) jest potencjalną przyczyną prerenal AKI; warunki te obejmują: hipowolemię z powodu wymiotów, biegunki, krwotoku, oparzeń lub wstrząsu septycznego; i zmniejszenie pojemności minutowej serca z powodu, na przykład, niewydolności serca i niewydolności wątroby (marskość wątroby). Główną przyczyną wewnętrznego AKI jest martwica kanalików nerkowych, wynikająca z niedokrwienia nerek lub spożycia leków/toksyn nefrotoksycznych.
sepsa, najczęstsza przyczyna AKI u chorych w stanie krytycznym, wynika częściowo ze słabo zdefiniowanego wewnętrznego uszkodzenia nerek, podobnego do martwicy kanalików nerkowych . Wreszcie, postrenal Aki wynika z każdego stanu, który utrudnia przepływ moczu dystalnie do nerek; należą do nich: kamienie nerkowe( kamienie); choroba prostaty (guz / przerost); dysfunkcja pęcherza moczowego; i zwężenie cewki moczowej.
leczenie Aki – terapii nerkozastępczej dla AKI
nie ma specyficznego leczenia AKI i postępowanie jest w dużej mierze wspierające leczenie skierowane na przyczynę. Wycofanie leków nefrotoksycznych, resuscytacja płynów i korekta zaburzeń elektrolitów i kwasów zasadowych są częścią tego ogólnego postępowania wspomagającego . Może być konieczne podawanie leków wazopresorowych lub inotropowych w celu przywrócenia prawidłowego ciśnienia krwi i pojemności minutowej serca.
nerkowa terapia zastępcza (ang. Renal replacement therapy, RRT), w centrum zainteresowania tego artykułu, stanowi ostateczną metodę leczenia pacjentów z ciężkim AKI, który nie reaguje na zachowawcze leczenie podtrzymujące. Około 23% pacjentów OIOM z AKI (tj. około 13% wszystkich pacjentów OIOM) otrzymuje RRT .
nerkowa terapia zastępcza (RRT) jest ogólnym terminem dla wszystkich zabiegów mających na celu zastąpienie funkcji nerek. Przeszczepienie nerki dawcy osobom ze schyłkową niewydolnością nerek można uznać za ostateczny RRT, ale termin ten jest częściej zarezerwowany dla tych terapii, które zastępują filtrowanie krwi i homeostatyczne funkcje nerek przez dializę, proces, który wykorzystuje półprzepuszczalną membranę jako filtr krwi. Do leczenia AKI (i w końcowym stadium CKD) dostępne są dwa szerokie rodzaje dialytic RRT: dializa otrzewnowa i hemodializa.
natomiast hemodializa polega na filtrowaniu krwi w maszynie poza ciałem (pozaustrojowym). Krew jest pompowana do filtra / dializatora, gdzie produkty odpadowe i nadmiar płynu są usuwane, a następnie wraca do organizmu. Ten pozaustrojowy Obwód (urządzenie do dializy i jego rurki łączące z pacjentem i z powrotem) jest środowiskiem prokoagulacyjnym.
hemodializa, hemofiltracja i hemodiafiltracja
nowoczesne urządzenia do dializy mają opcję hemofiltracji (HF), a także hemodializy (HD), umożliwiając trzy różne tryby leczenia Aki: hemodializa (HD), hemofiltracja (HF) i hemodiafiltracja (HDF).
rdzeniem wszystkich trzech trybów jest półprzepuszczalna membrana, która stanowi filtr krwi. Ponieważ krew wypompowana z pacjenta przepływa po jednej stronie tej błony, nadmiar wody i odpadowe substancje rozpuszczone przechodzą przez membranę. Filtrat lub ścieki są pompowane do odpadów, gdy przefiltrowana krew jest zwracana pacjentowi.
proces hemodializy (HD) polega na użyciu płynu do dializy, który płynie w sposób ciągły i przeciwobrzękowy do krwi po drugiej stronie błony. Skład i szybkość przepływu płynu dializacyjnego zapewnia stały gradient stężenia w błonie półprzepuszczalnej w odniesieniu do substancji rozpuszczonych we krwi. Te gradienty stężenia z kolei ułatwiają kontrolowaną dyfuzję rozpuszczonych cząsteczek przez membranę.
w przypadku substancji rozpuszczonych, takich jak mocznik i kreatynina, które muszą być usunięte z krwi, gradient stężenia jest taki, że kierunek dyfuzji jest od krwi do płynu do dializy, podczas gdy w przypadku substancji rozpuszczonych, takich jak wodorowęglan, które często muszą być dodawane do krwi w celu skorygowania kwasicy związanej z ciężkim AKI, płyn do dializy o wysokim stężeniu wodorowęglanu w stosunku do krwi zapewnia dyfuzję w przeciwnym kierunku, od płynu do dializy do krwi. Dostosowanie składu płynu do dializy i natężenia przepływu umożliwia w ten sposób specyficzną dla pacjenta korektę metaboliczną.
nadmiar płynów jest często cechą AKI, która jest korygowana podczas hemodializy. Osiąga się to poprzez ultrafiltrację, która zależy od gradientu ciśnienia hydrostatycznego występującego w całej membranie półprzepuszczalnej. Względne dodatnie ciśnienie hydrostatyczne po stronie krwi membrany skutecznie “wypycha” wodę z krwi do płynu dializacyjnego.
ta ultrafiltracja ułatwia również przejście rozpuszczonych cząsteczek, które są przeciągane wraz z wodą podczas ultrafiltracji za pomocą mechanizmu zwanego konwekcją rozpuszczoną (lub przeciąganiem rozpuszczalnika). Połączony efekt rozpuszczonej dyfuzji, rozpuszczonej konwekcji i ultrafiltracji podczas hemodializy ma na celu zapewnienie, że objętość i skład płynu w komorze zewnątrzkomórkowej i wewnątrzkomórkowej zostanie przywrócony, tak blisko, jak to możliwe, do tego, co dotyczy osób z normalnie funkcjonującymi nerkami.
Hemodiafiltracja (HDF)to połączenie HF i HD. Umożliwia optymalny klirens substancji rozpuszczonych o niskiej masie cząsteczkowej przez dyfuzję do płynu dializacyjnego, w połączeniu z optymalnym klirensem substancji rozpuszczonych o dużej masie cząsteczkowej przez konwekcję i ultrafiltrację. Podobnie jak w przypadku HF, HDF wymaga ciągłego płynu zastępczego; podobnie jak w przypadku HD, HDF wymaga płynu do dializy.
rozpoczęcie i czas RRT dla Aki – przerywany w porównaniu z ciągłym RRT
wszystkie terapie nerkozastępcze (PD, HD, HF i HDF) mogą być wykonywane sporadycznie (tj. zazwyczaj w 3-4 godzinnych sesjach) lub w sposób ciągły do czasu przywrócenia czynności nerek. U pacjentów ze schyłkową niewydolnością nerek, którzy wymagają całe życie (przewlekłe) RRT, leczenie jest wyłącznie przerywana hemodializa (IHD), prawie zawsze dostarczane w czterech godzinnych sesjach, trzy razy w tygodniu .
pacjenci z AKI mają tylko tymczasowe zapotrzebowanie na RRT do wspomagania czynności nerek podczas ustąpienia krytycznej / ostrej choroby, która wytrąca AKI. Średni czas trwania RRT u pacjentów z AKI wynosi około 13 dni, chociaż w szczególnych przypadkach może to być konieczne tylko przez kilka dni lub przedłużyć się o wiele tygodni.
tradycyjne (bezwzględne) wskaźniki do rozpoczęcia RRT w AKI obejmują:
• hiperkaliemię (stężenie potasu w osoczu > 6, 0-6, 5 mmol/l)
• ciężką mocznicę (stężenie mocznika w osoczu > 30 mmol/L)
• objawy encefalopatii mocznicowej
• kwasicę (pH • ostry obrzęk płuc
może być korzystne rozpoczęcie leczenia, zanim te ekstremalne efekty AKI będą widoczne, ale optymalny czas inicjowania (i zatrzymywania) RRT jest obecnie niejasny i przedmiotem trwających badań . Obecnie nie ma wiarygodnych danych na poparcie konkretnego typu RRT dla AKI i w związku z tym zastosowano wszystkie typy RRT.
obecne wytyczne odzwierciedlają jednak konsensus, że niezależnie od modalności RRT powinien być dostarczany w sposób ciągły, a nie sporadyczny do najbardziej krytycznie chorych (hemodynamicznie niestabilnych) pacjentów. Ostatnie badania wskazują, że obecnie ciągłe terapie nerkozastępcze (CRRT) są stosowane znacznie częściej niż przerywane terapie dla AKI, i że najczęściej stosowanym CRRT jest ciągła hemofiltracja żylna (CVVHF), a następnie ciągła hemodiafiltracja żylna (CVVHDF).
leczenie przeciwzakrzepowe podczas ciągłej terapii nerkozastępczej (CRRT)
CRRT, podobnie jak wszystkie inne terapie nerkozastępcze z wyjątkiem dializy otrzewnowej, polega na pompowaniu krwi przez niefizjologiczny, pozaustrojowy Obwód. Wrodzona właściwość krwi do koagulacji (skrzepu) w kontakcie z powierzchniami niefizjologicznymi określa, że w celu utrzymania “wolnego od skrzepu” obwodu pozaustrojowego pacjenta, krew musi być przeciwzakrzepowa.
CRRT ma szczególne zapotrzebowanie na leki przeciwzakrzepowe, w porównaniu z przerywanymi metodami, ze względu na długotrwałe sesje leczenia i stosunkowo powolną szybkość pompowania krwi przez obwód . Ponadto krew pacjentów, którzy wymagają CRRT, jest często już we względnym stanie prokoagulacyjnym z powodu podstawowej choroby krytycznej (np. sepsy) lub urazu .
przez wiele lat heparyna, heparyna niefrakcjonowana (UF) lub heparyna niskocząsteczkowa (LMWH), była jedynym lekiem przeciwzakrzepowym stosowanym w zabiegach dialitycznych, w tym CRRT. Heparyna jest nadal stosowana; jest to tani i ogólnie bezpieczny środek przeciwzakrzepowy dla większości pacjentów wymagających RRT.
jednak ogólnoustrojowe leczenie przeciwzakrzepowe heparyną, którego nie można uniknąć, nieuchronnie wiąże się ze zwiększonym ryzykiem krwawienia, tak że leczenie przeciwzakrzepowe heparyną podczas zabiegów dialitycznych jest bezwzględnie przeciwwskazane u osób, u których obecnie występuje krwawienie lub ryzyko krwawienia jest wyższe niż zwykle.
ponadto heparyna może, w niewielkiej mniejszości (
potencjalne ryzyko krwawienia i HIT-II związane ze stosowaniem heparyny uwypukliło potrzebę alternatywnego leku przeciwzakrzepowego u niektórych pacjentów wymagających RRT. Cytrynian stanowił taką alternatywę. Regionalna antykoagulacja cytrynianu w obwodzie dializy, po raz pierwszy z powodzeniem zastosowana na początku lat 80., była pierwotnie zarezerwowana dla niewielkiej mniejszości pacjentów, u których heparyna jest przeciwwskazana. Zmieniło się to wraz z wynikami randomizowanych kontrolowanych badań porównujących heparynę z ANTYKOAGULOWANYM CRRT z cytrynianem-antykoagulowanym CRRT; wykazały one, że cytrynian jest zarówno skuteczniejszym, jak i bezpieczniejszym antykoagulantem niż heparyna .
cytrynian pojawił się w ostatnich latach jako antykoagulant z wyboru dla wszystkich pacjentów AKI wymagających CRRT . Oddziały intensywnej opieki medycznej na całym świecie zgłaszają teraz zmianę z heparyny na regionalne antykoagulacje cytrynianowe dla CRRT . Niektóre władze zalecają nawet stosowanie cytrynianu zamiast heparyny w leczeniu przerywanej (przewlekłej) hemodializy (IHD).
cytrynian-mechanizm jego działania przeciwzakrzepowego i jego zastosowanie w CRRT
cytrynian, który był stosowany do przeciwzakrzepowego/zachowania krwi oddanej do transfuzji przez ponad wiek, zapobiega krzepnięciu krwi poprzez zdolność wiązania (chelatowania) zjonizowanego wapnia (iCa), który krąży w osoczu krwi. Ten iCa jest niezbędnym kofaktorem zarówno dla agregacji płytek krwi, jak i kilku kluczowych etapów wewnętrznego i zewnętrznego szlaku krzepnięcia, które są odpowiedzialne za wytwarzanie fibryny, a tym samym tworzenie skrzepu fibryny.
krzepnięciu krwi zapobiega się poprzez zmniejszenie stężenia iCa w osoczu do około 0, 35 mmol/l (prawidłowy zakres ref 1, 15-1, 30 mmol/l). Ten niefizjologiczny, poważnie hipokalcemiczny stan osiąga się przez zwiększenie stężenia cytrynianu w osoczu do około 3 mmol/l (normalne stężenie cytrynianu w osoczu ~0,1 mmol/l ).
chociaż istnieją różnice w szczegółach przedstawione przez Morabito i wsp., wszystkie protokoły antykoagulacji cytrynianu podczas CRRT obejmują ciągłą infuzję roztworu zawierającego cytrynian (Zwykle cytrynian trisodu lub roztwór cytrynianu kwasu-dekstrozy (ACD)) do filtra wstępnego / linii dializacyjnej, w pobliżu miejsca, w którym opuszcza pacjenta, jako oddzielny roztwór lub w połączeniu z płynem zastępczym predylution. Szybkość przepływu tego wlewu jest dostosowywana tak, aby osiągnąć stężenie cytrynianu we krwi ~3 mmol/l, a tym samym iCa w osoczu około 0,35 mmol/l.
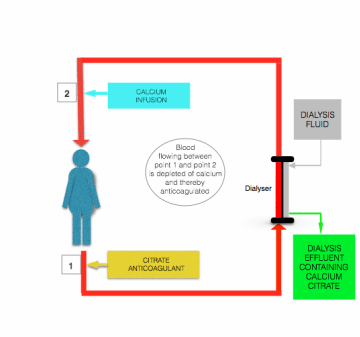
hipokalcemia wywołana infuzją cytrynianu jest korygowana przed powrotem krwi do pacjenta, przez infuzję roztworu zawierającego wapń (chlorek wapnia lub glukonian wapnia) do linii postfiltru w pobliżu miejsca, w którym dostaje się ona do pacjenta (patrz rysunek powyżej).
główną zaletą antykoagulacji cytrynianem w porównaniu z antykoagulacją heparyną jest to, że antykoagulacja ogranicza się do obwodu pozaustrojowego. Ta tak zwana “regionalna antykoagulacja” jest osiągana, ponieważ większość cytrynianu podawanego we wlewie jest usuwana (w postaci anionów cytrynianu lub chelatu cytrynianu wapnia) z krwi podczas przejścia przez filtr/dializator .
każdy pozostały cytrynian we krwi postfiltrowej jest rozcieńczany w krążeniu ogólnoustrojowym i szybko metabolizowany do dwutlenku węgla i wody w zależnym od tlenu cyklu Krebsa w mitochondrionie komórek tkankowych (głównie komórek wątroby ).
metabolizm cytrynianu jest związany z produkcją wodorowęglanów: dla każdego metabolizowanego 1 mmol cytrynianu powstaje 3 mmol wodorowęglanu. Szybki klirens cytrynianu (okres półtrwania cytrynianu we krwi wynosi zwykle około 5 minut), głównie w wątrobie, zwykle zapewnia brak ogólnoustrojowego działania przeciwzakrzepowego podczas CRRT, a tym samym brak dodatkowego ryzyka krwawienia.
potencjalne zaburzenia metaboliczne podczas CYTRYNIANOWO-przeciwzakrzepowego CRRT
pozorna niechęć do pełnego przyjęcia cytrynianowo-przeciwzakrzepowego CRRT u wszystkich pacjentów z AKI do niedawna była przypisywana obawom dotyczącym zaburzeń kwasowo-zasadowych i elektrolitowych, które mogą wystąpić u pacjentów otrzymujących leczenie .
u pacjentów otrzymujących cytrynianowo-przeciwzakrzepowe CRRT zgłaszano następujące zaburzenia elektrolitowe i kwasowo-zasadowe :
• hipokalcemia/hiperkalcemia
• hipomagnezja/hipermagnezja
• hiponatremia/hipernatremia
• zasadowica metaboliczna
• kwasica metaboliczna
zaburzenia te mogą wystąpić z wielu powodów, ale kumulacja cytrynianu w krążeniu obwodowym (toksyczność cytrynianu) może mieć kluczowe znaczenie dla większości tych zaburzeń. Powody, dla których cytrynian może gromadzić się podczas CRRT, obejmują:
• zaburzenia metabolizmu cytrynianu z powodu choroby wątroby i/lub zmniejszone dostarczanie tlenu z powodu nieodpowiedniej perfuzji (np.
• postępujące zmniejszenie drożności błony podczas dializy, co powoduje zmniejszoną filtrację cytrynianu i jednoczesne zwiększenie dostarczania cytrynianu do krążenia ogólnoustrojowego
• błąd operacyjny – przypadkowe zwiększenie szybkości infuzji cytrynianu do układu pozaustrojowego i jednoczesne zwiększenie dostarczania cytrynianu do krążenia ogólnoustrojowego
• transfuzja produktów krwiopochodnych – środek konserwujący cytrynian obecny w produktach krwiopochodnych zwiększa obciążenie cytrynianem w krążeniu ogólnoustrojowym wynikające z CRRT
bez względu na przyczynę, akumulacja cytrynianu w krążeniu obwodowym może skutkować chelatacją cytrynianu krążącego zjonizowanego wapnia, co powoduje zmniejszenie stężenia zjonizowanego wapnia w osoczu (hipokalcemia). Jeśli wystarczająco ciężka hipokalcemia może powodować arytmię serca i, ostatecznie, zatrzymanie akcji serca .
chociaż wapń zjonizowany w osoczu zmniejsza się podczas gromadzenia cytrynianu (toksyczność), całkowity wapń zwiększa się (co wskazuje na hiperkalcemię), ponieważ wapń związany z cytrynianem jest zawarty w mierzonym całkowitym wapniu. Zwiększenie stosunku całkowitego do zjonizowanego wapnia (zwykle 2,0) do > 2.Stwierdzono, że 1 jest najbardziej wiarygodnym sygnałem toksyczności cytrynianu przy braku rutynowo dostępnego oszacowania cytrynianu w osoczu .
ryzyko zwiększenia stężenia sodu w osoczu (hipernatremia) związanego z antykoagulacją cytrynianu wynika z wysokiej zawartości sodu (hipertoniczność) w niektórych roztworach cytrynianu stosowanych w CRRT. Na przykład 4% roztwór cytrynianu trisodu, który jest stosowany w niektórych protokołach, zawiera sód w stężeniu 420 mmol / L. w praktyce stosowanie dializy hipotonicznej / płynów zastępczych może zmniejszyć to ryzyko, a hipernatremia jest rzadkim powikłaniem antykoagulacji cytrynianu .
ryzyko hipomagnezji (zmniejszenie stężenia magnezu w surowicy) podczas antykoagulacji cytrynianu odzwierciedla fakt, że podobnie jak wapń, magnez jest dwuwartościowym Jonem, który może również wiązać się z (chelatem) cytrynianem. Jeśli straty magnezu w wyniku chelatacji cytrynianu nie są w pełni kompensowane przez magnez w dializach/płynach zastępczych, może wystąpić hipomagneza .
monitorowanie biochemiczne pacjentów otrzymujących cytrynianowe leki przeciwzakrzepowe
badanie punktowe przy użyciu analizatora gazów krwi umieszczonego w oddziale intensywnej terapii umożliwia szybki i wygodny pomiar większości parametrów (zjonizowanego wapnia, pH, wodorowęglanu, nadmiaru Zasady, sodu i mleczanu), ale całkowite oszacowanie wapnia i magnezu w surowicy zwykle nie jest dostępne na tych platformach i próbki muszą być wysłane do laboratorium w celu przeprowadzenia tych pomiarów.
dwa ostatnie badania dostarczają dowodów na to, że niektóre Analizatory gazów krwi mogą nie być wiarygodne w pomiarze zjonizowanego wapnia w skrajnie niskich, niefizjologicznych stężeniach (~0.3 mmol/l) obecne w krwi postfiltrowej, choć ich zdolność do dokładnego pomiaru zjonizowanego wapnia w osoczu w krążeniu ogólnoustrojowym (gdzie stężenie jest znacznie wyższe) nie budzi wątpliwości.
|
parametr zmierzony |
interwał monitorowania |
wartości docelowe lub OK. zakresy odniesienia |
cel pomiaru |
działania naprawcze, jeśli poza celem |
|
stężenie Jonizowanego wapnia Postfiltru (Ica), tj. krew pobrana z portu postfiltru. |
w ciągu 1 godziny od rozpoczęcia i po zmianie dawki cytrynianu, a następnie co 4-6 godzin |
0.25-0.35 mmol/l |
|
dostosowanie dawki cytrynianu: zwiększenie w przypadku iCa > 0, 35, zmniejszenie w przypadku iCa |
|
ogólnoustrojowe zjonizowane wapń (iCa), tj. pobranie krwi od pacjenta |
początkowe (przed rozpoczęciem), następnie 1 godzinę po rozpoczęciu, a następnie co najmniej co 4-6 godzin |
1.15-1.30 mmol/l |
|
dostosowanie szybkości wlewu wapnia; zwiększenie w przypadku 1.30 |
|
ogólnoustrojowy całkowity wapń (TotCa), tj. pobrano krew od pacjenta (TotCa = Ica + wapń związany z albuminą + wapń związany z cytrynianem) |
co najmniej co 12-24 godziny (musi być równoczesne z ogólnoustrojowym oszacowaniem jonizowanego wapnia) |
wymagane tylko do określenia stosunek totCa:iCa (patrz poniżej) |
||
|
stosunek całkowitego do zjonizowanego wapnia (TotCa:iCa) |
co najmniej co 12-24 godziny |
wykrywanie akumulacji/toksyczności cytrynianu czasami nazywane “blokadą cytrynianu” |
opcje obejmują:
|
|
|
Analiza gazowa krwi tętniczej
|
wartość początkowa (przed rozpoczęciem) . w ciągu 1 godziny od rozpoczęcia, a następnie co najmniej co 4-6 godzin. |
pH 7,35-7,45 23-28 mmol / L BE–2-+3 mmol / L |
wykrywanie zaburzeń kwasowo-zasadowych: zasadowość metaboliczna kwasica metaboliczna |
opcje w przypadku zasadowicy metabolicznej obejmują:
|
|
sód w surowicy |
raz na dobę |
135-145 mmol / L |
w celu wykrycia hipernatremii/hiponatremii |
rzadkie występowanie-zweryfikuj prawidłową dializę/płyn zastępczy |
|
mleczan w surowicy |
należy rozważyć, wraz ze współczynnikiem TotCa:iCa, ryzyko toksyczności cytrynianu |
|||
|
magnez w surowicy |
co najmniej raz na dobę |
aby wykryć hipomagnezję |
Korekcja za pomocą wlewu magnezu |
tabela II: monitorowanie biochemiczne podczas CYTRYNIANOWO-przeciwzakrzepowych CRRT (Ref 24)