Frontiers in Endocrinology
- wprowadzenie
- materiały i metody
- projekt badania i charakterystyka uczestników
- interwencja
- ocena wyników
- Izolacja komórek limfocytów
- ekstrakcja RNA i PCR w czasie rzeczywistym (RT-PCR)
- wielkość próby i Metody statystyczne
- wyniki
- dyskusja
- wpływ chromu na ekspresję genów insuliny i metabolizm lipidów
- wpływ chromu na ekspresję genu markerów zapalnych
- wkład autora
- finansowanie
- Oświadczenie o konflikcie interesów
wprowadzenie
zespół policystycznych jajników (PCOS), główna przyczyna braku owulacji i niepłodności wśród kobiet w wieku rozrodczym, jest najczęstszym zaburzeniem endokrynologicznym wpływającym na 5-10% kobiet na świecie (1). Przyspieszona lipoliza i późniejsza dyslipidemia u kobiet z PCOS jest związana z zaburzeniami metabolicznymi, w tym otyłością, insulinoopornością i cukrzycą typu 2 (T2DM) (2). Odzwierciedlone zmiany w płynie pęcherzykowym (FF) dominującego pęcherzyka (3, 4) mogą bezpośrednio wpływać na jakość i metabolizm oocytów. Przewlekłe zapalenie o niskim stopniu nasilenia jest powszechnie obwiniane za etiopatogenetyczny mechanizm niepłodności. Cytokiny zapalne są znacznie wyższe u kobiet z niewyjaśnioną niepłodnością (5). Wykazano, że czynniki prozapalne są istotnie związane z wyższym wskaźnikiem niepowodzenia zapłodnienia in vitro (IVF), zwłaszcza w fazie implantacji, u kobiet z niewyjaśnioną niepłodnością (6). Badania wykazały podwyższony poziom interferonu gamma (IFN-γ) i interleukiny-2 (IL-2) oraz obniżony poziom transformującego czynnika wzrostu beta (TGF-β), ważnego endogennego mediatora przeciwzapalnego, (7) w osoczu kobiet z niewyjaśnioną niepłodnością, w porównaniu z kontrolą płodności w okresie implantacji (faza lutealna) (8). Ponadto u niepłodnych pacjentów o niewyjaśnionej przyczynie stwierdzono podwyższone stężenie IL-2, IL-4, IL-6, IL-21, czynnika martwicy nowotworu alfa (TNF-α) i IFN-γ w surowicy w porównaniu z płodnymi kobietami (5).
korzystne działanie suplementów chromu zostało już zgłoszone na zaburzenia metaboliczne u kobiet cierpiących na PCOS. W metaanalizie przeprowadzonej przez Fazelian et al. (9), suplementacja chromem zmniejszyła insulinę w surowicy i wolny testosteron oraz poprawiła masę ciała u pacjentów z PCOS. Opublikowaliśmy już zalety przyjmowania suplementów chromu przez 8 tygodni w zakresie kontroli glikemii, parametrów ryzyka kardiometabolicznego i stresu oksydacyjnego u niepłodnych kobiet z PCOS, które były kandydatami do IVF (10). Ponadto suplementacja chromu u szczurów z cukrzycą wykazała działanie przeciwcukrzycowe, które można wyjaśnić poprzez wpływ chromu na modulację receptora gamma aktywowanego proliferatorem peroksysomów (PPAR-γ), substratu receptora insuliny 1 (IRS-1) i białka czynnika jądrowego kB (NF-kB) (11). Podobnie, Wang et al. (12) stwierdzono, że w porównaniu z otyłymi szczurami kontrolnymi, u tych, którym podawano chrom, stwierdzono znaczną poprawę tempa usuwania glukozy oraz zwiększenie aktywności kinazy P-IRS-1 stymulowanej insuliną i kinazy fosfatydyloinozytolu-3 w mięśniach szkieletowych. W innym eksperymencie na zwierzętach, spożycie chromu przez 7 tygodni przez szczury z cukrzycą, znacznie zmniejszyło markery zapalne, w tym białko C-reaktywne (CRP), TNF-α i IL-6 (13).
biorąc pod uwagę działanie antycukrzycowe i obniżające stężenie lipidów chromu (11, 14), postawiliśmy hipotezę, że suplementacja chromu może być korzystna u kobiet z PCOS i kandydatów do IVF, którzy cierpią na różne zaburzenia metaboliczne. Zgodnie z naszą najlepszą wiedzą, nic nie zostało opublikowane na temat wpływu suplementacji chromu na ekspresję genów insuliny, lipidów i markerów zapalnych u niepłodnych kobiet z PCOS, które były kandydatami do IVF. Badanie to miało na celu określenie wpływu suplementacji chromem na ekspresję genów insuliny, lipidów i markerów zapalnych u niepłodnych kobiet, które cierpiały na PCOS i były kandydatami do IVF.
materiały i metody
projekt badania i charakterystyka uczestników
to randomizowane, podwójnie zaślepione, kontrolowane placebo badanie zostało zarejestrowane przez irańską stronę internetową w celu rejestracji badań klinicznych (http://www.irct.ir:IRCT20170513033941N32). Uwzględniono czterdzieści niepłodnych kobiet z PCOS w wieku 18-40 lat, które były kandydatami do IVF bez wcześniejszej historii IVF. Badanie przeprowadzono w szpitalu Taleghani w Teheranie w Iranie w okresie od lutego do maja 2018 r. W celu potwierdzenia rozpoznania PCOS zastosowano kryteria rotterdamskie (15). Z badania wykluczono uczestników z zaburzeniami metabolicznymi, w tym z zaburzeniami czynności tarczycy, cukrzycą lub z upośledzoną tolerancją glukozy. Badanie zostało przeprowadzone zgodnie z deklaracją Helsińską i wytycznymi Dobrej Praktyki Klinicznej i zostało zatwierdzone przez komitet etyki badań Uniwersytetu Nauk Medycznych Shahid Beheshti (SUMS), Teheran, Iran. Pisemna, świadoma zgoda została podpisana przez wszystkie osoby.
interwencja
uczestnicy zostali losowo przydzieleni do grup interwencyjnych, aby przez 8 tygodni przyjmowali pikolinian chromu w dawce 200 µg/dobę (Nature Made, Kalifornia, USA) (n = 20) lub placebo (Barij Essence, Kashan, Iran) (n = 20). Suplementy chromu i placebo zostały dopasowane pod względem kształtu, wyglądu, zapachu i opakowania. Randomizacja została wykonana przy użyciu wygenerowanych komputerowo liczb losowych. Proces randomizacji i alokacji był ukryty zarówno przed naukowcami, jak i uczestnikami, aż do zakończenia końcowych analiz. Inna osoba, nie biorąca udziału w badaniu i nieświadoma losowych sekwencji, przydzieliła badanych do ponumerowanych butelek z tabletkami. Przestrzeganie suplementów i placebo, w trakcie badania, było monitorowane, prosząc osoby o przywrócenie pojemników na leki. Aby zwiększyć wskaźnik zgodności, wszyscy uczestnicy otrzymywali krótkie codzienne przypomnienia na swoich telefonach komórkowych, aby wziąć suplementy. Uczestnicy badania uzupełnili zapisy żywieniowe w tygodniu 0, 4 i 8 interwencji.
ocena wyników
stężenia białka C-reaktywnego (hs-CRP) w surowicy o wysokiej czułości uznano za pierwszorzędowy wynik, a profile metaboliczne za drugorzędowy. Na początku i na końcu 8-tygodniowej interwencji w szpitalu Taleghani (Teheran, Iran) pobrano próbki krwi na czczo (15 mL). Poziomy Hs-CRP mierzono przy użyciu komercyjnego zestawu ELISA (LDN, Nordhorn, Niemcy) z wariancjami współczynników między i wewnątrz testu (CVs) niższymi niż 7%. Stężenia tlenku azotu (NO) w osoczu mierzono metodą Griesa (16), a CV wewnątrz testu wynosiło < 5%.
Izolacja komórek limfocytów
do ekstrakcji komórek limfocytów wykorzystano 50% percoll (Sigma-Aldrich, Dorset, UK). Badanie liczby komórek i żywotności przeprowadzono z wykorzystaniem błękitu trypanowego, RNA i ekstrakcji DNA (17).
ekstrakcja RNA i PCR w czasie rzeczywistym (RT-PCR)
RNA ekstrahowano z próbek krwi za pomocą zestawu RNX-plus (Cinnacolon, Teheran, Iran). Zawiesinę RNA zamrażano w temperaturze -20°C do uzyskania cDNA. Po ekstrakcji całkowitego RNA z każdej próbki RNA oznaczano ilościowo za pomocą spektrofotometru UV. Każda próbka o stosunku OD 260/280 wynoszącym 1,7–2,1 nie stanowiła zanieczyszczenia ani białkiem, ani DNA (17). Wykorzystując odwrotną transkryptazę wirusa białaczki myszy moloney (RT), wyizolowany RNA został poddany odwrotnej transkrypcji do biblioteki cDNA. Ekspresję genów PPAR-γ, transportera glukozy 1 (GLUT-1), receptora lipoprotein o niskiej gęstości (LDLR), IL-1, IL-8, TNF-α, TGF-β i czynnika wzrostu śródbłonka naczyniowego (VEGF) przeprowadzono na komórkach jednojądrzastych (PBMC) krwi obwodowej, stosując SYBR green detection i Amplicon Kit oraz stosując ilościową technologię RT-PCR i Light Cycler (Roche Diagnostics, Rotkreuz, Szwajcaria) (Tabela 1). Jako gen domowy stosowano startery dehydrogenazy gliceroaldehydowo-3-fosforanowej (GAPDH). Primery zostały zaprojektowane przy użyciu oprogramowania Primer Express (Applied Biosystems, Foster City, USA) i oprogramowania Beacon designer (Takaposizt, Teheran, Iran). Względne poziomy transkrypcji obliczano stosując metody Pffafi lub 2-ΔΔCT.

Tabela 1. Specyficzne startery stosowane do ilościowego PCR w czasie rzeczywistym.
wielkość próby i Metody statystyczne
wielkość próby obliczono przy użyciu ustalonego wzoru dla RCTs, przy czym błędy typu pierwszego (α) i typu drugiego (β) uznano za 0,05 i 0.20, aby zapewnić moc 80%. W oparciu o wcześniejsze opublikowane badanie (18) do obliczenia wielkości próby wykorzystano średnią różnicę (d) wynoszącą 1500,0 ng/mL i odchylenie standardowe (SD) wynoszące 1496,1 ng/mL. Biorąc pod uwagę prawdopodobny spadek liczby 4 pacjentów w każdej grupie interwencyjnej, ostateczną wielkość próby ustalono na 20 (16 + 4) pacjentów w każdej grupie.
normalność danych oceniano za pomocą testu Kołmogorowa-Smirnowa. Analizy przeprowadzono metodą intention-to-treat (ITT). W celu określenia różnic w miarach antropometrycznych i ekspresji genów insuliny, lipidów i stanów zapalnych pomiędzy grupami interwencyjnymi zastosowano test t niezależnych próbek. Wpływ suplementacji chromem na markery zapalne oceniano stosując powtarzane pomiary ANOVA test. Różnice w proporcjach zostały ocenione przez dokładny test Fishera. P < 0, 05 uznano za statystycznie istotne. Analizy statystyczne przeprowadzono przy użyciu pakietu statystycznego dla nauk społecznych wersja 18 (SPSS Inc., Chicago, Illinois, USA).
wyniki
w każdej grupie interwencyjnej zgłoszono trzy przypadki przerwania leczenia z przyczyn osobistych. W sumie 34 uczestników ukończyło badanie (Rysunek 1). Przy zastosowaniu podejścia ITT do końcowej analizy danych uwzględniono wszystkich 40 uczestników (po 20 w każdej grupie). Wskaźnik zgodności w tym badaniu był wysoki-ponad 90% tabletek było spożywanych podczas interwencji w obu grupach. W tym badaniu nie zgłoszono żadnych działań niepożądanych po spożyciu chromu u kobiet z PCOS.

Rysunek 1. Schemat przepływu pacjenta.
pomiary antropometryczne nie różniły się statystycznie w poszczególnych grupach interwencyjnych(Tabela 2). Ponadto, po suplementacji chromem wyniki IVF, w tym grubość endometrium, liczba pobranych komórek jajowych, liczba zapłodnionych komórek jajowych, wskaźnik zapłodnienia, wskaźnik ciąży i liczba zarodków, nie różniły się znacząco między grupami uzupełnionymi i placebo.

Tabela 2. Ogólna charakterystyka uczestników badania.
średnie spożycie makro-i mikroskładników pokarmowych również nie różniło się znacząco w obu grupach interwencyjnych w trakcie leczenia (dane nie zostały przedstawione).

Tabela 3. Markery zapalne na początku i po 8-tygodniowej interwencji u niepłodnych kobiet z zespołem policystycznych jajników kandydujących do zapłodnienia in vitro, które otrzymały suplementy chromu lub placebo.
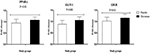
Rysunek 2. Fold change (means ± SDS) w poziomach ekspresji genów PPAR-γ, GLUT-1 i LDLR u kobiet z zespołem policystycznych jajników, które były kandydatami do zapłodnienia in vitro, otrzymujących suplementy chromu i placebo. Wartość P uzyskano w niezależnym teście T. N = 20 w każdej grupie. IL-1, interleukina-1; IL-8, interleukina-8; ldlr, utleniony receptor lipoprotein o niskiej gęstości; PPAR-γ, aktywowany proliferatorem peroksysomów receptor gamma; TNF-α, czynnik martwicy nowotworu alfa; TGF-β, transformujący czynnik wzrostu beta; VEGF, naczyniowy czynnik wzrostu śródbłonka.
suplementacja chromem obniżyła również ekspresję genu IL-1 (p = 0,004)w PBMC w porównaniu z placebo (rycina 3). Nie stwierdzono istotnego wpływu suplementacji chromem na ekspresję genów IL-8, TNF-α, TGF-β i VEGF u pacjentów z PCOS.
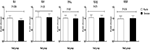
Rysunek 3. Zmiana (średnia ± SDs) w poziomach ekspresji genów IL-1, IL-8, TNF-α, TGF-β i VEGF u kobiet z zespołem policystycznych jajników, które były kandydatami do zapłodnienia in vitro, otrzymujących suplementy chromu i placebo. Wartość P uzyskano w niezależnym teście T. N = 20 w każdej grupie. IL-1, interleukina-1; IL-8, interleukina-8; ldlr, utleniony receptor lipoprotein o niskiej gęstości; PPAR-γ, aktywowany proliferatorem peroksysomów receptor gamma; TNF-α, czynnik martwicy nowotworu alfa; TGF-β, transformujący czynnik wzrostu beta; VEGF, naczyniowy czynnik wzrostu śródbłonka.
dyskusja
odkryliśmy korzystne efekty podawania chromu przez 8 tygodni u niepłodnych kobiet z PCOS, które były kandydatami do IVF. Suplementacja chromu obniżyła stan zapalny i poprawiła ekspresję genu PPAR-γ, GLUT-1, LDLR i IL-1, chociaż nie wpłynęła na ekspresję genu IL-8, TNF-α, TGF-β i VEGF. Zgodnie z naszą najlepszą wiedzą, jest to pierwsze badanie opisujące wpływ suplementacji chromu na ekspresję genów związaną z insuliną, lipidami i markerami zapalnymi u niepłodnych kobiet z rozpoznaniem PCOS i kandydatami do IVF.
wpływ chromu na ekspresję genów insuliny i metabolizm lipidów
pacjenci z PCOS są podatni na różne zaburzenia metaboliczne, takie jak zwiększona insulinooporność, dyslipidemia i przewlekłe zapalenie (19, 20). Obecne badanie wykazało, że suplementacja chromu przez 8 tygodni niepłodnym kobietom z PCOS, które były kandydatami do IVF, znacznie zwiększyła ekspresję genu PPAR-γ, GLUT-1 i LDLR. Zgodnie z naszymi ustaleniami, podawanie chromu szczurom z cukrzycą wykazało działanie przeciwcukrzycowe, prawdopodobnie związane z wpływem chromu na modulację białek PPAR-γ i IRS-1 (11). Wang et al. (12) stwierdzono również, że otyłe szczury uzupełnione chromem znacznie zwiększyły szybkość usuwania glukozy. Ponadto, w porównaniu z grupą kontrolną otyłych szczurów wykazano zwiększenie aktywności kinazy P-IRS-1 stymulowanej insuliną i kinazy fosfatydyloinozytolu-3 w mięśniach szkieletowych. W innym badaniu chrom, biotyna lub ich kombinacja znacznie zwiększyły ekspresję PPAR-γ w tkance tłuszczowej, co może mieć skuteczny wpływ uczulający na insulinę i zmniejszać oporność na insulinę w modelu szczura cukrzycowego (11). Chrom może również promować handel GLUT-4 i transport glukozy stymulowany insuliną (21). Podobnie, szczury z retinopatią cukrzycową, które były uzupełniane chromem przez 12 tygodni, wykazały poprawę ekspresji genu GLUT-1, GLUT-3 i insuliny (22). PPAR-γ jest centralnym regulatorem metabolizmu insuliny, glukozy i lipidów, który jest szeroko wyrażony w tkance tłuszczowej. PPAR-γ może poprawiać wrażliwość na insulinę i profil lipidów u pacjentów z cukrzycą typu 2, a także u gryzoni z cukrzycą (23). Obecne dowody sugerują, że agoniści PPAR-γ mogą być korzystni w zmniejszaniu lipidów korowych nerek i białkomoczu poprzez mechanizm niezależny od ich działania hipoglikemicznego (24, 25).
wpływ chromu na ekspresję genu markerów zapalnych
nasze badanie potwierdziło, że podawanie chromu przez 8 tygodni znacząco zmniejszyło ekspresję genu IL-1 i stężenia hs-CRP w surowicy u niepłodnych kobiet z PCOS, które były kandydatami do IVF, chociaż nie miało to wpływu na ekspresję genu IL-8, TNF-α, TGF-β i VEGF. Obecne dowody świadczące o wpływie suplementacji chromu na ekspresję genów markerów zapalnych i ich poziom krążenia są rzadkie i w większości ograniczone do badań na zwierzętach. Suplementacja chromu przez 8 tygodni szczurom Zucker diabetic fatty (ZDF) znacznie zmniejszyła ich poziom CRP w surowicy (26). W innym badaniu spożycie niacynianu chromu przez 7 tygodni zmniejszało poziomy prozapalnych cytokin (TNF-α, IL-6 i CRP), stres oksydacyjny i stężenie lipidów u szczurów z cukrzycą (13). Ponadto podawanie suplementu diety zawierającego pikolinian chromu, fosfatydyloserynę, kwas dokozaheksaenowy i bor przez 12 tygodni znacząco zmniejszało stężenia CRP i TNF-α u szczurów karmionych dietą wysokotłuszczową (27). Nie znaleźliśmy znaczącego wpływu suplementacji chromu na IL-8, TNF-α, TGF-β i VEGF, co można wyjaśnić poprzez zastosowanie różnych wzorów badań, rodzaju i dawek stosowanego chromu, czasu trwania interwencji i cech uczestników. Wyższe dawki chromu mogą znacznie poprawić profile metaboliczne, w tym IL-8, TNF-α, TGF-β i VEGF. Markery stanu zapalnego i stresu oksydacyjnego są podwyższone u wielu pacjentów z cukrzycą, co pozytywnie odzwierciedla stan zapalny naczyń (28). Insulinooporność i późniejsze zapalenie naczyń są głównymi czynnikami ryzyka rozwoju chorób sercowo-naczyniowych (29). Hamujący wpływ chromu na markery prozapalne może być ułatwiony przez inaktywację szlaków stresu oksydacyjnego i zmniejszenie fosforylacji Akt związanej z kaskadą insulinooporności w wątrobie (30). Obecne dowody wykazały, że zwiększone cytokiny zapalne są zaangażowane w wyniki IVF. W badaniu przeprowadzonym przez Haimovici et al. (31) kobiety, które urodziły płód, miały niższy poziom IL-6. Hamowanie wytwarzania progesteronu przez komórki lutealne w obecności IL-1β może być jednym z czynników prowadzących do niepowodzenia implantacji (32). Zwiększone pęcherzykowe TNF-α i IL-6 mogą pogorszyć mikrośrodowisko w pęcherzyku, a tym samym negatywnie wpłynąć na jakość oocytów i zarodka (33). W innym badaniu przeprowadzonym przez Levin et al. (34), wyższe poziomy CRP, podczas stymulacji IVF, były znacząco związane z niepowodzeniem poczęcia. Zgodnie z wyżej wymienionych opublikowanych dowodów założyliśmy, że wyniki IVF może mieć wpływ na zmniejszenie stanu zapalnego. Niedawne badania wykazały, że stosowanie inhibitora TNF-α i dożylnej immunoglobuliny znacznie poprawiło wyniki IVF, w tym; implantacja, ciąża kliniczna i żywe wskaźniki urodzeń u młodych niepłodnych kobiet, u których stwierdzono wysoki poziom cytokin T helper 1/T helper 2 (35).
w tym badaniu było kilka ograniczeń. Ze względu na niewystarczające finansowanie nie byliśmy w stanie zmierzyć poziomu chromu i nie mogliśmy ocenić wpływu chromu na ekspresję genów stresu oksydacyjnego.
Ogólnie rzecz biorąc, nasze badanie sugeruje zalety suplementacji chromem w obniżaniu markerów zapalnych poprzez poprawę ekspresji genów PPAR-γ, GLUT-1, LDLR i IL-1in niepłodnych kobiet z PCOS, które były kandydatami do IVF.
wkład autora
za pomoc w koncepcji, projektowaniu i analizie statystycznej rękopisu. MA, SZ, NM, EA I SS przyczyniły się do gromadzenia danych i opracowywania rękopisów. ZA nadzorował badania.
finansowanie
to badanie było wspierane przez grant od wicekanclerza ds. badań, Shahida Beheshti University of Medical Sciences i Teheranu, Iran.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Yildiz BO, Bozdag G, Yapici Z, Esinler I, Yarali H. występowanie, fenotyp i kardiometaboliczne ryzyko zespołu policystycznych jajników w różnych kryteriach diagnostycznych. Hum Reprod. (2012) 27:3067–73. doi: 10.1093/humrep / des232
PubMed Abstract / CrossRef Full Text / Google Scholar
2. Amato G, Conte m, Mazziotti G, Lalli e, Vitolo G, Tucker AT, et al. Cytokiny z surowicy i płynu pęcherzykowego w zespole policystycznych jajników podczas cykli stymulowanych. Ginekolog Położnik. (2003) 101:1177–82.
PubMed Abstract / Google Scholar
3. Valckx SD, Arias-Alvarez M, De Pauw I, Fievez V, Vlaeminck B, Fransen E, et al. Skład kwasów tłuszczowych w płynie pęcherzykowym o prawidłowej masie ciała, u kobiet z nadwagą i otyłych poddanych leczeniu wspomaganego rozrodu: opisowe badanie przekrojowe. Reprod Biol Endocrinol. (2014) 12:13. doi: 10.1186/1477-7827-12-13
PubMed Abstract / CrossRef Pełny Tekst / Google Scholar
4. Valckx SD, De Pauw I, De Neubourg D, Inion I, Berth M, Fransen e, et al. Zależny od BMI skład metaboliczny płynu pęcherzykowego u kobiet poddawanych leczeniu wspomaganego rozrodu oraz wpływ na jakość komórek jajowych i zarodków. Hum Reprod. (2012) 27:3531–9. doi: 10.1093/humrep / des350
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Letterio JJ, Roberts AB. Regulacja odpowiedzi immunologicznej przez TGF-beta. Annu Rev Immunol. (1998) 16:137–61
PubMed Abstract | Google Scholar
8. Fornari MC, Sarto A, Berardi VE, Martinez MA, Rocha MG, Pasqualini S, et al. Effect of ovaric hyper-stimulation on blood lymphocyte subpopulations, cytokines, leptin and nitrite among patients with unexplained infertility. Am J Reprod Immunol. (2002) 48:394–403.
PubMed Abstract | Google Scholar
10. Jamilian M, Zadeh Modarres S, Amiri Siavashani M, Karimi M, Mafi A, Ostadmohammadi V, et al. Wpływ suplementacji chromu na kontrolę glikemii, markery ryzyka sercowo-metabolicznego i stres oksydacyjny u niepłodnych kobiet z zespołem policystycznych jajników kandydujących do zapłodnienia in vitro: randomizowane, podwójnie ślepe, kontrolowane placebo badanie. Biol Trace Elem Res. (2018): 48-55. doi: 10.1007 / s12011-017-1236-3
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
11. Sahin K, Tuzcu m, Orhan C, Sahin N, Kucuk O, Ozercan IH, et al. Przeciwcukrzycowe działanie pikolinianu chromu i biotyny u szczurów z cukrzycą typu 2 indukowaną dietą wysokotłuszczową i streptozotocyną. Br J Nutr. (2013) 110:197–205. doi: 10.1017 | S0007114512004850
PubMed Abstract | CrossRef Full Text / Google Scholar
13. Jain SK, Rains JL, Croad Jl. Wpływ suplementacji niacynianem chromu i pikolinianem chromu na peroksydację lipidów, TNF-alfa, IL-6, CRP, glikowaną hemoglobinę, trójglicerydy i poziom cholesterolu we krwi szczurów z cukrzycą leczonych streptozotocyną. Free Radic Biol Med. (2007) 43:1124–31. doi: 10.1016 / J.freeradbiomed.2007.05.019
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
14. Martino F, Puddu PE, Pannarale G, Colantoni C, Martino E, Niglio T, et al. Niska dawka chromu-polikotynianu lub polikozanolu jest skuteczna u dzieci hipercholesterolemicznych tylko w połączeniu z glukomannanem. Miażdżyca. (2013) 228:198–202. doi: 10.1016 / j. miażdżyca.2013.02.005
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
15. Rotterdam ESHRE / ASRM-Sponsored PCOS Consensus Workshop Group. Poprawiony konsensus z 2003 r.w sprawie kryteriów diagnostycznych i długoterminowych zagrożeń dla zdrowia związanych z zespołem policystycznych jajników. Fertil Steril. (2004) 81:19–25.
Google Scholar
17. Dunkley PR, Jarvie PE, Robinson PJ. Procedura szybkiego gradientu Perkollu do wytwarzania synaptosomów. Protokół Nat. (2008) 3:1718–28. doi: 10.1038 / nprot.2008.171
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
18. Jamilian m, Bahmani F, Siavashani MA, Mazloomi M, Asemi Z, Esmaillzadeh A. Wpływ suplementacji chromu na profile endokrynologiczne, biomarkery stanu zapalnego i stres oksydacyjny u kobiet z zespołem policystycznych jajników: randomizowane, podwójnie ślepe, kontrolowane placebo badanie. Biol Trace Elem Res. (2016) 172: 72-8. doi: 10.1007 / s12011-015-0570-6
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
19. Asemi Z, Foroozanfard F, Hashemi T, Bahmani F, Jamilian M, Esmaillzadeh A. Suplementacja wapniem i witaminą D wpływa na metabolizm glukozy i stężenie lipidów u kobiet z nadwagą i otyłością z niedoborem witaminy D z zespołem policystycznych jajników. Clin Nutr. (2015) 34:586–92. doi: 10.1016 / j.clnu.2014.09.015
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
20. Foroozanfard F, Jamilian M, Bahmani F, Talaee R, Talaee N, Hashemi T, et al. Suplementacja wapniem i witaminą D wpływa na biomarkery stanu zapalnego i stresu oksydacyjnego u kobiet z nadwagą i niedoborem witaminy D z zespołem policystycznych jajników: randomizowane, podwójnie ślepe, kontrolowane placebo badanie kliniczne. Clin Endocrinol. (2015) 83:888–94. doi: 10.1111 / cen.12840
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
21. Chen G, Liu P, Pattar GR, Tackett L, Bhonagiri P, Strawbridge AB, et al. Chrom uaktywnia Transporter glukozy 4T3-L1 i wzmacnia stymulowany insuliną transport glukozy w adipocytach 3T3-L1 poprzez mechanizm zależny od cholesterolu. Mol Endokrynol. (2006) 20:857–70. 10.1210 / me.2005-0255
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
24. Benigni a, Zoja C, Campana M, Corna D, Sangalli F, Rottoli D, et al. Korzystny wpływ antagonizmu TGFbeta w leczeniu nefropatii cukrzycowej zależy od momentu rozpoczęcia leczenia. Nefron Exp Nefrol. (2006) 104: e158–68. doi: 10.1159/000094967
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
25. Bobulescu IA. Metabolizm lipidów w nerkach i lipotoksyczność. Curr Opin Nephrol Hypertens. (2010) 19:393–402. doi: 10.1097 / MNH.0b013e32833aa4ac
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
26. Jain SK, Croad JL, Velusamy T, Rains JL, Bull R. suplementacja Dinicocysteinianem chromu może obniżyć poziom glukozy we krwi, CRP, MCP-1, ICAM-1, kreatyniny, najwyraźniej za pośrednictwem podwyższonej witaminy C i adiponektyny we krwi oraz hamowania NFkappaB, Akt i Glut-2 w wątrobach szczurów tłuszczowych z cukrzycą Zucker. Mol Nutr Food Res. (2010) 54: 1371-80. doi: 10.1002 / mnfr.200900177
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
27. Sahin N, Akdemir F, Orhan C, Aslan A, Agca CA, Gencoglu H, et al. A novel nutritional supplement containing chromium picolinate, phosphatidylserine, docosahexaenoic acid, and boron activates the antioxidant pathway Nrf2/HO-1 and protects the brain against oxidative stress in high-fat-fed rats. Nutr Neurosci. (2012) 15:42–7. doi: 10.1179/1476830512Y.0000000018
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Haimovici F, Anderson JL, Bates GW, Racowsky C, Ginsburg ES, Simovici D, et al. Stres, lęk i depresja obu partnerów w niepłodnych par są związane z poziomem cytokin i niekorzystnym wynikiem IVF. Am J Reprod Immunol. (2018) 79:e12832. doi: 10.1111 / aji.12832
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
32. Wang XF, Xing FQ, Chen SL. Ekspresja interleukiny-1beta na komórkach ziarniniakowych jajnika i jej implikacja kliniczna u kobiet poddawanych zapłodnieniu in vitro. Di Yi Jun Yi Da Xue Xue Bao. (2002) 22:934–6.
PubMed Abstract / Google Scholar
33. Wunder DM, Mueller MD, Birkhauser MH, Bersinger NA. Zwiększenie stężenia ENA-78 w płynie pęcherzykowym u pacjentów z endometriozą. Acta Obstet Gynecol Scand. (2006) 85:336–42. doi: 10.1080/00016340500501715
PubMed Abstrakt / CrossRef Pełny tekst / Google Scholar