Frontiers in Medicine
- wprowadzenie
- pacjenci i metody
- selekcja pacjentów w bazie danych Surveillance, Epidemiology, and End Results Database
- Analiza statystyczna
- wyniki
- charakterystyka pacjentów
- zwiększono ryzyko wystąpienia Stadium T1 w porównaniu z innymi etapami T w kontekście zwiększenia CEA w surowicy
- wpływ przedoperacyjnego zwiększenia CEA w surowicy w stadium T
- dyskusja
- Oświadczenie o dostępności danych
- Etyka
- wkład autora
- konflikt interesów
- podziękowania
wprowadzenie
rak odbytnicy jest jednym z najczęstszych nowotworów złośliwych na świecie (1). Według American Joint Committee on Cancer (AJCC), anatomiczny stopień guza pierwotnego (stadium T) jest jednym z najważniejszych czynników prognostycznych. Jednak u pacjentów z tym samym T stadium raka odbytnicy wyniki kliniczne mogą się znacznie różnić.
po raz pierwszy opisano w 1965 r., że antygen karcinoembryonowy (CEA) jest glikoproteiną o masie 180-200 kDa i członkiem nadrodziny immunoglobulin (2). CEA jest wydzielana przez różne guzy lite, w tym 90% nowotworów jelita grubego (3). Jako najważniejszy i najbardziej wiarygodny biomarker prognostyczny w raku jelita grubego, podwyższone przedoperacyjne poziomy CEA są związane z gorszym rokowaniem raka jelita grubego (4-9).
poprzednie badania wykazały, że CEA było związane z adhezją komórek nowotworowych i odpornością wrodzoną w raku jelita grubego. Ponadto stwierdzono, że CEA ułatwia przyłączanie komórek raka jelita grubego do miejsc przerzutów i wspiera progresję nowotworu (10-12).
tradycyjnie odległe rozprzestrzenianie się komórek nowotworowych było uważane za późne Zdarzenie, jednak wyniki kilku wcześniejszych badań wskazywały, że nabycie potencjału przerzutowego może nastąpić w bardzo wczesnym stadium progresji nowotworu (13-16). Wo i in. (17) poinformował, że bardzo mały rozmiar guza zaangażowany w dodatni stan węzłów chłonnych może być substytutem agresywnej biologii. Następnie podejrzewamy, że bardzo wczesne stadium raka odbytnicy z podwyższeniem CEA w surowicy może sugerować wczesne nabycie potencjału przerzutowego i przewidywać bardzo słabe przeżycie raka odbytnicy.
jednak, zgodnie z naszą wiedzą, zgłoszono kilka badań w celu zbadania związku stopnia T i poziomu CEA w surowicy (C0 i C1) w określaniu rokowania raka odbytnicy. Dlatego przeprowadzamy to duże badanie populacyjne, aby zbadać, czy bardzo wczesne stadium T w kontekście wzrostu CEA w surowicy może być substytutem agresywnej biologicznie choroby i przewidzieć słabe przeżycie specyficzne dla przyczyny (CSS) raka odbytnicy. Aby usunąć wpływ dodatniości węzłów chłonnych na nasze badania, wykluczyliśmy pacjentów z dodatnimi węzłami i skoncentrowaliśmy analizę na pacjentach i–II stadium.
pacjenci i metody
selekcja pacjentów w bazie danych Surveillance, Epidemiology, and End Results Database
jako wiarygodne źródło informacji na temat zachorowalności na raka i przeżycia w USA oraz kompleksowe źródło informacji populacyjnych, w tym wszystkich nowo zdiagnozowanych przypadków raka występujących w obszarach uczestniczących w Surveillance, Epidemiology, and End Results (SEER), baza danych SEER obejmuje ~28% populacji amerykańskiej. Baza danych SEER nie zawierała żadnych identyfikatorów i była publicznie dostępna dla badaczy. SEER * Stat to oprogramowanie dostarczane przez program SEER w celu uzyskania informacji o pacjencie za pomocą dostępu online. Początkowo do listy wszystkich informacji związanych z pacjentem wykorzystano sesję Case-listing oprogramowania SEER*Stat (SEER * Stat 8.3.5), a pacjenci z rozpoznanym rakiem odbytnicy w stadium I–II (bez węzłów) między 1 stycznia 2004 r.a 31 grudnia 2015 r. zostali zidentyfikowani z bazy danych SEER (Rysunek 1). Pacjenci z rakiem odbytnicy zostali zidentyfikowani za pomocą kodów miejsca ICD-O-3 C199 i C209 oraz kodu zachowania 3 (pozycje NAACCR 522 i 523) (9). Zdecydowaliśmy się uwzględnić te lata, ponieważ informacje o CEA w surowicy przedoperacyjnej były rejestrowane począwszy od 2004 r., a obserwacja SEER zakończyła się w 2015 r.

Rysunek 1. Schemat definicji kohorty pacjentów.
następnie osoby, które otrzymały radioterapię neoadiuwantową, brak pozytywnego potwierdzenia histologicznego, nieznaną rasę, histologię bez gruczolakoraka lub nieaktywną obserwację, zostały wykluczone z naszego badania. Pacjenci z dostępnym przedoperacyjnym poziomem CEA w surowicy zostali włączeni do naszego badania i pogrupowaliśmy “dodatnie / podwyższone” i ” ujemne / normalne; w granicach normy ” jako C1 i C0 (informacje o etapie C). Wartości odcięcia CEA wynosiły odpowiednio 2,5 ng/ml dla osób niepalących i 5 ng/ml dla osób palących. Ponadto z bazy SEER pobrano również następujące zmienne kliniczno-patologiczne pacjentów: stopień T, rasa, płeć, lokalizacja guza, wiek w momencie rozpoznania, rok rozpoznania, stopień i histologia.
Analiza statystyczna
w niniejszym badaniu wykorzystano test Chi-squared Pearsona do porównania wszystkich zmiennych kliniczno-patologicznych pacjentów pobranych z bazy danych SEER między prawidłowym i podwyższonym poziomem CEA w surowicy przedoperacyjnej. W celu identyfikacji niezależnych zmiennych prognostycznych raka odbytnicy w naszych analizach stworzono kilka wielowymiarowych modeli proporcjonalnego ryzyka Coxa. Krzywe przeżycia generowano metodą Kaplana-Meiera, a różnice między krzywymi analizowano za pomocą testu logarytmicznego. Głównymi wynikami zainteresowania w niniejszym badaniu były CSS i całkowite przeżycie (OS). CSS został obliczony od daty rozpoznania do daty śmierci specyficznej dla nowotworu. Zgony przypisywane rakowi odbytnicy były traktowane jako zdarzenia, a zgony z innych przyczyn były traktowane jako ocenzurowane obserwacje w dniu śmierci. Aby ustalić, czy w przewidywaniu CSS wystąpiła istotna interakcja między poziomem CEA w surowicy przedoperacyjnej a poziomem t, zdefiniowaliśmy również zmienną interakcji (etap T i poziom CEA w surowicy). Obustronne P < 0, 05 uznano za istotne statystycznie. Analizy statystyczne były wykonywane głównie przy użyciu SPSS w wersji 22 (IBM Corporation, Armonk, NY, USA).
wyniki
charakterystyka pacjentów
ogółem w bazie danych SEER między 1 stycznia 2004 r.A 31 grudnia 2015 r. zidentyfikowano 19 184 pacjentów z rozpoznanym rakiem odbytnicy w stadium I–II (rycina 1). Spośród tych pacjentów 13 007 (67,8%) pacjentów przypisano do stopnia C0, a 6 177 (32,2%) pacjentów przypisano do stopnia C1. System stopniowania AJCC sugerował, że 6077 pacjentów było w fazie T1, 4783 pacjentów w fazie T2, 7021 w fazie T3, a 1303 w fazie T4. W sumie 2560 (13,3%) pacjentów zmarło na raka odbytnicy pod koniec okresu obserwacji. Mediana czasu obserwacji całej kohorty wynosiła 44 miesiące (0-143 miesiące). Wyjściowe charakterystyki pacjentów przedstawiono w tabeli 1.
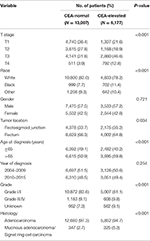
Tabela 1. Porównanie wyjściowej charakterystyki raka odbytnicy w stadium I–II na podstawie stężenia antygenu Rakowo-błonowego w surowicy (cea).
zwiększono ryzyko wystąpienia Stadium T1 w porównaniu z innymi etapami T w kontekście zwiększenia CEA w surowicy
stwierdzono, że Stadium C1 było bardziej prawdopodobne, że korelowało z wyższym Stadium t, czarnym, złączem odbytnicy, starszym wiekiem, wyższym stopniem i rakiem gruczolakoraka śluzowatego/raka pierścienia Sygnetowego (Tabela 1, P < 0, 05). Jak pokazano w tabeli 2, rasa, płeć, lokalizacja guza, wiek w momencie rozpoznania, rok rozpoznania, stopień zaawansowania, histologia, Stopień T i poziom CEA w surowicy zostały włączone do wielowymiarowej analizy Cox. Po przeprowadzeniu wielowymiarowej analizy Coxa przekonaliśmy następujące cechy kliniczno-patologiczne jako niezależne czynniki prognostyczne w stadium I-II raka odbytnicy; obejmowały one rasę, płeć, lokalizację guza, wiek w momencie rozpoznania, stopień guza, stopień T i poziom CEA w surowicy, podczas gdy ryzyko między T2,C0 i T1,C0 nie było różnicą statystyczną (P = 0,925). Wykazano, że w kontekście podwyższonego stężenia CEA w surowicy, stopień T1 wykazywał nieoczekiwane większe ryzyko śmiertelności specyficznej dla raka odbytnicy w porównaniu z etapami T2 i T3. W stadium zaawansowania T1 podwyższone stężenie CEA w surowicy wiązało się ze zwiększonym o 227,6% ryzykiem śmiertelności w porównaniu z prawidłowym stężeniem CEA w surowicy.

Tabela 2. Wielowymiarowa analiza regresji Coxa przeżycia specyficznego dla przyczyny (CSS)w raku odbytnicy i–II stadium.
krzywe przeżycia Kaplana–Meiera są przedstawione na rysunkach 2, 3. 5-letni współczynnik CSS wynosił 92,2% w t1c0, 75,2% w t1c1, 93,1% w t2c0, 86,7% w t2c1, 84,6% w T3C0, 76,3% w t3c1, 62,9% w t4c0 i 43,6% w t4c1 (Rysunek 2, P < 0,001). W związku z tym T1C1 wykazywał podobny 5-letni współczynnik CSS w porównaniu z t3c1 (75,2 vs 76,3%, P = 0,238). Ponadto stwierdzenie to było jeszcze wyraźniejsze w OS. 5-letni wskaźnik OS wynosił 78,6% w t1c0, 48,3% w t1c1, 77,1% w t2c0, 62,3% w t2c1, 68,5% w t3c0, 54,5% w t3c1, 45,3% w t4c0 i 30,0% w t4c1 (rycina 3, P < 0,001). T1C1 charakteryzował się znacznie niższym pięcioletnim współczynnikiem CSS w porównaniu z T3C1(48,3 vs. 54,5%, P < 0,001).
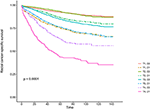
Rysunek 2. Krzywe przeżycia specyficznego dla przyczyny Kaplana–Meiera (CSS) stopnia T w połączeniu z poziomem antygenu Rakowo -embrionicznego w surowicy (cea).
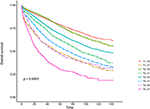
Rysunek 3. Krzywe przeżycia całkowitego Kaplana-Meiera (OS) w stadium T w połączeniu z poziomem antygenu Rakowo -embrionicznego w surowicy (cea).
wpływ przedoperacyjnego zwiększenia CEA w surowicy w stadium T
Wykres leśny przedstawiono współczynniki ryzyka (hrs) w celu porównania CSS pomiędzy grupami cea o prawidłowej i podwyższonej wartości w odpowiednich stadiach t (Fig.4). W porównaniu z prawidłowym poziomem CEA w surowicy, w stadium T2 podwyższony poziom CEA w surowicy wiązał się ze zwiększonym o 69,0% ryzykiem śmiertelności specyficznej dla raka odbytnicy ; w stadium T3 podwyższony poziom CEA w surowicy wiązał się ze zwiększonym o 67,2% ryzykiem śmiertelności specyficznej dla raka odbytnicy (HR = 1,672, 95% CI = 1,486-1,882, P < 0,001); w stadium T4 podwyższony poziom CEA w surowicy wiązał się ze zwiększonym o 81,3% ryzykiem śmiertelności specyficznej dla raka odbytnicy (HR = 1,672, 95% CI = 1,486-1,882, P < 0,001). % zwiększone ryzyko śmiertelności specyficznej dla raka odbytnicy (HR = 1, 813, 95% ci = 1, 485-2, 213, P < 0, 001); natomiast w stadium T1 podwyższone stężenie cea w surowicy występowało nawet do 211.6% zwiększone ryzyko śmiertelności specyficznej dla raka odbytnicy(HR = 3, 116, 95% CI = 2, 639–3, 679, P < 0, 001).
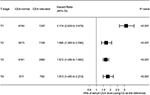
Rysunek 4. Współczynniki ryzyka (hrs) przeżycia specyficznego dla przyczyny (CSS) pomiędzy normalnym i podwyższonym poziomem antygenu Rakowo -embrionicznego w surowicy (CEA) w zależności od stopnia T.
dyskusja
naszym celem było zbadanie związku stopnia T i poziomu CEA w surowicy w określaniu CSS raka odbytnicy. Postawiliśmy hipotezę, że rak odbytnicy z bardzo wczesnym stadium T (Stadium T1) i podwyższeniem CEA w surowicy może być biologicznym substytutem agresywnej choroby, przewidując w ten sposób zły wynik onkologiczny. Z ~20 000 pacjentów, u których zdiagnozowano raka odbytnicy w stadium I–II, włączonych do naszego badania.
w tym badaniu stwierdzono, że podwyższenie CEA w surowicy było bardziej prawdopodobne, aby korelowało z wyższym stopniem T, czarnym, złączem odbytnicy, starszym wiekiem i wyższym stopniem i rakiem gruczolakoraka śluzowatego/raka pierścienia Sygnetowego. Analizy przeżycia Kaplana–Meiera wykazały, że w kontekście podwyższenia CEA w surowicy, 5-letni współczynnik CSS w stadium T1 wynosił 75,2%, co nie wykazało statystycznej różnicy w stosunku do stadium T3 (76,3%). Jeśli chodzi o całkowite przeżycie, 5-letni wskaźnik OS w stadium T1 z przedoperacyjnym podwyższeniem CEA w surowicy (48,3%) był nawet niższy niż w stadium T3 z podwyższeniem cea (54,5%) i nie osiągnął statystycznej różnicy w stosunku do stopnia T4 (45.3%), co oznacza, że podwyższony przedoperacyjny poziom CEA w surowicy może zidentyfikować podgrupę nowotworów odbytnicy w stadium T1 z podobnym CSS w porównaniu z niektórymi chorobami w stadium T3 i z podobnym OS w porównaniu z niektórymi chorobami w stadium T4.
po skorygowaniu znanych czynników prognostycznych raka odbytnicy (rasa, płeć, lokalizacja guza, wiek w momencie rozpoznania, rok rozpoznania, stopień zaawansowania i histologia) wykazano, że zmienna interakcji (stopień T i poziom CEA w surowicy), którą zdefiniowaliśmy, jest niezależnym czynnikiem prognostycznym raka odbytnicy. Wielowymiarowa analiza Coxa wykazała, że w kontekście podwyższonego stężenia CEA w surowicy, stopień T1 stwarzał nieoczekiwane większe ryzyko śmiertelności specyficznej dla raka odbytnicy w porównaniu z etapami T2 i T3. W stadium zaawansowania T1 podwyższone stężenie CEA w surowicy wiązało się ze zwiększonym o 227,6% ryzykiem śmiertelności w porównaniu z prawidłowym stężeniem CEA w surowicy. Ponadto, rasa, płeć, lokalizacja guza, wiek w momencie rozpoznania i stopień guza zostały również zidentyfikowane jako niezależne czynniki prognostyczne raka odbytnicy w stadium I–II. Oprócz T1 stwierdzono, że przedoperacyjne podwyższenie CEA w surowicy powodowało około 75% większe ryzyko śmiertelności specyficznej dla raka odbytnicy w odpowiednim Stadium T, jednak liczba ta znacznie wzrosła do 211,6% w stadium T1.
w 2000 r.Grupa Robocza ds. jelita grubego AJCC zaproponowała włączenie poziomu CEA w surowicy (Stadium C) do konwencjonalnego systemu stopniowania TNM raka jelita grubego AJCC (18). Ponadto Amerykańskie Towarzystwo Onkologii Klinicznej i Europejska Grupa markerów nowotworowych wspierały włączenie przedoperacyjnego poziomu CEA w surowicy jako narzędzia prognostycznego w raku jelita grubego (19-21).
kilka wcześniejszych badań donosiło, że poziom CEA w surowicy ma silną rolę prognostyczną w raku jelita grubego (4-7, 22-26). W 2011 roku Thirunavukarasu et al. (25) poinformował, że przedoperacyjny poziom CEA w surowicy był niezależnym biomarkerem prognostycznym raka jelita grubego, a rokowanie było gorsze u pacjentów z wysokim CEA z niższym Stadium w porównaniu z pacjentami z niskim CEA z wyższym Stadium. W badaniu tym wysokie CEA uznano nawet za tak silne, jak dodatni wynik węzła w celu przewidywania złych wyników onkologicznych raka jelita grubego.
jednak niewiele badań koncentruje się na wyjaśnieniu prognostycznej roli poziomu CEA w raku odbytnicy. W 2016, również przy użyciu bazy danych SEER, Tarantino et al. (9, 27) przeprowadził dwa duże badania populacyjne, które dostarczyły przekonujących dowodów na to, że podwyższony poziom CEA w surowicy przedoperacyjnej był silnym predyktorem gorszego ogólnego i specyficznego dla raka przeżycia w raku odbytnicy. W 2018 roku Liu et al. (8) wykazano, że przedoperacyjny poziom CEA w surowicy był niezależnym czynnikiem prognostycznym raka odbytnicy, a podwyższony poziom CEA w surowicy wykazywał ewidentnie gorszą przeżywalność w porównaniu z normalnym poziomem CEA w surowicy w stadiach I–IV. jednak tylko dwa poprzednie badania koncentrowały się na badaniu prognostycznej roli przedoperacyjnego poziomu CEA w surowicy nie badały związku poziomu CEA I etapu T w przewidywaniu wyników nowotworu raka odbytnicy.
chociaż konwencjonalne pokazuje, że rak nabywa potencjał przerzutowy krok po kroku, gdy rosną do dużych rozmiarów (28), jednak niektóre wcześniejsze badania wykazały, że nabycie potencjału przerzutowego może wystąpić bardzo wcześnie w progresji guza. Wcześniejsze badania wykazały skrajnie słabą przeżywalność bardzo małych rozmiarów guza, gdy jest on zaangażowany w dodatni stan węzłów chłonnych (17). Ponadto wyniki naszych badań pokazują, że podwyższenie poziomu CEA w surowicy przedoperacyjnej w bardzo wczesnym stadium (Stadium T1) raka odbytnicy jest związane z bardzo słabym OS i CSS i może być substytutem agresywnej biologii. Uważamy, że zarówno zajęcie węzłów chłonnych, jak i podwyższenie CEA w surowicy są uważane za nabycie zdolności przerzutowej. Nasze badania, w połączeniu z wo et al. konsekwentnie popieraj powyższą ideę, że nabycie potencjału przerzutowego może wystąpić bardzo wcześnie w progresji nowotworu, co wiąże się ze słabymi wynikami onkologicznymi, a początkowe cechy biologiczne są bardziej prawdopodobne, aby określić potencjał odległych przerzutów podczas progresji raka, zamiast skumulowanej zdolności przerzutowej (29).
ponadto wyniki naszych badań mają znaczenie kliniczne. Obecnie, Stadium i raka odbytnicy jest leczony z radykalnej resekcji chirurgicznej sam ze względu na stosunkowo korzystnych wyników onkologicznych. Jednak około 10-15% pacjentów rozwinie nawrót guza po radykalnej resekcji (30, 31). W niniejszym badaniu, zdarza się zidentyfikować podgrupę Stadium T1 raka odbytnicy z bardzo złym rokowaniem w porównaniu z resztą Stadium i raka odbytnicy, co oznacza, że te Stadium T1 raka odbytnicy z udziałem przedoperacyjnego wzrostu CEA w surowicy powinny przyciągnąć większą uwagę onkologów.
jednak w naszym badaniu istnieją dwa ograniczenia. Z jednej strony badanie to nie uwzględniło w naszych analizach niektórych znanych czynników prognostycznych raka odbytnicy, w tym stanu niestabilności mikrosatelitowej i powikłań pooperacyjnych, które nie były dostępne w bazie danych SEER i mogły w pewnym stopniu wprowadzać uprzedzenia. Nie możemy podać zakresów i średnich wartości CEA w obu grupach. Z drugiej strony, niniejsze badanie było raczej retrospektywne niż oparte na danych prospektywnych. W związku z tym nasze wyniki nadal muszą zostać potwierdzone w innych kohortach, zwłaszcza w dużych prospektywnych badaniach klinicznych.
podsumowując, nasze badanie pokazuje, że rak odbytnicy w stadium T1, gdy bierze udział w przedoperacyjnym podwyższeniu CEA w surowicy, może być substytutem agresywnej biologicznie choroby i korelować z niekorzystnymi OS i CSS. Co więcej, Ta podgrupa raka odbytnicy zasługuje na większą uwagę kliniczną onkologów. Nasze wyniki, jeśli zostaną potwierdzone w przyszłych badaniach bazy danych, dostarczyłyby nowego pomysłu na terapię we wczesnym stadium raka odbytnicy.
Oświadczenie o dostępności danych
zbiory danych wygenerowane dla tego badania są dostępne na żądanie do odpowiedniego autora.
Etyka
pacjenci w tym badaniu zostali zidentyfikowani z bazy danych SEER, a zgodę na wykorzystanie danych uzyskano na podstawie wniosku złożonego do programu SEER. Zatwierdzenie przez institutional review board nie było potrzebne, ponieważ baza danych SEER jest publicznie dostępna.
wkład autora
SW i WG wniosły znaczący i bezpośredni wkład w to badanie i zatwierdziły je do przedłożenia.
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
ta praca była częściowo wspierana przez projekt planu rozwoju nauk medycznych i technologii Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. Ca Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
2. Gold P, Freedman SO. Demonstracja antygenów specyficznych dla nowotworu w raku jelita grubego człowieka za pomocą technik tolerancji immunologicznej i absorpcji. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
3. Goldstein MJ, Mitchell EP. Antygen Rakowo -embrioniczny w inscenizacji i obserwacji pacjentów z rakiem jelita grubego. Cancer Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Ocena prognostycznej roli podwyższonego przedoperacyjnego poziomu antygenu Rakowo-błonowego u pacjentów z rakiem jelita grubego: wyniki z national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori s, Ushijima m, et al. Podwyższony przedoperacyjny poziom antygenu Rakowo -embrionowego w surowicy może być skutecznym wskaźnikiem konieczności chemioterapii adiuwantowej po potencjalnie leczniczej resekcji raka jelita grubego II stopnia. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
6. Quah HM, Chou JF, Gonen m, Shia J, Schrag D, Landmann RG, et al. Identyfikacja pacjentów z rakiem jelita grubego II stopnia wysokiego ryzyka do leczenia uzupełniającego. Odbytnica Okrężnicy. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. Włączenie CEA poprawia stratyfikację ryzyka w stadium II raka jelita grubego. 21: 770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combination of carcinoembryonic antigen with the American Joint Committee on Cancer TNM staging system in rectal cancer: a real-world and large population-based study. Onco Celuje Tam. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Predictive value of CEA for survival in stage I rectal cancer: a population-based propensity score-matched analysis. 20:1213-22 doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
12. Cai z, Xiao J, He X, ke J, Zou Y, Chen Y, et al. Dostęp do nowego znaczenia prognostycznego przedoperacyjnego antygenu Rakowo-błonowego w raku jelita grubego otrzymującym resekcję guza: więcej niż pozytywne i negatywne. Rak Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstract / CrossRef Full Text / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M,Fürstenberger G, Richter R, et al. Proces przerzutów do raka piersi. Eur J Rak. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer m, Burghart e, et al. Ogólnoustrojowe rozprzestrzenianie się jest wczesnym etapem raka piersi. Komórka Nowotworowa. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Siew i rozmnażanie nieprzetransformowanych komórek sutka myszy w płucach. Nauka. (2008) 321:1841–4. 10.1126 / nauka1161621
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis a, Granzow m, Ahr a, Blankenstein TJ, et al. Od utajonych rozsianych komórek do jawnych przerzutów: analiza genetyczna ogólnoustrojowej progresji raka piersi. Proc Natl Acad sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin nu, Punglia RS. Wpływ bardzo małych rozmiarów guza na śmiertelność specyficzną dla nowotworów w raku piersi z przerzutami do węzłów chłonnych. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j.breastdis.2012.01.026
CrossRef Pełny Tekst / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostic factors consensus conference: colorectal working group. Rak. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::pomoc-CNCR30>3.0.CO;2-T
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
19. Duffy MJ, van Dalen a, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Markery nowotworowe w raku jelita grubego: wytyczne Europejskiej Grupy markerów nowotworowych (EGTM) do stosowania klinicznego. Eur J Rak. (2007) 43:1348–60. doi: 10.1016 / j.ejca.2007.03.021
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 aktualizacja zaleceń dotyczących stosowania markerów nowotworowych w raku przewodu pokarmowego. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini a, Kalousová M, Holubec L, et al. Markery nowotworowe w raku jelita grubego, raku żołądka i nowotworach podścieliska przewodu pokarmowego: European group on tumor markers 2014 Guidelines update. Int J Rak. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Przedoperacyjny antygen Rakowo-błonowy przewiduje wyniki u pacjentów z rakiem okrężnicy bez węzłów chłonnych: Wielowymiarowa analiza 572 pacjentów. J Am Coll. (1997)185: 55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Przedoperacyjny poziom antygenu rakotwórczego jako niezależny czynnik prognostyczny w potencjalnie leczniczym raku jelita grubego. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
24. Ozawa H, Kotake K, Hosaka m, Hirata a, Nakagawa y, Fujita s, et al. Włączenie stężenia antygenu Rakowo -embrionicznego w surowicy krwi do systemu grupowania prognostycznego raka jelita grubego. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan m, Pragatheeshwar KD, Pingpank JF, et al. C-etap w raku jelita grubego: implikacje carcinoembryonic antygen biomarker w inscenizacji, rokowanie, i zarządzanie. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093/jnci / djr078
PubMed Abstract / CrossRef Full Text / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Ocena wartości prognostycznej stężenia antygenu Rakowo-błonowego w I I II stadium raka jelita grubego. Eur J Rak. (2018) 94:1–5. doi: 10.1016 / j.ejca.2018.01.112
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
27. Tarantino I, Warschkow R, Worni m, Merati-Kaszani K, Köberle D, Schmied BM, et al. Podwyższone przedoperacyjne CEA jest związane z gorszym przeżyciem u pacjentów z rakiem odbytnicy w stadium I-III. Br J Rak. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
28. Norton L, Massague J. czy rak to choroba samoistnego siewu? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
29. YU KD, Jiang YZ, Chen S, Cao Zg, Wu J, Shen ZZ i in. Wpływ dużych rozmiarów guza na śmiertelność specyficzną dla nowotworów w raku piersi z przerzutami do węzłów chłonnych. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j.mayocp.2012.07.023
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Stadium i raka odbytnicy: identyfikacja pacjentów wysokiego ryzyka. J Am Coll (1998)186: 574-9; dyskusja: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic m, et al. Wpływ t I N Stadium i leczenia na przeżywalność i nawrót w adiuwantowym raku odbytnicy: analiza zbiorcza. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar