Frontiers in Neurology
- wprowadzenie
- metody
- pacjenci
- badania przewodzenia nerwów
- USG
- statystyki
- wyniki
- cechy kliniczne
- obszar przekroju poprzecznego (Csa)
- korelacja wyników maxCSA i Medical Research Council Sum Score (MRC)
- korelacja CSA i CB
- dyskusja
- ograniczenia
- data Availability Statement
- Deklaracja Etyki
- wkład autora
- podziękowania
- Materiały uzupełniające
- skróty
wprowadzenie
wieloogniskowa neuropatia ruchowa (MMN) została po raz pierwszy opisana w 1988 roku (1) jako neuropatia czysto ruchowa wpływająca na wiele nerwów ruchowych z blokiem przewodzenia (CB). Silnik CB jest podstawowym znakiem elektrofizjologicznym w diagnostyce MMN. USG nerwów może dostarczyć cech morfologicznych nerwów obwodowych. Wieloogniskowe powiększenie nerwów obwodowych lub korzeni szyjnych w obszarach przekrojowych nerwów (CSAs) odnotowano w MMN (2-4). Kerasnoudis et al. (5) odnotowano korelację pomiędzy potencjałem złożonego działania ruchowego (CMAPs) i CSAs nerwu środkowego w górnej części ramienia (r = 0, 851, p < 0, 001). Beekman et al. (6) stwierdzono, że badania USG wykazały zwiększoną CSA nerwu zgodny z zaburzeniami przewodzenia więcej niż oczekiwano na czysto klinicznych podstaw. Co więcej, niektóre miejsca wykazywały powiększenie nerwów bez CB. Wieloogniskowe CBs były rozmieszczone wzdłuż nerwu w MMN; w badaniach tych mierzono jednak tylko kilka wcześniej określonych miejsc, dostarczając ograniczonych informacji morfologicznych. W tym badaniu zastosowanie kolejnego skanowania wzdłuż nerwu i pomiaru CSA w wielu miejscach na podstawie ultradźwięków pozwoliło na dokładniejszą korelację między blokiem przewodzenia a zwiększonym CSA w MMN.
metody
pacjenci
między grudniem 2014 r.a majem 2018 r. kolejno rekrutowano 12 pacjentów MMN ze szpitala Peking Union Medical College Hospital zgodnie z kryteriami zaproponowanymi przez AANEM (7). Taką samą liczbę zdrowych grup kontrolnych (HC), dopasowaną do wieku (±1 rok), włączono jako grupy kontrolne. Wszyscy pacjenci i zdrowi kontrolni przeszli standaryzowane badanie kliniczne obejmujące badanie siły mięśni nadgarstka, kciuka i palca zgięcia, opponens pollicis, abductor pollicis brevis, finger spreading i adductor pollicis, wraz z testami sensorycznymi. Tego samego dnia przeprowadzono badania kliniczne, elektromiogram i USG nerwów. Komisja Etyki szpitala Pekin Union Medical College zatwierdziła nasz protokół badania, a wszyscy pacjenci podpisali formularz świadomej zgody zgodnie z deklaracją Helsińską.
badania przewodzenia nerwów
badania przewodzenia nerwów ruchowych (NCSs) przeprowadzono u wszystkich pacjentów na nerwach obustronnych środkowych i łokciowych z przezskórną stymulacją nerwów supramaksymalnych podczas rejestracji CMAP za pomocą elektrod dyskowych 10 mm. Standardowe segmenty zostały zdefiniowane jako nadgarstek do łokcia i łokieć do pachy dla nerwu środkowego oraz jako nadgarstek do łokcia poniżej i łokieć górny do pachy dla nerwu łokciowego. Technikę inching (stymulowanie wzdłuż przebiegu nerwu w krokach 2 cm) przeprowadzono na niektórych standardowych segmentach z częściowym blokiem przewodzenia, wykrywając dokładne miejsce CB, wraz z kolejnym badaniem ultrasonograficznym w tym samym segmencie. Diagnostykę CB segmentów standardowych i technikę inchingu przeprowadzono zgodnie z kryteriami sugerowanymi przez aanem (7). Aby uwzględnić tylko prawdziwy blok przewodzenia, dystalny CMAP musiał wynosić 1 mV. Utrzymywano temperaturę pokojową w celu zapewnienia, że temperatura skóry utrzymywała się na poziomie >31°C. technicy byli zaślepieni na temat informacji o pacjencie.
USG
badania ultrasonograficzne przeprowadzono za pomocą śledzenia nerwów od nadgarstka do pachy na obu nerwach środkowych i łokciowych za pomocą przetwornika liniowego 10 MHz (GE LOGIQ E, USA). W celu wyeliminowania sztucznego przyrostu wielkości nerwów nie dopuszczono do tych pomiarów powiększenia. Początkowe ustawienia były stałe podczas wszystkich badań, w tym głębokości. Przetwornik trzymano prostopadle do nerwu pod kątem wybranym w celu uzyskania najmniejszego i najjaśniejszego obrazu. Csa w wcześniej określonych miejscach na każdym nerwie mierzono przez śledzenie tuż wewnątrz hiperechoicznej krawędzi nerwu. Dziesięć wcześniej określonych miejsc mierzono na każdym nerwie zgodnie z poprzednim raportem z naszego laboratorium (8). W przypadku nerwu środkowego 10 miejsc obejmowało wylot cieśni nadgarstka (M1), środkowy punkt zagięcia nadgarstka (m2), wlot cieśni nadgarstka (m3), 4 cm bliżej zagięcia nadgarstka (M4), środek między zagięciem nadgarstka a łokciem (M5), wejście do pronatora teres (M6), łokcia (M7), 4 cm powyżej łokcia (M8), 8 cm powyżej łokcia (M9) i pachwinę (M10). W przypadku nerwu łokciowego 10 miejsc obejmowało nadgarstek (U1), 4 cm bliżej nadgarstka (U2), punkt odchodzący od tętnicy łokciowej (U3), obok brzucha mięśnia zginacza nadgarstka (U4), wylot tunelu łokciowego (U5), wewnątrz tunelu łokciowego (U6), wlot tunelu łokciowego (U7), 4 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm bliżej wlotu tunelu łokciowego (U8), 8 cm U9), oraz w okolicy pachowej (U10). Poza wyżej wymienionymi miejscami, pomiary wykonano również w innych miejscach rozszerzenia. Powiększenie CSA nawiązano do wartości normatywnych w naszym laboratorium (w nerwie środkowym segmenty przedramienia i łokcia wynosiły ≤ 10 mm2, a łokcia i pachwiny ≤ 9 mm2; w nerwie łokciowym segmenty przedramienia i ramienia wynosiły ≤ 6 mm2). Po pomiarze CSA nerw ponownie śledzono w sposób ciągły i dokładnie rejestrowano. Z badania wykluczono częste neuropatie uciskowe powodujące powiększenie nerwów. Ultrasonografowie byli zaślepieni na informacje o pacjencie.
statystyki
CSAs MMN wykazały rozkład nienormalny. Mann-Whitney U-test został użyty do porównania MMN i zdrowych kontroli oraz różnicy w maksymalnych CSAs między segmentami z CB i tych bez CB. Maksymalna wartość CSA została zdefiniowana jako maksymalna wartość CSA w segmencie standardowym. We wszystkich badaniach uznano, że statystycznie istotna jest obustronna wartość P <0, 05.
wyniki
cechy kliniczne
8 mężczyzn i 4 kobiety w średnim wieku 43, 7 lat (zakres 21-62, SD 13, 2), 12 zdrowych grup kontrolnych (średni wiek 43, 6, Zakres 28-57, SD 13, 3, 8 mężczyzn). Średni czas trwania choroby wynosił 65.3 (24-108) miesięcy. Średni wzrost wynosił 168 (155-186) cm, a średnia masa ciała 65,4 (56,5–88) kg. Wszyscy pacjenci byli nieleczeni.
obszar przekroju poprzecznego (Csa)
wartości Csa dla mediany i nerwów łokciowych w MMN i HC w 10 miejscach przedstawiono w tabeli 1 i na fig.1. Rozszerzenia CSA były wieloogniskowe w porównaniu ze zdrowymi grupami kontrolnymi. W nerwach środkowych wyższe wartości CSA były rozłożone głównie w segmencie przedramienia i górnego ramienia. Miejsca poniżej łokcia i górny segment nerwów łokciowych wykazały bardziej oczywiste powiększenie CSA. Co ciekawe, wspólne miejsca ucisku nerwów, takie jak Kanał nadgarstka i tunel łokciowy, nie ujawniły rozpowszechnionego wzrostu CSA u pacjentów z MMN w porównaniu ze zdrowymi grupami kontrolnymi.

Tabela 1. CSA w różnych miejscach nerwów środkowych i łokciowych w MMN i HC.

Rysunek 1. Rozmieszczenie 10 miejsc CSA w nerwach środkowych i łokciowych. Linię 10 mm2 wyznaczono jako wyróżniającą znaczące nieprawidłowości miejsc CSA od pozostałych segmentów. A) dla nerwu środkowego: M1-wylot kaniuli nadgarstka, M2-środkowy punkt zagięcia nadgarstka, m3-wlot kaniuli nadgarstka, M4-4 cm bliżej zagięcia nadgarstka, M5-środkowy punkt między zagięciem nadgarstka a łokciem, M6-wejście do pronatora teres, M7-łokieć, M8-4 cm nad łokciem, M9-8 cm nad łokciem, M10-pachwina. B) Dla nerwu łokciowego: U1-nadgarstek, U2-4 cm nad nadgarstkiem, U3-punkt odchodzący od tętnicy łokciowej, U4-wzdłuż brzucha mięśnia zginacza nadgarstka, U5-wylot tunelu łokciowego, U6 – wewnątrz tunelu łokciowego, U7-wlot tunelu łokciowego, U8-4 cm proksymalnie do wlotu tunelu łokciowego, U9-8 cm proksymalnie do wlotu tunelu łokciowego, U10-Łach. CSA, obszar przekrojowy; MMN, wieloogniskowa neuropatia ruchowa.
korelacja wyników maxCSA i Medical Research Council Sum Score (MRC)
u 12 pacjentów z MMN, łącznie uwzględniono 23 nerwy środkowe i 23 nerwy łokciowe, ponieważ jeden z pacjentów z MMN został amputowany z powodu urazu przy pracy. Trend pomiędzy maksymalnym CSA nerwu a odpowiadającą mu siłą mięśni jest podzielony na następujące dwa typy (rycina 2): (1) zwiększenie CSA i zmniejszenie MRC. (2) CSA wzrosła i MRC nie wykazały oczywistych zmian.
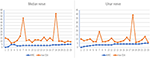
Rysunek 2. Korelacja między nerwem maxCSA i MRC. Trend między maksymalnym obszarem przekroju nerwu (Csa) nerwu a odpowiednią siłą mięśni. Abscissa wskazuje na 23 nerwy obustronne u 12 pacjentów, z których jeden nie był w stanie zarejestrować nerwu bocznego z powodu amputacji; ordinate reprezentuje pole przekroju nerwu (mm2) lub siłę mięśniową. MRC, Medical Research Council Sum Score; maxCSA, maksymalny obszar przekroju pewnego nerwu.
korelacja CSA i CB
z NCSs silnika, 12 określonych CB i 12 prawdopodobnych obszarów CB wykryto w standardowych segmentach nerwów środkowych i łokciowych. W badaniach ultrasonograficznych stwierdzono zwiększenie CSA w 36 miejscach, usuwając segmenty, które były podatne na prasowanie. W nerwie środkowym mediana (P25, P75) maksymalnego CSA standardowego segmentu wynosiła 10,3 (8-12) mm2 dla osób bez CB i 21,22 (8,5, 38) mm2 dla osób z CB (Z = 1,409,P = 0,159). W nerwie łokciowym mediana (P25, P75) maksymalnego CSA standardowego odcinka nerwu wynosiła 7,7 (5 .8,7) mm2 dla osób bez CB i 6,25 (5,8.25) mm2 dla osób z CB (z = 0,744, P = 0,457).
było 9 standardowych segmentów z CB i zwiększonym CSA (Rysunek 3, Wideo 1), 15 segmentów z CB, ale normalnym CSA (Rysunek 4, Wideo 2) i 27 segmentów ze zwiększonym CSA, ale bez CB (Rysunek 5, wideo 3). Technikę inchingu i kolejne skanowanie za pomocą ultradźwięków przeprowadzono w pięciu segmentach, z których bloki przewodzenia nie zostały potwierdzone przez standardowe wykrywanie segmentów z częściowym blokiem przewodzenia. Łącząc techniki inchingu i ultradźwięki, kolejne dwa segmenty wykazały CBs i zwiększony CSA w tych samych miejscach, a 3 segmenty wykazały CBS, ale normalny Csa w tych samych miejscach.
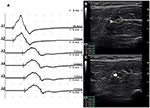
Rysunek 3. Tryb 1. 28-letni mężczyzna z 4-letnim postępującym asymetrycznym osłabieniem obustronnych dłoni. Badanie wykazało unerwienie mięśni nerwu łokciowego dłoni (stopień MRC prawy 3, Lewy 4). Technika inchingu zastosowana w lewym odcinku przedramienia nerwu łokciowego wykazała blok przewodzenia i powiększenie CSA w tym samym miejscu u jednego pacjenta z MMN. (A) Blok przewodzenia wykryto między A1 (opóźnienie 4,9 ms, Czas trwania 8,2 ms, Amplituda 14,8 mv, obszar 38,2 mvms, prędkość przewodzenia 66,6 m/s) i A2 (opóźnienie 5,2 ms, Czas trwania 8,2 ms, Amplituda 9,5 mv, obszar 26,1 mvms, prędkość przewodzenia 11,6 m/s). B) biała strzałka wykazała, że CSA A1 wynosi 8 mm2. (C) strzałka pokazuje, że CSA A2 wynosił 19 mm2 (A1, łokieć-6 cm; A2, łokieć-4 cm; A3, łokieć-2 cm) (wideo 1). CSA, obszar przekroju poprzecznego; CB, blok przewodzenia; l, lewy; r, prawy.
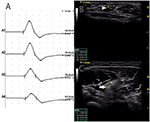
Rysunek 4. Tryb 2. 46-letnia kobieta z 11-letnim postępującym asymetrycznym osłabieniem obustronnych kończyn górnych, z prawą kończyną górną MRC stopnia 3 i lewą 4, wykazała blok przewodzenia i prawidłowy CSA w tym samym miejscu. A) wykryto bloki przewodzenia pomiędzy A1 i A2. (B) Biały grot strzałki wykazał 6 mm2 przy A1 (opóźnienie 2,8 ms, Czas trwania 3,8 ms, Amplituda 12,4 mv, obszar 13,3 mvms, prędkość przewodzenia 50,9 m/s) I (C) strzałka wykazała 8 mm2 przy A2 (opóźnienie 6,8 ms, Czas trwania 3,9 ms, Amplituda 8,2 mv, obszar 7,7 mvms, prędkość przewodzenia 63 m / s) (A1, nadgarstek; A2, łokieć) (Wideo 2). CSA, przekrój; CB, blok przewodzenia; l, lewy; r, prawy.
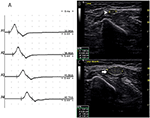
Rysunek 5. Tryb 3. 51-letnia kobieta z 4-letnim osłabieniem lewej kończyny górnej i MRC stopnia 4 wykazała powiększenie CSA bez odpowiedniego bloku przewodzenia. A) badanie przewodnictwa nerwu ruchowego odcinka standardowego lewego nerwu łokciowego. Nie wykryto CB. Badanie ultrasonograficzne nerwu w lewym ramieniu nerwu łokciowego pokazuje: (B)CSA (biały grot strzałki), który był 8 mm2 w miejscu A3 (opóźnienie 8,7 ms, Czas trwania 8,0 ms, Amplituda 8,2 mv, obszar 19,2 mvms, prędkość przewodzenia 48.6 m/s) i (C) Csa (strzałka) miejsca 6 cm bliżej łokcia lewej łokci, które wynosiło 39 mm2 (opóźnienie 12,0 ms, Czas trwania 7,9 ms, Amplituda 8,4 mv, powierzchnia 19,5 mvms, prędkość przewodzenia 18,2 m/s), ale nie wykryto CB w tym samym segmencie (A1, nadgarstek; A2, poniżej łokcia; A3, powyżej łokcia; A4, pachwina) (wideo 3). CSA, obszar przekroju poprzecznego; CB, blok przewodzenia; l, lewy; r, prawy.
dyskusja
badania elektrofizjologiczne odzwierciedlają fizjologiczne cechy nerwu, a badania ultradźwiękowe ujawniają cechy morfologiczne nerwu. MMN jest jednym z idealnych modeli do badania korelacji między CB silnika i CSA, dla których tylko nerw ruchowy jest zaangażowany, a CB jest główną cechą elektrofizjologiczną. Chociaż w poprzednich badaniach odnotowano korelację między CB i CSA (5, 6, 9), ograniczone miejsca obserwowano bez ciągłego skanowania nerwów pod ultradźwiękami, a zmiany w MMN były rozprowadzane stochastycznie, a nie zawsze w wcześniej określonych miejscach.
w tym badaniu wykonaliśmy kolejne skanowanie wzdłuż całego nerwu, aby zarejestrować CSA w nieprawidłowych miejscach. Dodatkowo Csa mierzono w 10 wcześniej ustalonych miejscach. W razie potrzeby przeprowadzono technikę inchingu. Chociaż czas trwania choroby w tej grupie pacjentów z MMN był długi i zróżnicowany, co mogło mieć wpływ na właściwości ultradźwiękowe i elektrofizjologiczne, nadal znaleźliśmy trzy tryby zależności między CSA i CB: CB z odpowiadającym powiększeniem Csa nerwu (Tryb 1), CB bez odpowiadającego powiększenia Csa nerwu (Tryb 2) i powiększenie Csa nerwu bez odpowiadającego CB (Tryb 3). W związku z tym CB nie zawsze jest skorelowane ze zwiększonym CSA.
potencjalny mechanizm tych różnych wzorców korelacji między CB i CSA jest nadal niejasny. Co więcej, prawdziwe odpowiadające im objawy patologiczne za rozszerzeniem nerwów nie zostały wyraźnie ujawnione. Hypoechoiczne powiększenie nerwu może odzwierciedlać aktywne zapalenie i cebulki cebulowe, podczas gdy powiększenie nerwu z dodatkowymi hiperechogennymi fascynami/tkanką okołostawową może odzwierciedlać zwyrodnienie aksonalne (10). Oznacza to, że zarówno zmiany w pochwie aksonalnej, jak i mielinowej mogą prowadzić do powiększenia nerwu CSA (11). W odniesieniu do trybu 2 CB bez odpowiedniego rozszerzenia CSA można łatwo zrozumieć. Obecnie MMN jest uważany za immunomediowaną neuropatię ruchową, która jest związana z uszkodzeniem przeciwciał anty-GM1 kanałów na+w węźle Ranviera (12, 13). Teoretycznie, przeciwciała anty-GM1 wyzwalają bezpośrednie i zależne od dopełniacza uszkodzenie aksonów, prowadząc do bloku przewodzenia, podczas gdy nie może być żadnych oczywistych zmian mieliny. Taylor et al. postawiono hipotezę, że atak przeciwciała może być skierowany na składniki mieliny paranodalnej i stwierdzono, że aksonalna zmiana patologiczna MMN przeważała nad patologią mieliny (14). Ponadto, nasze odkrycia związane z prawidłowym CSA i CB w MMN mogą być konsekwencją faktu, że tylko pojedyncze faszyce są powiększone, podczas gdy główny nerw Csa pozostaje nienaruszony (15).
w odniesieniu do trybu 1 (CB ze zwiększonym CSA), w badaniach rezonansu magnetycznego (MRI) (16) i innych badaniach ultrasonograficznych (3) odnotowano zwiększenie CSA w MMN. Nasze odkrycie, że pacjenci z MMN mieli wieloogniskowe powiększenie CSA i blok przewodnictwa w tym samym miejscu wzdłuż nerwu, może sugerować, że w miejscu CB nie tylko były uszkodzone kanały na+ – bramkowane napięciem, ale także niektóre zmiany, takie jak demielinizacja, obrzęk i tworzenie cebuli (6, 17). Tryb ten wskazywał, że CB może być spowodowane przez różne mechanizmy, a MMN może być zespołem. Nie wszystkie przypadki MMN są spowodowane przez przeciwciała anty-GM1 IgM, a inne procesy immunizacji mogą również być zaangażowane w wyniku demielinizacji / remielinizacji i aksonalnych procesów degeneracji / regeneracji.
mechanizm dla trybu 3 wymaga dalszej eksploracji. Powiększenie CSA nerwu bez CB w MMN, a nawet kończyn bez dysfunkcji neurofizjologicznej, stwierdzono również w innych raportach (6, 9, 18). Postawiliśmy hipotezę, że gdy infiltracje zapalne, obrzęk i dysfunkcja kanałów wystąpią w węzłach Ranviera na wczesnym etapie, próg depolaryzacji kanałów jonowych może pozostać w normalnym zakresie, tak że dysfunkcja przesyłania bodźców solnych nie została jeszcze osiągnięta i nie można wykryć CB. U pacjentów z MMN, w przypadku wykrycia zwiększonego CSA bez CB, zmiany morfologiczne nerwu powinny mieć również znaczenie kliniczne. Kolejne skanowanie wzdłuż nerwu i pomiary w większej liczbie miejsc w celu wykrycia zmian morfologicznych mogą zwiększyć czułość diagnostyczną MMN.
podsumowując, istniały trzy wzorce korelacji między CB i CSA, a zmiany elektrofizjologiczne i morfologiczne nie zawsze były spójne w MMN. Badania ultrasonograficzne mogą wykryć więcej zmian wzdłuż nerwu w MMN, nawet bez CB. Połączenie motorycznych NCS i badań ultrasonograficznych może dostarczyć więcej informacji do klinicznej diagnozy MMN.
ograniczenia
to było porównanie pojedynczych parametrów, badanie przekrojowe. Różne czasy trwania choroby u pacjentów z MMN w tym badaniu, oprócz ich różnej wysokości i masy ciała, mogą wpływać na wykrywanie CSA nerwów i prędkości przewodzenia nerwowego. Ponadto zaobserwowaliśmy tylko, czy nerw ruchowy CB przedstawił i czy były związane zmiany w CSAs na USG; potencjalne mechanizmy różnych wzorców korelacji między CB i CSA wymagają dalszych badań. W badaniu tym uwzględniono tylko CSA, najważniejszy parametr nerwu, więc w celu przeprowadzenia bardziej precyzyjnych badań należy zaangażować więcej wskaźników, takich jak intensywność ECHA.
data Availability Statement
wszelkie dane nie opublikowane w artykule są dostępne i będą udostępniane na żądanie dowolnego wykwalifikowanego badacza.
Deklaracja Etyki
Komisja Etyki szpitala Peking Union Medical College zatwierdziła nasz protokół badania, a wszyscy pacjenci podpisali formularz świadomej zgody zgodnie z deklaracją Helsińską.
wkład autora
: badania elektrofizjologiczne i ultrasonograficzne, pozyskiwanie danych, Analiza statystyczna, pisanie manuskryptów. JN: badania elektrofizjologiczne i ultrasonograficzne oraz analiza statystyczna. LC: koncepcja i projekt badania oraz edycja rękopisu. TL: gromadzenie danych i edycja rękopisu. QD: badania elektrofizjologiczne i ultrasonograficzne. SW i YG: badania elektrofizjologiczne. ML: koncepcja i projekt badania, przegląd danych, edycja rękopisu i krytyczna rewizja.
ML otrzymało wsparcie z Beijing Capital Special Fund (Z171100001017220).
pozostali autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
z wdzięcznością potwierdzamy finansowanie z Beijing Capital Special Fund (Z171100001017220).
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć w Internecie pod adresem: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Video 1. Tryb 1: Blok przewodzenia i rozszerzenie CSA w tym samym miejscu w MMN.
Video 2. Tryb 2: Blok przewodzenia i normalny CSA w tym samym miejscu w MMN.
wideo 3. Tryb 3: Rozszerzenie CSA bez odpowiedniego bloku przewodzenia.
skróty
MMN, wieloogniskowa neuropatia ruchowa; CB, blok przewodzenia nerwów ruchowych; Csa, obszar przekroju poprzecznego; NCS, badania przewodzenia nerwów ruchowych.
1. Parry GJ, Clarke S. wieloogniskowa nabyta neuropatia demielinizacyjna maskaradująca się jako choroba neuronu ruchowego. Nerw Mięśniowy. (1988) 11:103–7. doi: 10.1002 / mus.880110203
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
2. Grimm a, Rattay TW, Winter N, Axer H. Peripheral nerve ultrasound scoring systems: benchmarking and comparative analysis. J Neurol. (2017) 264:243–53. doi: 10.1007 / s00415-016-8305-y
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
3. Rattay TW, Winter N, Decard BF, Dammeier NM, Hartig F, Ceanga m, et al. USG nerwów jako narzędzie kontrolne w leczonej wieloogniskowej neuropatii ruchowej. Eur J Neurol. (2017) 24:1125–34. doi: 10.1111 / ene.13344
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
4. Loewenbruck KF, Liesenberg J, Dittrich m, Schafer J, Patzner B, Trausch B, et al. USG nerwów w różnicowaniu wieloogniskowej neuropatii ruchowej (MMN) i stwardnienia zanikowego bocznego z dominującą chorobą dolnego neuronu ruchowego (ALS / LMND). J Neurol. (2016) 263:35–44. doi: 10.1007 / s00415-015-7927-9
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
5. Kerasnoudis a, Pitarokoili K, Behrendt V, Gold R, Yoon ms. wieloogniskowa neuropatia ruchowa: korelacja wyników USG nerwów, elektrofizjologicznych i klinicznych. J Peryferia Nerv Syst. (2014) 19:165–74. doi: 10.1111 / jns5.12067
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. Ultrasonografia pokazuje rozległe powiększenie nerwów w wieloogniskowej neuropatii ruchowej. Neurologia. (2005) 65:305–7. doi: 10.1212 / 01.wnl.0000169179.67764.30
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. Consensus criteria for the diagnosis of multifocal motor neuropathy. Nerw Mięśniowy. (2003) 27:117–21. doi: 10.1002 / mus.10317
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
8. Niu J, Cui l, Liu M. USG wieloczłonowe nerwów obwodowych w różnicowaniu Charcota-marie-tooth typu 1A od przewlekłej zapalnej demielinizacyjnej poliradikuloneuropatii. Przedni Neurol. (2017) 8:181. doi: 10.3389/fneur.2017.00181
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
9. Pitarokoili K, Gold R, Yoon MS. USG nerwów w przypadku wieloogniskowej neuropatii ruchowej bez bloku przewodzenia. Nerw Mięśniowy. (2015) 52:294–9. doi: 10.1002 / mus.24583
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
10. Hartig F, Ross m, Dammeier NM, Fedtke N, Heiling B, Axer h, et al. Ultrasonografia nerwów przewiduje odpowiedź na leczenie w przewlekłej zapalnej demielinizacyjnej poliradikuloneuropatii-prospektywna obserwacja. Neuroterapeutyki. (2018) 15:439–51. doi: 10.1007 / s13311-018-0609-4
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
11. Tsukamoto H, Granata G, Coraci D, Paolasso I, Padwa L. USG i korelacja neurofizjologiczna w wspólnym bloku przewodzenia nerwu strzałkowego w głowie strzałkowej. Clin Neurofizjol. (2014) 125:1491–5. doi: 10.1016 / j.clinph.2013.11.041
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
12. Harschnitz O, Jongbloed BA, Franssen H, Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: zmiany patologiczne w miejscu bloku przewodzenia. J Neuropathol Exp Neurol. (2004) 63:129–37. doi: 10.1093/jnen / 63.2.129
PubMed Abstract / CrossRef Full Text / Google Scholar
15. Grimm A, Winter N, Rattay TW, Hartig F, Dammeier NM, Auffenberg e, et al. Spojrzenie do wnętrza nerwu-Morfologia fascynatów nerwowych u zdrowych kontrolerów i pacjentów z polineuropatią. Clin Neurofizjol. (2017) 128:2521–6. doi: 10.1016 / j.clinph.2017.08.022
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
16. Haakma w, Jongbloed BA, Froeling m, Goedee HS, Bos C, Leemans A, et al. MRI wykazuje pogrubienie i zmianę dyfuzji nerwów środkowych i łokciowych w wieloogniskowej neuropatii ruchowej. Eur Radiol. (2017) 27:2216–24. doi: 10.1007 / s00330-016-4575-0
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
17. Kaji r, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I i in. Zmiany patologiczne w miejscu bloku przewodzenia w wieloogniskowej neuropatii ruchowej. Ann Neurol. (1993) 33:152–8. doi: 10.1002 / ana.410330204
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
18. Gallardo E, Noto Y, Simon ng. USG w diagnostyce neuropatii obwodowej: struktura spełnia funkcję w klinice nerwowo-mięśniowej. J Neurol Neurochirurg Psychiatria. (2015) 86:1066–74. doi: 10.1136 / jnnp-2014-309599
PubMed Abstrakt / CrossRef Pełny tekst / Google Scholar