Frontiers in Psychology
wprowadzenie
badania preferencji kolorystycznych dzieci mają długą historię. Praktycznie wszystkie z nich badały typowo rozwijające się dzieci (TD). Pionierskie badania dotyczące tej kwestii (Bornstein, 1975; Zentner, 2001), jak również stosunkowo niedawne (ale najbardziej znane) badanie (Franklin et al., 2008a) poinformował, że chłopcy i dziewczęta w wieku przedszkolnym wolą czerwień od wszystkich innych kolorów. Podobne preferencje dla czerwonego odnotowano dla niemowląt (Franklin et al., 2010). Chociaż inne badania przedstawiły dowody na preferowanie niebieskiego u noworodków(Teller et al., 2005; Zemach et al., 2007), z pewnością istnieje ogólna zgoda, że dzieci TD preferują kolory podstawowe (takie jak czerwony i niebieski), a nie Kolory wtórne (takie jak różowy i pomarańczowy). Jako możliwe znaczenie funkcjonalne takiej preferencji kolorystycznej, ponadto potrzeba rozróżniania subtelnych zmian koloru skóry innych osób ze względu na ich stany emocjonalne (np., wściekła twarz jest czerwonawa, a smutna twarz jest niebieska)argumentowano (Changizi et al., 2006). Takie rozumowanie najwyraźniej zakłada, że preferencja dzieci TD dla kolorów podstawowych jest predyspozycyjna.
dotyczące dzieci z zaburzeniami ze spektrum autyzmu (ASD), zaburzeń neurorozwojowych z niezwykłym przetwarzaniem sensorycznym, niektóre anegdotyczne dowody od rodziców, opiekunów, nauczycieli osób z ASD i osób z ASD same sugerują, że dzieci z tym zaburzeniem mogą postrzegać kolor inaczej niż dzieci TD (Franklin et al., 2008b). Zwłaszcza obsesja koloru na punkcie zieleni została obficie udokumentowana (Higashida, 2013; Silberman, 2015; Masataka, w prasie). W jednym przypadku, na przykład, 11-letni chłopiec z ASD nadal używał zielonej słomki w celu stymulowania przez ponad 3 lata (Silberman, 2015). Pozornie dziwne postrzeganie kolorów odnotowano również w badaniach eksperymentalnych z dziećmi z ASD. Na przykład, Brian et al. (2003) nieoczekiwanie znalazł ułatwiający efekt przez kolorowe bodźce podczas badania mechanizmów hamujących u uczestników z ASD, podczas gdy taki efekt nie był obserwowany w kontrolach neurotypicznych. Autorzy argumentowali, że w ASD ” cechy stymulujące, takie jak kolor, mogą być zbyt łatwo zakodowane, a tym samym łatwiej wykrywane niż zwykle.”Następnie stwierdzono podobny efekt w odniesieniu do zadania cueing, w którym nieprawidłowe wskazówki dotyczące kolorów skutkowały większymi kosztami dla uczestników z ASD niż dla neurotypicznych kontroli (Greenway and Plaisted, 2005). Badania te konsekwentnie wykazały zwiększenie wydajności zadań przez kolorowe materiały u tych dzieci.
inne badania (Ludlow et al., 2006, 2008, 2012) stwierdzono, w warunkach klinicznych, percepcyjne korzyści z zastosowania kolorowych filtrów u dużej części osób z ASD. Nakładki zostały zaprojektowane tak, aby systematycznie i kompleksowo próbkować chromatyczność, tak aby jeśli był jakikolwiek kolor, który był korzystny, dostępna była nakładka lub kombinacja nakładek zapewniająca bliskie zbliżenie do tego koloru. Inne badanie, z drugiej strony, próbowano porównać kategoryczne postrzeganie koloru między dziećmi z ASD i td dzieci(Franklin et al., 2008b) i poinformował, że siła kategorycznego postrzegania koloru nie różni się między dziećmi ASD i TD.
łącznie powyższe ustalenia doprowadziły nas do hipotezy, że podczas gdy podstawowy mechanizm leżący u podstaw percepcyjnej kategoryzacji kolorów nie różniłby się między osobami z ASD i bez ASD, zwiększona wrażliwość na stymulację sensoryczną w ogóle, która jest charakterystyczna dla ASD (Markram and Markram, 2010), wpłynęłaby na postrzeganie kolorów wykazywane przez osoby z tym zaburzeniem, co spowodowałoby awersję do pewnych określonych kolorów, które są zwykle preferowane przez osoby neurotypiczne. Obecne badanie zostało zaprojektowane w celu zbadania tej możliwości, przy użyciu tych samych bodźców, co w poprzedniej pionierskiej pracy, przy założeniu, że dzieci z ASD mają percepcyjne kategorie kolorów równoważne z tymi u dzieci z TD.
materiały i metody
to dochodzenie zostało przeprowadzone zgodnie z zasadami wyrażonymi w deklaracji Helsińskiej. Wszystkie protokoły eksperymentalne były zgodne z przewodnikiem dla eksperymentów z ludźmi i zostały zatwierdzone przez Institutional Ethics Committee, Prymasowskiego Instytutu Badawczego, Kyoto University (#2011-150). Autorzy uzyskali pisemną świadomą zgodę rodziców wszystkich uczestników biorących udział w badaniu.
uczestnicy
w obecnym badaniu badano grupę 29 dzieci z ASD w wieku od 4 do 17 lat (M = 8, 8; SD = 3, 0) i 38 dzieci z TD w wieku od 4 do 17 lat (M = 9, 8; SD = 4, 0). Wszyscy byli mężczyznami. Nie było znaczącej różnicy między średnim wiekiem każdej grupy uczestników . Wszyscy uczestnicy byli Francuzami, praworęczni, naiwni co do celu tego badania i mieli normalne lub skorygowane do normalnego widzenie. Nie mieli trudności z wyczuwaniem koloru.
do obecnego badania zrekrutowano 29 dzieci z ASD. Opierając się na bezpośredniej obserwacji klinicznej każdego dziecka przez niezależnego psychiatrę dziecięcego, diagnozę autyzmu postawiono zgodnie z ICD-10 (Światowa Organizacja Zdrowia, 1994) oraz DSM-IV (Amerykańskie Towarzystwo Psychiatryczne, 1994). Na podstawie tych kryteriów każdy uczestnik w grupie dzieci z ASD zdiagnozowano jako F84.0, F84.9 lub F84.8. Co więcej, takie diagnozy zostały również potwierdzone przez wywiad diagnostyczny autyzmu-poprawiony (ADI-R), obszerny, częściowo ustrukturyzowany Wywiad rodzicielski (Lord et al., 1994), którą prowadził niezależny psychiatra. Adi – r dostarcza informacji o obecności werbalnych umiejętności językowych, definiowanych jako codzienne, funkcjonalne i wszechstronne użycie spontanicznych zwrotów co najmniej trzech słów i czasami czasownika. Stwierdzono, że wszystkie dzieci biorące udział w ASD wyrażają język werbalny. Wszystkie dzieci TD zostały zrekrutowane przez Radę edukacji w małym mieście we Francji. Wszyscy uczęszczali na normalne zajęcia odpowiadające ich poziomowi wieku chronologicznego. Żaden z uczestników należących do grup dzieci TD nie spełnił żadnego kryterium diagnostycznego autyzmu ani innych wszechobecnych zaburzeń rozwojowych.
w celu zbadania możliwej rozwojowej zmiany preferencji kolorystycznych, każde z dzieci z ASD i dzieci z TD zostało sklasyfikowane w jednej z trzech grup wiekowych: jedna grupa wiekowa składała się z dzieci w wieku od 4 do 7 lat (9 dzieci z ASD i 13 dzieci z TD), jedna grupa składała się z dzieci w wieku od 8 do 10 lat (9 dzieci z ASD i 17 dzieci z TD), a pozostała grupa składała się z dzieci w wieku od 11 do 17 lat (11 dzieci z ASD i 8 dzieci z TD). Biorąc pod uwagę, że założenia ANOVA (analiza wariancji) są z pewnością spełnione, taki podział całej grupy uczestników powinien być spójny, aby zbadać możliwe zmiany w perspektywie rozwojowej.
procedura
materiały użyte w obecnym badaniu składały się z sześciu prostokątów tekturowych o wymiarach 35 cm × 50 cm w kolorze czerwonym, żółtym, różowym, niebieskim, zielonym lub brązowym. Były one zasadniczo takie same jak materiały użyte w poprzednim badaniu (Zentner, 2001), abyśmy mogli porównać nasze wyniki uzyskane tutaj z wynikami tam zgłoszonymi. Barwa, luminancja i chroma każdego bodźca kolorowego, który został określony zgodnie z systemem notacji kolorów Munsella, były następujące: czerwony, 7,5 R, 4, 14; żółty, 10Y, 8,5, 12; Różowy, 7,5 PR, 6, 10; zielony, 2,5 G, 3, 8; niebieski, 10B, 7, 8; brązowy, 10r, 3, 10.
protokół testów był również taki sam jak w poprzednim badaniu (Zentner, 2001). Uczestnicy byli testowani indywidualnie w cichym pomieszczeniu w warunkach dziennych. Wszystkie z sześciu kartonów zostały przedstawione uczestnikowi, który siedział na krześle i poprosił o wybór koloru, który mu się podobał. Ich rangę preferencji wśród kartonów mierzono metodą porównywania par wymuszonego wyboru. Za każdym razem uczestnik wybierał kolor, rejestrowano preferencje dla tego koloru. Do celów analizy statystycznej wynik preferencji obliczono dla koloru, odejmując jego rangę preferencji od liczby koloru bodźca (6).
wyniki
ogólne wyniki eksperymentu są podsumowane na fig.1, który pokazuje ogólną średnią rangę sześciu kolorów w grupie dzieci TD i dzieci ASD. Gdy zebrane dane analizowano przy użyciu ANOVA 2 (ASD/TD, uczestnik) × 3 (grupy wiekowe, wiek) dla każdego z sześciu kolorów, Jeden z dwóch głównych efektów (uczestnik) był statystycznie istotny dla żółtego, F(1,61) = 49,60, p = 0.000, np2 = 0,284, a Dla Zielonego, F(1,61) = 5,03, p = 0,029, np2 = 0,114. Inny główny efekt (wiek) nie był znaczący ani dla żółtego, F (2,61) = 0,84, p = 0,44, np2 = 0,028, ani dla zielonego, F(2,61) = 1,50, p = 0,23, NP2 = 0,53. Interakcja pomiędzy uczestnikiem a wiekiem nie była istotna dla żółtego, F(2,61) = 0,25, p = 0,78, np2 = 0,08, ani dla zielonego, f(2,61) = 0,28, p = 0,76, np2 = 0,09.
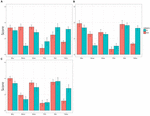
RYSUNEK 1. Średnie wyniki preferencji (paski błędów: SDs) sześciu kolorów u dzieci z zaburzeniami ze spektrum autyzmu (ASD) i u dzieci typowo rozwijających się (TD). A) w wieku od 4 do 7 lat, B) w wieku od 8 do 10 lat oraz C) w wieku od 11 do 17 lat.
dla koloru brązowego zarówno główny efekt, uczestnik, jak i interakcja między uczestnikiem a wiekiem były znaczące, F(1,61) = 33,06, p = 0,0000, NP2 = 0,35 dla uczestnika i F(2,61) = 4,11, p = 0,021, np2 = 0,119 dla uczestnika × wiek. Jednak inny główny efekt nie był znaczący, F(1,61) = 1,89, p = 0,16, np2 = 0,062. Późniejsze analizy prostych efektów głównych (korekcja Bonferroniego) wykazały, że średnia ranga preferencji dla Browna była mniejsza u dzieci w wieku od 11 do 17 lat z ASD niż u dzieci w wieku od 4 do 7 lat z ASD, p = 0,001, a także u dzieci w wieku od 8 do 10 lat z ASD, p = 0,03. Średnia ranga preferencji u dzieci w wieku od 4 do 7 lat z ASD nie różniła się od rangi u dzieci w wieku od 11 do 17 lat z ASD, p = 0,31.
natomiast żaden z dwóch głównych efektów ani interakcja między nimi nie były istotne dla czerwieni, F(1,61) = 0,70, p = 0,41, np2 = 0.012 dla uczestnika, F(2,61) = 1,77, p = 0,18, np2 = 0,068 dla wieku, F(2,61) = 0,98, p = 0,38, np2 = 0,081 dla uczestnika × wiek, Dla niebieskiego, F(1,61) = 3,39, p = 0,08, np2 = 0,046 dla uczestnika, F(2,61) = 1,25, p = 0,29, NP2 = 0,040 dla wieku, f(2,61) = 0,09, P = 0,91, NP2 = 0,003 dla uczestnika × wiek, a dla różowego, f(1,61) = 1,90, p = 0,17, NP2 = 0,028 dla uczestnika, f(2,61) = 0,51, P = 0,61, NP2 = 0,040 dla wieku, f(2,61) = 0,41, P = 0,66, NP2 = 0,003 dla uczestnika × wiek.
dyskusja
w odniesieniu do dzieci z TD, wyniki obecnego badania są zgodne z tymi zgłoszonymi wcześniej(Zentner, 2001; Franklin et al., 2010). Czerwony był najbardziej preferowanym kolorem. Niebieski był blisko niego, a następnie żółty. Najmniej preferowanym kolorem był brąz. Jak donoszono w niedawnym badaniu, różu unikali również chłopcy (LoBue and DeLoache, 2011). Takie wyniki potwierdzono również u dzieci z ASD. Jednak ich wynik preferencji dla żółtego był niski, a Dla zielonego i brązowego był odwrotnie wyższy.
ponieważ przedstawione tu kategorie kolorów były ograniczone, wydaje się, że trudno wyciągnąć z nich jednoznaczny wniosek. Biorąc pod uwagę stosunkowo niewielką wielkość próby w każdej z trzech grup wiekowych, brak jakichkolwiek różnic w wynikach preferencji między dziećmi z TD A dziećmi z ASD w odniesieniu do czerwonego, niebieskiego i różowego można przypisać efektowi sufitu/podłogi. Poza tym problemem należy jednak zauważyć, że dzieci z ASD z pewnością unikały żółtego, a odwrotnie-faworyzowały zielony i brązowy. Te odkrycia są z pewnością te przewidywane przez naszą hipotezę przedstawioną powyżej. Co więcej, ich preferencja dla zieleni jest zgodna z anegdotycznymi dowodami, które zostały zgłoszone do tej pory (Higashida, 2013; Silberman, 2015; Masataka, w prasie).
aby wyjaśnić te wyniki, nie należy pomijać faktu, że kolor żółty miał najwyższą wartość luminancji wśród badanych kolorów. Obserwowana niechęć do tego koloru może odzwierciedlać nadmierną wrażliwość dzieci z ASD na luminancję. Istnieje również ogólna zgoda, że żółty jest najbardziej męczącym kolorem (Kernell, 2016). Powszechnie wiadomo, że nasze oczy są wyposażone w trzy różne typy komórek stożka do percepcji kolorów, L, M I S, które odpowiadają percepcji odpowiednio czerwonego, zielonego i niebieskiego światła. Jednak w przypadku postrzegania żółtego muszą być zaangażowane zarówno L, jak i M. Percepcja żółci powinna być zatem najbardziej obciążona zmysłowo percepcją każdego rodzaju koloru. Jego percepcja jest znośna dla dzieci TD, ale może być nadmiernie obciążona dla dzieci z ASD, których wrażliwość na stymulację sensoryczną jest zwiększona.
często donosi się, że dzieci z ASD są bardzo wrażliwe na dotykowe, słuchowe i wzrokowe. W dziedzinie słuchowej wykazują one zwiększoną dyskryminację między bodźcami słuchowymi, dokładniejsze wykrywanie lokalnych docelowych bodźców słuchowych i zmniejszoną globalną ingerencję w przetwarzanie słuchowe (Takahashi et al., 2014). W dziedzinie wizualnej wykazują one zwiększone możliwości wizualnej dyskryminacji, szybsze wykrywanie celów w wyszukiwaniu funkcji i spojówek wizualnych, dokładniejsze wykrywanie celów lokalnych itp. (Markram and Markram, 2010). Obecne badania sugerują możliwość, że takie zjawisko występuje również w dziedzinie percepcji kolorów. Kolor żółty jako bodziec sensoryczny, który jest normalny dla dzieci TD, może być trudny do zniesienia dla dzieci z ASD.
Ostatnio hiper-sensacja, jak również hiper-Uwaga charakterystyczna dla ASD została neurologicznie wyjaśniona pod względem podstawowej underconectivity neuronalnej wśród obszarów korowych w tym zaburzeniu (Just et al., 2004), które mogą negatywnie wpłynąć lub spowolnić integrację lub komunikację między regionami korowymi zaangażowanymi w Przetwarzanie obrazów wizualnych, a także język. To Wyjaśnienie przypisuje wiele powszechnych nieprawidłowości w funkcjonowaniu psychologicznym w ASD do upośledzenia koordynacji i komunikacji między kluczowymi ośrodkami przetwarzania mózgu. Jednym z głównych przewidywań opartych na tym wyjaśnieniu jest to, że każdy aspekt funkcji psychologicznych i neurologicznych zależny od koordynacji lub integracji regionów mózgu jest podatny na zakłócenia w ASD. Neurologicznie, ogólnie przyjęty podstawowy rachunek przetwarzania kolorów utrzymuje, że widzenie kolorów rozpoczyna się w siatkówce, że następnie komórki parwokomórkowe i koniokomórkowe w bocznym jądrze genikulacyjnym kodują chromatyczność, a komórki magnokomórkowe luminancję, zapewniając różne ścieżki do kory wzrokowej, w której znajdują się różne neurony selektywne kolorystycznie (Kernell, 2016). Wzór wyników w obecnym badaniu może wynikać z zakłócenia jednego lub więcej z tych różnych procesów biologicznych i neurologicznych. Aby to zbadać, potrzebne są dalsze badania.
osoba, która cierpi na przeciążenie sensoryczne, naturalnie uniknie tak silnego bodźca, jak awersja. Takie unikanie może przejawiać się jako obserwowana atypowa preferencja kolorów w obecnym badaniu. Fakt, że silne unikanie brązowego obserwowano tylko u dzieci z ASD poniżej 11 lat, może sugerować możliwość, że nadmierna wrażliwość jest najbardziej intensywna w tym okresie rozwojowym w tym zaburzeniu. Najwyraźniej jest to również kwestia, którą należy zbadać w najbliższej przyszłości.
autorzy
MG zebrał dane. NM przeanalizował dane i sporządził rękopis. Obie przeczytały projekt i zatwierdziły go.
finansowanie
badanie zostało wsparte dotacją (JSPS”25285201).
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autorzy są wdzięczni Ronanowi Jubinowi i Nathalie Lavenne-Collot za pomoc w rekrutacji, Mayuko Iriguchi i Hiroki Koda za pomoc w przeprowadzeniu eksperymentu oraz Elizabeth Nakajima za korektę angielskiego rękopisu.
American Psychiatric Association (1994). Podręcznik diagnostyczno-Statystyczny zaburzeń psychicznych. Washington, DC: American Psychiatric Association, 1-609.
Google Scholar
Bornstein, M. H. (1975). Cechy widzenia kolorów w niemowlęctwie. J. Exp. Psychol Dziecięcy. 19, 401–419. doi: 10.1016/0022-0965(75)90070-3
CrossRef Pełny tekst / Google Scholar
Brian, J. A., Tipper, S. P., Weaver, B., and Bryson, S. E. (2003). Mechanizmy hamujące w zaburzeniach ze spektrum autyzmu: typowe selektywne hamowanie lokalizacji w porównaniu z ułatwionym przetwarzaniem percepcyjnym. Psychol Dziecięcy J. Psychiatria 44, 552-560. doi: 10.1111/1469-7610.00144
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Changizi, M. A., Zhang, Q., and Shimojo, S. (2006). Naga skóra, krew i ewolucja widzenia barw naczelnych. Biol. Lett. 2, 217–221. doi: 10.1098 / rsbl.2006.0440
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Franklin, A., Bevis, L., Ling, Y., and Hurbert, A. (2010). Biologiczne składniki preferencji kolorów w niemowlęctwie. Dev. Sci. 21, 346–354. doi: 10.1111 / j.1467-7687.2009.00884.x
PubMed Streszczenie / CrossRef Pełny tekst
Franklin, A., Pitchford, N., Hart, L., Davies, I. R., Clausse, S., and Jenings, S. (2008a). Wyrazistość koloru pierwotnego i wtórnego w okresie niemowlęcym. Br. J. Dev. Psychol. 26, 471–483. doi: 10.1348 | 026151007×256672
CrossRef Pełny tekst / Google Scholar
Franklin, A., Snowdon, P., Burley, R., Notman, L., and Alder, E.(2008b). Percepcja kolorów u dzieci z autyzmem. J. Autyzm Dev. Disord. 18, 1837–1847. doi: 10.1007 / s10803-008-0574-6
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Greenway, R., and Plaisted, K. (2005). Modulacja uwagi odgórnej w zaburzeniach ze spektrum autystycznego jest specyficzna dla bodźców. Psychol. Sci. 16, 987–994. doi: 10.1111 / j.1467-9280.2005.01648.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Higashida, N. (2013). Powód, dla którego skaczę: wewnętrzny głos trzynastoletniego chłopca z autyzmem. Nowy Jork, NY: Random House, 1-129.
Just, M. A., Cherkassky, V. L., Keller, T. A., and Minshew, N. J. (2004). Aktywacja korowa, synchronizacja podczas rozumienia zdań w autyzmie o wysokiej funkcjonalności: dowody underconnectivity. Brain 127, 1811-1821. doi: 10.1093/brain / awh199
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Kernell, D. (2016). Kolor i widzenie barw: ankieta wprowadzająca. Cambridge: Cambridge University Press, 1-345.
Google Scholar
LoBue, V., and DeLoache, J. (2011). Pretty in pink: the early development of gender-stereotyped colour preferences. Br. J. Dev. Pszychol. 29, 656–667. doi: 10.1111 / j. 2044-835X. 2011. 02027.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Lord, C., Rutter, M., i Le Couteur, A. (1994). Wywiad diagnostyczny autyzmu-poprawiony: poprawiona wersja wywiadu diagnostycznego dla opiekunów osób z możliwymi wszechobecnymi zaburzeniami rozwojowymi. J. Autyzm Dev. Disord. 24, 659–685. doi: 10.1007 / BF02172145
PubMed Abstract / CrossRef Full Text / Google Scholar
Ludlow, A. K., Taylor-Whiffen, E., and Wilkins, A. J. (2008). Kolorowe nakładki zwiększają wydajność percepcji wzrokowej u dzieci ze spektrum autyzmu. Res. Autyzm Spectr. Disord. 2, 498–515. doi: 10.1016 / j.rasd.2007.10.001
CrossRef Pełny tekst / Google Scholar
Ludlow, A. K., Taylor-Whiffen, E., and Wilkins, A. J. (2012). Kolorowe filtry wzmacniają wizualne postrzeganie sygnałów społecznych u dzieci ze spektrum autyzmu. Isrn Neurol. 2012: 298098. doi: 10.5402/2012/298098
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Ludlow, A. K., Wilkins, A. J., and Heaton, P. (2006). Wpływ kolorowych nakładek na zdolność czytania u dzieci z autyzmem. J. Autyzm Dev. Disord. 36, 507–516. doi: 10.1007 / s10803-006-0090-5
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Markram, K., and Markram, H. (2010). Teoria intensywnego świata – jednocząca teoria neurobiologii autyzmu. Przód. Hum. Neurosci. 4:224. doi: 10.3389 / fnhum.2010.00224
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Masataka, N. (w prasie). Implikacje idei neuroróżnorodności dla zrozumienia genezy zaburzeń rozwojowych. Physics Life Rev.
Silberman, S. (2015). NeuroTribes: Dziedzictwo autyzmu i Przyszłość Neuroróżnorodności. New York, NY: Avery, 1-534.
Google Scholar
Takahashi, H., Nakahachi, T., Komatsu, S., Ogino, K., Iida, Y., and Kamio, Y. (2014). Nadmierna reaktywność na słabe bodźce akustyczne i przedłużone opóźnienie startu akustycznego u dzieci z zaburzeniami ze spektrum autyzmu. Mol. “Autyzm” – 5: 23 doi: 10.1186/2040-2392-5-23
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Teller, D. Y., Civan, A., and Bronson-Castain, K. (2005). Spontaniczne preferencje kolorystyczne niemowląt nie wynikają z różnic jasności podobnych do dorosłych. Neurosci Wzrokowe. 21, 397–401. doi: 10.1017 | S0952523804213360
CrossRef Full Text / Google Scholar
Światowej Organizacji Zdrowia (1994). Composite International Diagnostic Interview, Wersja 1.1. Genewa: Światowa Organizacja Zdrowia, 1-632.
Google Scholar
Zemach, I., Chang, S., and Teller, D. Y. (2007). Infant color vision: przewidywanie spontanicznych preferencji kolorystycznych niemowląt. Vision Res. 47, 1368-1381. doi: 10.1016 / j. visres.2006.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar