kanały i transportery jonów chlorkowych: od ciekawostek Natury i źródła chorób ludzkich po cele leków
Posted: 20 August 2013 | |
na początku swojej edukacji licencjackiej student jest wprowadzany do różnych typów integralnych białek błonowych: receptorów, białek adhezyjnych, kanałów jonowych, pomp jonowych i transporterów jonowych. W miarę postępów w swoich badaniach dowiadują się, że dyskretne rodziny genów i struktury białkowe są odpowiedzialne za te różne klasy białek i nigdy nie ma powodu, aby uważać, że może istnieć jakakolwiek niejasność w przypisaniu konkretnego białka do odpowiedniej klasy białek.
to spełnia praktycznie każdy przypadek od klasy do laboratorium badawczego, dopóki nie weźmiemy pod uwagę kanałów chlorkowych. Wiemy, że istnieją, są ważne i mogą być dobrymi celami leków w kilku obszarach chorobowych, ale do niedawna pozostawały nieco napiętnowane i niemodne w świecie terapeutycznym. Brak selektywnych ligandów wcale nie pomógł. Jedynym wyjątkiem od tego był receptor GABA – A, który jest sprzężony z wewnętrznym kanałem chlorkowym, który otwiera się po wiązaniu hamującego neuroprzekaźnika GABA. Benzodiazepiny wzmacniają ten receptor odkąd Valium stało się dostępne w 1960 roku, zapewniając działanie uspokajające i przeciwdrgawkowe. Wprowadza to ważną koncepcję: istnieje kilka rodzin genów i różnych typów białek, które można opisać jako kanały chlorkowe.
jest to w przeciwieństwie do tego, co rozumiemy z kanałów jonowych selektywnych kationowo, gdzie istnieje niewielka elastyczność w strukturze białka, która może tworzyć pory, które są selektywne dla potasu, sodu lub wapnia; różnorodność tych kanałów jonowych jest spowodowana przez różnice w domenach białkowych różniących się od porów, które wpływają na zachowanie otwierania i zamykania. Aby być uczciwym, nie wydaje się być wiele fizjologicznych powodów, dla których kanał anionowy powinien wykazywać selektywność chlorkową, ponieważ istnieje niewielka rola fizjologiczna w transporcie błonowym innych halogenków lub małych anionów; każdy kanał anionowy będzie domyślnie kanałem chlorkowym z fizjologicznego punktu widzenia. Z drugiej strony, potasowe, sodowe i wapniowe prądy błonowe odgrywają różne podstawowe role, a selektywna przepuszczalność błon dla tych kationów ma kluczowe znaczenie dla funkcji komórkowej, a nawet samego życia.
receptory GABA-A należą do rodzin kanałów jonowych bramkowanych pentamerycznym ligandem cys-loop, które obejmują kilka rodzajów kanałów pobudzających i hamujących neuroprzekaźniki. Białko regulatora transmembrany mukowiscydozy (CFTR) jest regulowanym przez nukleotydy kanałem chlorkowym. Należy do zróżnicowanej rodziny transporterów ATP-binding cassette (ABC) i jest jedynym, który wydaje się nie transportować żadnego substratu przez membranę, ale raczej działa jako kanał chlorkowy. Rodzina CLC kanałów chlorkowych bramkowanych napięciowo powstaje z innej odrębnej rodziny genów i ma ogólną strukturę unikalną wśród białek błonowych. Ta rodzina białek przyniosła wiele niespodzianek w ciągu ostatnich 30 lat, a członkowie tej rodziny zostaną tutaj wprowadzeni, a także jak można je uznać za cele narkotykowe.
inne ekscytujące zmiany w dziedzinie kanałów chlorkowych pojawiły się po molekularnej identyfikacji białek leżących u podstaw kanałów chlorku aktywowanego wapniem (ClCa). Funkcjonalnie wiemy o ich roli fizjologicznej od jakiegoś czasu, ale niedawna molekularna identyfikacja białek kanału pozwoliła na opracowanie molekularnych i farmakologicznych narzędzi do badania i zmiany ich aktywności. Przegląd ten koncentruje się na farmakologicznym potencjale ukierunkowania kanałów ClCa i białek CLC; ich funkcję i lokalizację subkomórkową podsumowano na fig.1.
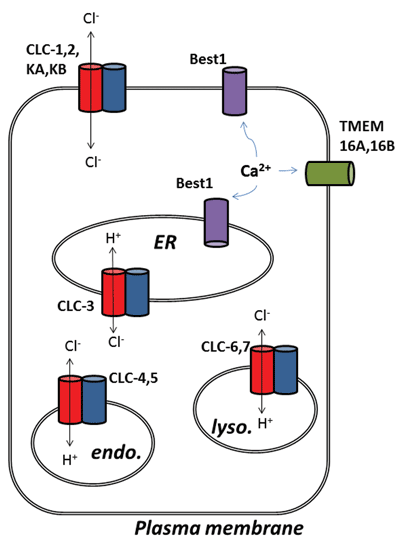
Rysunek 1
wprowadzenie do białek CLC
dziewięć członków tej rodziny białek to CLC-1 do 7, CLC-KA I KB. Członek założyciel, CLC-1, jest bramkowanym napięciem kanałem chlorkowym mięśni szkieletowych i zostanie omówiony poniżej. Przeprowadzono wiele badań funkcjonalnych nad homologiem o honorowym tytule CLC-0, wyizolowanym z elektroplaxowego narządu elektrycznego, który umożliwia promieńowi ogłuszenie jego wodnych ofiar. Odtworzenie CLC-0 w dwuwarstwy lipidowe i elektrofizjologiczne rejestrowanie prądów przepływających przez pojedyncze kanały jonowe ujawniło intrygującą właściwość. Zwykle, rejestrując prąd z niewielkiego fragmentu membrany zawierającego pojedynczy kanał jonowy, obserwuje się wahania pomiędzy dwiema amplitudami prądu: jedną reprezentującą kanał zamknięty, a drugą reprezentującą prąd płynący przez kanał otwarty. Fluktuacje odzwierciedlają przejścia między Stanami kinetycznymi otwartymi i zamkniętymi. W przypadku CLC-0 było jednak oczywiste, że białko pojedynczego kanału jonowego składa się z dwóch równoważnych porów, które mogą otwierać się niezależnie 1. Kanał ten został zatem opisany jako dwukolumnowy (Rys. 2). Nic więc dziwnego, że struktury krystaliczne homologów bakterii jelitowych ujawniły, że kompleks białkowy jest dimerem, przy czym każda podjednostka posiada ścieżkę przewodzącą jon2 (fig.2).
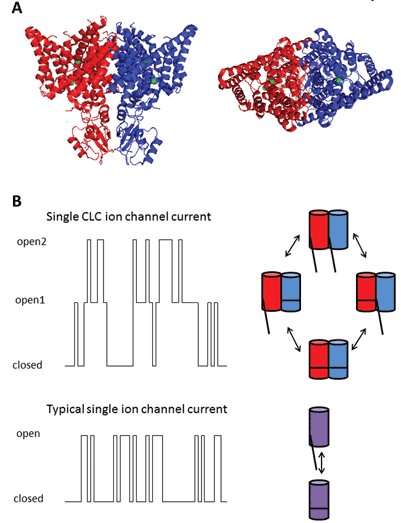
Rysunek 2
drugie zaskoczenie pojawiło się, gdy przeprowadzono szczegółowe eksperymenty funkcjonalne na CLC-ec1 z E. coli. Zamiast działać jako kanał chlorkowy, podobnie jak jego dawno utracony krewny w mięśniach szkieletowych kręgowców, CLC-ec1 jest transporterem wymiany 2CL-/H+, lub antyporterem, ze ścisłą stechiometrią wymiany 2:13. Białko to jest ważne dla przetrwania bakterii jelitowych o niskim pH4 i prawdopodobnie wykorzystuje gradient chlorków, aby utrzymać pH komórkowe na tolerowanym poziomie. Prokariotyczne CLC mogą zatem stanowić cele dla inhibitorów w leczeniu patogennego zakażenia E. coli lub Salmonellą4. Odkrycie zachowania wymiany jonowej w naturalny sposób pobudziło dalsze wysiłki w celu ustalenia, czy którekolwiek z tych przemian chloru na proton istniało w ssaczych CLC, przy założeniu, że wymiana CL-/h+ może być prawdziwą funkcją archetypowych CLC, a te zidentyfikowane jako kanały chlorkowe mogą być tylko wyjątkami od tej reguły. Wydaje się, że tak jest, ponieważ istnieją silne dowody na to, że CLC-3 do CLC-7 działają jako transportery wymiany 2CL–/H+, głównie zamieszkujące wewnątrzkomórkowe organele, podczas gdy CLC-1, CLC-2, KA I KB są prawdziwymi kanałami jonowymi przewodzącymi chlorek błony plazmatycznej5-9. Ponieważ archetypową właściwością CLC jest transport wymiany, znajdowany we wszystkich formach życia komórkowego, ostatnią podklasę białek, bona fide kanały chlorkowe, można zatem uznać za “złamane” transportery chlorkowe, które utraciły sprzężenie transportu chlorkowego z ruchem drugiego jonu substratowego.
CLC-1
ten założyciel rodziny CLC jest bramkowanym napięciem chlorkowym kanałem mięśni szkieletowych i służy do regulacji potencjału błony i repolaryzacji błony po potencjale działania w celu rozluźnienia mięśnia. W większości tkanek można by oczekiwać, że kanały potasowe odegrają tę rolę, co robią w mięśniach sercowych i gładkich, a także regulują pobudliwość błon w innych typach komórek. System kanalików poprzecznych jest przedłużeniem błony plazmatycznej (sarcolemma) i przenika do tkanki kurczliwej. Ma kluczowe znaczenie dla szybkiego rozprzestrzeniania się aktywności elektrycznej w mięśniu i organizuje szybki i kontrolowany skurcz. Wypływ potasu z komórek mięśniowych do zamkniętej przestrzeni kanalika t zwiększyłby zewnątrzkomórkowe stężenie potasu i załamał ten gradient jonów, co prowadziłoby do przedłużonej depolaryzacji błony. Ponieważ kanały chlorkowe odgrywają dominującą rolę repolaryzującą, zapobiega się temu. Utrata mutacji funkcyjnych w CLC-1 prowadzi do miotonii u ludzi, kóz i myszy (do niedawnego przeglądu patrz10) i charakteryzuje się upośledzonym rozluźnieniem mięśni, zgodnym z utratą prądu repolaryzującego błonę.
przy ekspresji ograniczonej do mięśni szkieletowych, CLC-1 może być atrakcyjnym celem dla leków, które kontrolują skurcz mięśni poprzez zwiększenie lub zmniejszenie funkcji CLC-1, a tym samym odpowiednio zmniejszenie lub zwiększenie pobudliwości mięśni. Związki, które zwiększają funkcję CLC – 1, mogą być w stanie leczyć miotonię, szczególnie w przypadkach, gdy mogłyby zrekompensować częściową utratę aktywności kanału chlorkowego. Hamowanie CLC – 1 może zmniejszyć próg skurczu mięśni i może być przydatne w przypadkach osłabienia mięśni lub chorób zwyrodnieniowych, takich jak dystrofia mięśniowa.
CLC-2
kanał chlorkowy rektyfikujący do wewnątrz, CLC-2, ma dość szeroką dystrybucję tkankową. Można go znaleźć w neuronach centralnych, gdzie reguluje aktywność neuronalną11-13. U astrocytów jego subkomórkowe ukierunkowanie na połączenia komórkowe jest regulowane przez interakcję z glejakiem (MLC1), mutacje, w których zaburza to ukierunkowanie i powoduje megalencefaliczną leukoencefalopatię14. Ostatnie zainteresowania terapeutyczne obejmują ekspresję CLC-2 w błonie śluzowej jelit i oskrzelikach płuc, gdzie odgrywa rolę odpowiednio w wydzielinie jelitowej i płucnej. Lubiproston, lek stosowany klinicznie w celu złagodzenia zaparć, został zaproponowany, aby wywierać swój efekt poprzez aktywację CLC-2, ale efekt ten jest kontrowersyjny. Podczas gdy związek ten aktywuje kanały CLC – 2 w niektórych badaniach, w innych reguluje przepływ CLC-2 i zwiększa funkcję CFTR poprzez aktywację receptora prostaglandyny15,16. Istnieją jednak wystarczające dowody na to, że zwiększenie funkcji CLC-2 w drogach oddechowych może stanowić alternatywny szlak chlorkowy w włókniaku torbielowym17.
CLC-KA / KB
te kanały chlorkowe są wyraźnie wyrażone w nabłonku nerkowym i przyczyniają się do przepuszczalności błon komórkowych do biernego strumienia chlorków. Odgrywają one kluczową rolę w wznoszącej się kończynie i kanalikach dystalnych nefronu, zapewniając bazolateralną drogę reabsorpcji chlorków, po transporcie z moczu pierwotnego przez błonę wierzchołkową. Gen CLCKB, kodujący CLC-KB, jest jednym z pięciu genów leżących u podstaw zespołu Barttera. Mutacje utraty funkcji w CLC-KB powodują wadliwą reabsorpcję chlorków, a więc prowadzą do zaburzenia wyniszczenia soli, które jest związane z wielomoczem. Jedną z głównych cech osób dotkniętych mutacjami CLC-KB (Typ III Barttera) jest niskie ciśnienie krwi. Cięższa postać choroby jest spowodowana mutacjami w genie BSND (Typ IV Barttera), który koduje Barttynę, białko dodatkowe ważne dla transportu zarówno CLC-KA, jak i KB do błonnika osocze18. Ta forma zaburzenia obejmuje również głuchotę czuciową, która jest uważana za spowodowaną utratą zarówno CLC-KA, jak i KB do błon nabłonkowych w uchu wewnętrznym. Przypuszczalnie utrata aktywności CLC-KA lub KB, ale nie obu, może być tolerowana przez układ słuchowy. Sugeruje to, że inhibitory selektywne zarówno dla CLC-KA, jak i CLC-KB, lub częściowe hamowanie obu, mogą działać jako nowy diuretyk pętlowy z potencjalnym obniżeniem ciśnienia krwi i niewielkimi skutkami ubocznymi. Doprowadziło to do badań nad ich farmakologią i opracowania nowych pochodnych inhibitorów o niskim mikromolowym powinowactwie 19, które miały działanie moczopędne po podaniu szczurom20. Z drugiej strony leki, które aktywują kanały CLC-KB, mogą zwiększać resztkową aktywność wadliwych kanałów u pacjentów Barttera typu III.
CLC-7
z podklasy transportera wymiany 2CL–/H+, CLC-7 jest obiecującym celem działania leku, a jego hamowanie może być korzystne w osteoporozie. Po raz kolejny wskazanie to bierze swój początek z obserwacji ludzkiej choroby spowodowanej mutacjami powodującymi utratę funkcji w CLC-7, które powodują osteropetrozę21. W tym zaburzeniu dochodzi do niedoboru przebudowy kości przez osteoklasty, co uważa się za spowodowane wadliwym wydzielaniem kwasów i enzymów. Prowadzi to do powstania gęstej kości, która,jeśli zostanie odtworzona przez inhibitor CLC-7, może zmniejszyć rozpuszczanie się kości, a tym samym wzmocnić szkielet pacjentów z osteoporozą22, 23. W badaniach proof-of-concept farmakologiczne hamowanie zakwaszenia24 lub zaburzenie funkcji CLC-7 przez przeciwciała25 zmniejszało resorpcję kości. Hamowanie CLC – 7 nie może jednak przebiegać bez powikłań, ponieważ badania na ludziach i myszach sugerują, że brak funkcji CLC-7 może być również związany z zaburzeniami przechowywania neuronów i degeneracją z powodu zmniejszonej funkcji lizosomalów26.
utrata funkcji mutacje u ludzi-lekcje z CFTR
warto w tym miejscu zrobić krótką przerwę, aby wziąć pod uwagę, że niektóre wskazania terapeutyczne dla nowych leków ukierunkowanych na CLC mają na celu leczenie zaburzeń odrębnych i na przeciwnym końcu spektrum niż te, które są spowodowane wadliwą funkcją CLC. Oprócz tych opisanych powyżej, choroba Denta I jest chorobą nerek związaną z chromosomem X, która jest spowodowana utratą funkcji CLC-5 (patrz najnowszy przegląd 27). Wszystkie są rzadkimi zaburzeniami dziedzicznymi, a poważna wada białka wiąże się albo z obniżoną aktywnością białka, albo z przedostaniem się do błony docelowej. W rzeczywistości wiele pojedynczych mutacji powoduje retencję ER i brak dojrzewania białka. Równoległość może być wykonana z mukowiscydozą, przy czym większość dotkniętych osób posiada mutację er-retained ΔF508. Niedawne i stratyfikowane podejścia do leczenia mukowiscydozy były wynikiem podwójnego ataku w celu skorygowania zmutowanego fałdowania białek (korektory CF) i (lub) zwiększenia aktywności błonowych kanałów chlorkowych CFTR (potencjatory CF). Sukces pojawia się dzięki klasie potencjatorów 28, które są skuteczne u pacjentów z mutacjami zmniejszającymi aktywność CFTR bez utraty biosyntezy białek lub handlu nimi (np. G551D), jednak skuteczność korektorów fałdowych (co jest wymagane w większości przypadków) pozostaje do ustalenia 29. Chociaż choroby związane z utratą funkcji CLC są rzadkimi zaburzeniami genetycznymi, możemy pewnego dnia być w stanie leczyć osoby z miotonią, zespołem Barttera, chorobą Denta i osteopetrozą, a także mukowiscydozą lekami, które korygują rzeczywistą przyczynę ich zaburzenia.
kanały chlorkowe aktywowane wapniem
wreszcie, wzmianka zostanie o kanałach chlorkowych aktywowanych wapniem (ClCa), które mają jasno określone role fizjologiczne w wielu typach komórek, ale ich identyfikacja molekularna Uległa kilku fałszywym i jąkającym się początkom. Historia dotyczy czterech rodzajów białka: członków rodzin genów CLCA, Bestrophin, Tweety i TMEM16. We wszystkich przypadkach ich rekombinowana nadekspresja powodowała wytwarzanie błonowych prądów chlorkowych, które są stymulowane przez podniesienie wewnątrzkomórkowego stężenia wapnia i, w różnym stopniu, depolaryzację błon. Podróż do CLCA dobiegła końca, gdy stwierdzono, że było to białko wydzielane, ale prawdopodobnie zwiększyło ekspresję błon kanałów CLCA endogennych do systemu ekspresji 30. Białka Tweety ‘ ego i Bestrophin nie wykazują wszystkich właściwości kanałów ClCa badanych w głównych tkankach, chociaż Best1 wydaje się odpowiedzialny za składnik ClCa w neuronach czuciowych31 i może być również ważnym regulatorem uwalniania wapnia z siateczki endoplazmatycznej32,33. Trzy niezależne badania zaproponowały tmem16a (zwany także Ano1) jako kandydata na główny składnik, jeśli nie w całości, dla kanału chlorku aktywowanego wapniem34-36. Wiele późniejszych badań, ułatwionych przez generowanie narzędzi molekularnych, potwierdziło to. TMEM16A jest ważny dla regulacji pobudliwości błony w mięśniach gładkich naczyń krwionośnych, jest regulowany w zwierzęcym modelu nadciśnienia płucnego i napięcie może być zmniejszone przez hamowanie kanału37,38. W neuronach czuciowych tmem16a łączy obecność mediatorów zapalnych z nadpobudliwością błony, a hamowanie TMEM16A ma działanie przeciwnocyceptywne39. W zwierzęcych modelach astmy ekspresja tego konkretnego kanału chlorkowego jest zwiększona, a jego hamowanie może mieć korzystny efekt40. Występuje również w komórkach śródmiąższowych jelita i funkcja kanału jest wymagana do rytmicznego skurczu mięśni gładkich w ścianie jelitowej41. Ponadto aktywacja TMEM16A może stanowić alternatywny szlak wydzielania chlorków nabłonkowych w włókniaku torbielowatym42. Chociaż nadal istnieje pewna debata dotycząca dokładnej funkcji reszty rodziny TMEM16, funkcja ClCa została również przypisana do Tmem16b (Ano2), który uważa się za podstawę kanału ClCa w komórkach włosów węchowych43, 44. W biologii komórek nowotworowych może również występować rola kanału jonowego tej klasy, a jego hamowanie może zapobiegać proliferacji komórek 45-48.
Uwagi końcowe
ta recenzja podkreśliła różne role białek przewodzących lub transportujących chlorki oraz sposób, w jaki ich dysfunkcja jest sprzężona z ludzkim zaburzeniem lub objawami przypominającymi chorobę w modelach zwierzęcych. Istnieje poważny brak odczynników farmakologicznych, które hamują, aktywują lub poprawiają przepływ błon kanałów chlorkowych i transporterów. Postęp jest dokonywany z lekami, które odwracają wadliwą funkcję CFTR w mukowiscydozie, co miejmy nadzieję spowoduje leki, które są specyficzne dla różnych typów dziedzicznej mutacji. Inhibitory i aktywatory kanałów chlorkowych aktywowanych wapniem tmem16a42,49 okazują się przydatnymi narzędziami laboratoryjnymi, a nowe związki mogą tworzyć skuteczne leki, szczególnie jeśli mogą dostarczać efekty specyficzne dla tkanek. Cząsteczki specyficzne dla poszczególnych CLC są prawdopodobnie najbardziej nieuchwytne. Zrozumienie strukturalnych podstaw aktywacji CLC z bramkami napięciowymi 50 może zidentyfikować domeny białkowe, które są kierowane przez racjonalne projektowanie leków oparte na strukturze. Takie narzędzia pozwolą nam wystawić na próbę niektóre z nowatorskich pomysłów terapeutycznych, które zostały sprawdzone i zaprezentowane tutaj.
biografia autora

Dr Jon Lippiat ukończył doktorat na temat struktury, funkcji i farmakologii kanałów potasowych na Uniwersytecie w Leicester. Studiował funkcję beta-komórek trzustki i cukrzycę na Uniwersytecie w Oksfordzie, a następnie został wykładowcą farmakologii na Uniwersytecie w Leeds. Jego badania obejmują Wyjaśnienie strukturalnych i fizjologicznych właściwości kilku różnych typów kanałów jonowych i transporterów oraz ich potencjalnego ukierunkowania za pomocą nowych odczynników farmakologicznych.
numer
4 2013
Tematy pokrewne
kanały chlorkowe, cele leków, kanały jonowe