kwasy, zasady i pH
|
|||||||||
kwasy i ich sprzężone Zasady
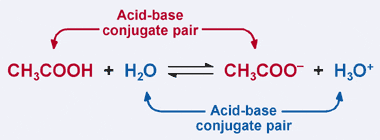
pamiętaj o definicji kwasu Bronsteda-Lowry’ ego: kwas jest dawcą protonów. Oczywiście w naszym poprzednim przykładzie kwas octowy przekazuje swój proton H2O w reakcji do przodu, w wyniku czego powstaje jon octanowy. Jednak w reakcji odwrotnej jon octanowy przyjmuje proton z H3O+, aby powrócić do CH3COOH. Z definicji Bronsteda-Lowry ‘ ego baza jest akceptorem protonów.
|
Tak więc jon octanowy działa jako zasada w reakcji odwrotnej i jest nazywany sprzężoną zasadą kwasu octowego. Kwas octowy i Jon octanowy są znane jako sprzężona para kwasowo-zasadowa. Co ciekawe, w powyższej reakcji występuje druga para koniugatów kwasowo-zasadowych. Zauważ, że w reakcji odwrotnej H3O + przekazuje proton (czyniąc go kwasem), podczas gdy w reakcji odwrotnej H2O przyjmuje proton (czyniąc go zasadą). H2O i H3O+ są sprzężoną parą kwasowo-zasadową, przy czym H3O+ jest sprzężonym kwasem, a H2O jest sprzężoną zasadą.
In a conjugate acid-base pair, the conjugate acid has one more Proton than its corresponding conjugate base.