poznane zaangażowanie antygenu na komórkach miąższowych stymuluje proliferację limfocytów T CD8+ in situ
- poznane limfocyty T CD8+ znajdują się w tkance LN i w stanie zapalnym
- limfocyty T CD8+ rozszerzają się w miejscu zapalenia
- interakcja Cogniate z wysepkami sprzyja ekspansji
- nie jest wymagana interakcja poznawcza z rezydującymi leukocytami
- ważna jest interakcja poznawcza z komórkami miąższowymi
- komórki T proliferują w miejscu zapalenia
- interakcja poznawcza z komórkami miąższowymi napędza proliferację
- IL-2 jest ważniejsza w miejscu zapalenia
poznane limfocyty T CD8+ znajdują się w tkance LN i w stanie zapalnym
w początkowych eksperymentach (Fig. 1) stworzyliśmy model, w którym można analizować odpowiedzi limfocytów T CD8 na antygen miąższowy, albuminę jajową (OVA). Myszy OT-i wyrażają transgeniczny TCR, który pośredniczy w rozpoznawaniu komórek T CD8+ peptydu OVA257-264 prezentowanego na cząsteczce MHC klasy I H-2KB. Limfocyty T CD8 wzbogacono z myszy OT-i / CD45.1, znakowanych barwnikiem cfse i adoptywnie przenoszonych dożylnie na myszy gospodarza B6 (CD45. 2+). Adoptywnie przeniesione komórki T można odróżnić od komórek gospodarza poprzez barwienie CD45.1 (jak również CD8 i łańcuch Va2 OT-i TCR), podczas gdy rozcieńczenie barwnika CFSE stosowano do identyfikacji komórek, które się proliferowały (na przykład, Fig. 1a, dodatkowe rys. 1). Antygen miąższowy wprowadzono przez szczepienie B6.wysepki ßOVA (takie wysepki wyrażają komórki jajowe w miąższowych komórkach β pod promotorem insuliny szczura, tabela uzupełniająca 1) pod kapsułką nerkową myszy gospodarza, które otrzymały już komórki T OT-i/CD45.1. Wszystkie trzy źródła (gospodarz, dawca komórek T i dawca wysepek) mają tło B6, a zatem wyrażają H-2kb. Tak więc, chociaż ekspresja antygenu komórek jajowych była ograniczona do szczepionych komórek β, założyliśmy, że prezentacja komórek jajowych pochodzących z komórek β przez nie-miąższowe APC,takie jak DC poprzez krzyżową prezentację, będzie wymagana do gruntowania LN i być może lokalnych odpowiedzi na komórki T17, 18.

podzielone komórki OT-I (żywotne CD45.1+CD8+Va2+ gate) w drenażu nerki LN i przeszczep 3 lub 6 dni po otrzymaniu pojedynczego przeszczepu 400 B6.wysepki ßOVA. a) reprezentatywne wykresy cytometrii przepływowej. Pozycję niepodzielonego piku OT-I oznaczono za pomocą kontroli “bez antygenu” przeszczepu wysepki B6. B) całkowita liczba podzielonych OT-I w nerkach LN i przeszczepie, gdzie każdy punkt reprezentuje pojedynczą mysz. Zebrane dane z siedmiu niezależnych eksperymentów: n=8 biorców przeszczepu w 3.dniu I N = 14 biorców przeszczepu w 6. dniu. Jednego dnia 6 przeszczep został utracony z powodu awarii cytometru przepływowego. Poziome pręty są środkami, wartości P obliczono przez nieparzyste, dwuogonowe t-test z korektą Welcha.
limfocyty T CD8+ rozszerzają się w miejscu zapalenia
zgodnie z oczekiwaniami, silna odpowiedź OT-I została wykryta najpierw w nerkowej LN, która odprowadza miejsce przeszczepu i była zależna od obecności antygenu komórek jajowych (Fig. 1a, b). W 3 dni po przeszczepieniu można było wykryć podzieloną OT-I w LNs odprowadzającą B6.wysepki ßOVA (rys. 1a) i były obfite (rys. 1b, średnia=9,2 × 104). Natomiast w obrębie B6 można było wykryć 100-krotnie mniej podzielonych komórek OT-I.grafy ßOVA (rys. 1A, B, średnia=6,6 × 102). Liczba podzielonych komórek OT-I wzrosła 300-krotnie w miejscu przeszczepu od dnia 3 do dnia 6 (Fig. 1B, średnia=6,6 × 102 w dniu 3 do 2,1 × 105 W dniu 6, P<0,0001, niesparowany dwuogonowy test t z poprawką Welcha), podczas gdy nie było wzrostu LN (Fig. 1B). Odpowiedź OT-I w B6.przeszczepy ßOVA można wytłumaczyć infiltracją komórek OT-I, które namnażały się w LN. Jednak profile CFSE różniły się między miejscami przeszczepu i LN, ponieważ komórki OT-I w przeszczepach były bardziej podzielone niż te w ln w dniu 6 (Fig . 1a). Istnieją co najmniej dwa możliwe wyjaśnienia tej różnicy. Tylko komórki, które podzieliły się wiele razy naciekały przeszczep. Alternatywnie, komórki docierające do przeszczepu szybciej się dzielą, prawdopodobnie ze względu na obfitość dostępnego antygenu. Wzrost bezwzględnej liczby komórek w przeszczepie w porównaniu z LN w dniu 6 skłonił nas do zbadania tego ostatniego wyjaśnienia.
interakcja Cogniate z wysepkami sprzyja ekspansji
aby określić możliwy udział COGNIATE MHC w przeszczepie do ekspansji lokalnej, użyliśmy wysepek pochodzących z bm1.ßOVA myszy (dodatkowa Tabela 1). W bm1.myszy ßOVA, cząsteczka H–2kbm1 nie jest w stanie przedstawić peptydu OVA257-264 z powodu trzech mutacji do H-2KB (ref. 19). Porównanie odpowiedzi na B6.ßOVA i bm1.przeszczepy wysepek ßOVA wykazały, że pomimo podobnych odpowiedzi OT-I w drenującym nerkowym LN, ekspansja OT-I zmniejszyła się sześciokrotnie w bm1.ßOVA w porównaniu do B6.ßOVA grafta (średnia = 4.7 × 104 w porównaniu do 2,6 × 105 podzielonego OT-I; P=0,0153 niesparowany dwuogonowy test t z korekcją Welcha; Fig. 2A). Ta mniej efektywna ekspansja komórek OT-I infiltrujących bm1.przeszczepy ßOVA sugerowały, że interakcje poznawcze z wszczepionymi komórkami wysepek przyczyniły się do lokalnej ekspansji komórek T.

Analiza cytometrii przepływowej komórek OT-I (viable CD45.1+CD8 + Va2 + gate) 6 dni po przeszczepieniu. a) całkowity podział OT-I w nerce drenującej LN i przeszczep po otrzymaniu pojedynczego przeszczepu 400 B6.ßOVA lub bm1.wysepki ßOVA. Dane dla B6.ßOVA szczepione myszy są podzbiorem tego pokazanego na Fig. 1B. każdy punkt reprezentuje indywidualną mysz. Zbiorcze dane z dwóch niezależnych eksperymentów przedstawiono w każdym panelu: n = 5 biorców B6.ßOVA przeszczepy I N = 6 biorców bm1.ßOVA przeszczepy. Poziome pręty są środkami, wartości P obliczono przez nieparzyste, dwuogonowe t-test z korektą Welcha. (b) schemat dwubiegunowego modelu przeszczepu, w którym przeszczepy 200 wysepek są umieszczone na przeciwległych biegunach tej samej nerki i mają wspólną nerkę drenującą LN. Całkowity podział OT-I w (c) B6.ßOVA i KbKO.ßOVA przeszczepy dwubiegunowe I (d) B6.przeszczepy bipolarne ßOVA i B6 (N=5 myszy biorców zebranych z dwóch niezależnych eksperymentów w każdym z c I d) dane dla tej samej myszy są połączone przerywanymi liniami: wartości P obliczono przez stosunek sparowanego testu T.
w celu wyeliminowania jakiegokolwiek wkładu przez alloantigen H-2kbm1 wygenerowaliśmy KbKO.myszy ßOVA wykazujące ekspresję antygenu komórek jajowych w komórkach beta wysepek, ale pozbawione alloantygenu lub H-2kb (tabela uzupełniająca 1). Następnie użyliśmy “dwubiegunowego modelu przeszczepu” do porównania odpowiedzi na B6.ßOVA i KbKO.przeszczepy wysepek ßOVA umieszczone na przeciwległych biegunach tej samej nerki u myszy gospodarza B6, tak że nacierające przeszczepy limfocyty T pochodzą z komórek T zagruntowanych w tym samym LN (Fig. 2b). W B6 było 10-100 razy więcej komórek T.ßOVA niż KbKO.grafy ßOVA (rys. 2c). Wykorzystując stosunek podzielonego OT-I na przeciwnych biegunach nerki obliczony dla poszczególnych myszy, uzyskaliśmy względny współczynnik odpowiedzi (RRR). RRR wskazywał, że miejscowa ekspansja limfocytów T była 26-krotnie większa, gdy doszło do sprzężenia poznawczego z komórkami przeszczepu (RRR = 26,4±14,1 w B6.ßOVA: KbKO.ßOVA przeszczepy, P=0,0025, stosunek sparowany t-test, Fig. 2c).
porównaliśmy również odpowiedzi na bipolar B6.przeszczepy ßOVA i B6 (bez antygenu) (rys. 2d). Bardzo niewiele OT-I można wykryć w przeszczepach B6 (rys. 2d) i uważamy za prawdopodobne, że wiele z nich krąży OT-I Pochodzące ze skażenia krwi. Tak więc niespecyficzne zapalenie związane z przeszczepami, w których nie ma antygenu, nie prowadzi do wydajnej ekspansji komórek T w obrębie tkanki zapalnej. Natomiast odpowiedź na B6.przeszczepy ßOVA były ponownie bardzo silne i ponad 900-krotnie większe niż przeszczepy B6 (RRR=950±252 dla B6.ßOVA: przeszczepy B6, P< 0,0001, stosunek sparowany t-test, rys. 2d).
łącznie te eksperymenty wykazały, że ekspansja limfocytów T CD8 w obrębie zapalnej tkanki docelowej była znacząco promowana przez lokalną prezentację antygenu. Nie musi to koniecznie wykluczać innych przyczyn ekspansji limfocytów T, na przykład poprzez krzyżujące się DC gospodarza w przeszczepie. My tylko aver że poznawać interakcję między limfocytami T i komórkami wysepek powoduje znaczną ekspansję limfocytów T.
nie jest wymagana interakcja poznawcza z rezydującymi leukocytami
wysepki są złożonymi skupiskami komórek, które obejmują komórki β, komórki śródbłonka i leukocyty rezydujące na wysepkach (IRL). Dlatego następnie staraliśmy się wyjaśnić, które komórki wysepek przedstawiały antygen do infiltracji komórek T w celu napędzania ekspansji komórek T. Najbardziej oczywistym kandydatem byłby IRL. Te komórki CD45+ zostały różnie zdefiniowane jako DC lub makrofagi, co-express CD11c i F4 / 80 i wykazano, że przetwarzają i prezentują antygeny 20,21,22,23. Zbadaliśmy zatem rolę IRL dawcy w stymulowaniu lokalnej ekspansji limfocytów T CD8. B6.myszy ßOVA krzyżowano do CD11c.DTR.Myszy GFP w celu uzyskania CD11c.DTR.GFP.myszy ßOVA, których komórki β wykazują ekspresję komórek jajowych i których komórki CD11c+ mogą być ablowane przez wstrzyknięcie toksyny błoniczej (DT) 8. Najpierw przetestowaliśmy przez FACS, że wysepki wyizolowane z CD11c. DTR.Myszy GFP leczone DT były pozbawione komórek CD11c+ (Fig. 3a, b). CD11c + IRL u nieleczonych myszy kontrolnych zidentyfikowano przez barwienie dla CD45 i CD11c, jak również ich ekspresję reportera GFP i zostały wyraźnie wyczerpane przez leczenie DT (Fig . 3a, b, p=0,0002, niesparowany dwuogonowy test t z korekcją Welcha). Potwierdziliśmy również, że CD11c + IRL co-expressed F4 / 80 i H-2 Kb MHC class i (dodatkowe rys. 2A) i w konsekwencji komórki F4/80+ zostały również wyczerpane z wysepek myszy leczonych DT(Fig. 2b). CD11c.DTR.GFP.wysepki ßOVA wyizolowane od nieleczonych i leczonych DT myszy szczepiono w przeciwnych biegunach tej samej nerki. Podzielenie liczby OT-I było podobne między przeszczepami, co wskazuje, że wyczerpanie IRL nie miało wpływu na ekspansję limfocytów T CD8+ w miejscu przeszczepu (Fig. 3c). Aby potwierdzić, że IRL nie były ważne dla lokalnej ekspansji limfocytów T CD8, przeprowadziliśmy drugi zestaw eksperymentów. KbKO.myszy ßOVA napromieniowano i odtwarzano za pomocą szpiku kostnego KbKO lub B6 (BM) W celu wytworzenia źródła wysepek ßOVA, w których ekspresja H-2kb była nieobecna we wszystkich komórkach lub selektywnie przywracano do IRL (Fig. 3d). Porównanie takich wysepek w modelu przeszczepu dwubiegunowego wykazało podobne poziomy ekspansji komórek OT-I w obu przeszczepach (Fig. 3e). W związku z tym IRL nie są głównymi czynnikami lokalnej ekspansji limfocytów T CD8.

Analiza cytometrii przepływowej pokazująca wyczerpanie CD11c + IRL w CD11c.DTR.Myszy GFP leczone DT: a) reprezentatywne wykresy pokazujące gatowanie CD11c + IRL na wysepkach nieleczonych myszy kontrolnych i ich wyczerpanie w dniu następującym po pojedynczym leczeniu DT oraz b) wyliczenie CD11c+IRL u nieleczonych i leczonych DT myszy. Każdy punkt reprezentuje indywidualny preparat wysepek zawierający połączone wysepki od 1 do 8 myszy, N=5 nieleczonych preparatów wysepek i 6 preparatów wysepek poddanych działaniu DT zebranych w czterech niezależnych eksperymentach. Wartość p obliczona przez niesparowany, dwuogonowy test t z korektą Welcha. C) całkowity podzielony OT-I w 6 dni po przeszczepie dwubiegunowym wysepek uzyskanych z CD11c. DTR.GFP.myszy ßOVA nieleczone lub leczone DT (N = 6 myszy biorczych zebranych z dwóch niezależnych eksperymentów). Dane dla tej samej myszy są połączone przerywanymi liniami; wartości p obliczane przez stosunek sparowany t-test. D) reprezentatywne wykresy wykazujące brak lub obecność ekspresji H-2kb na CD11c + IRL myszy kbko odtworzonych odpowiednio KbKO lub B6 BM. Pregowane na żywych komórkach. e) całkowity podzielony OT-I w 6 dni po dwubiegunowym przeszczepie wysepek otrzymanym od myszy chimaerycznych (n=3 myszy biorcy z pojedynczego eksperymentu). Dane dla tej samej myszy są połączone przerywanymi liniami; Wartości p obliczone przez stosunek sparowany t-test.
ważna jest interakcja poznawcza z komórkami miąższowymi
B6.Myszy rip-Kb transgenicznie wyrażają H – 2kb w komórkach β pod kontrolą promotora insuliny szczura24. Przez przejście tych myszy do KbKO.mysz kbko.ßOVA.myszy ßKb, u których ekspresja H-2KB była ograniczona do komórek β (tabela uzupełniająca 1). Ekspresję H – 2KB na komórkach β potwierdzono analizą FACS wysepek (Fig. 4a). Badaliśmy komórki krwiotwórcze wysepek (CD45+) i śródbłonka (CD31+) i wykazaliśmy, że H-2Kb nie ulega ekspresji na tych komórkach w żadnym KbKO.ßOVA lub KbKO.ßOVA.myszy ßKb w porównaniu do silnej ekspresji u myszy B6 (Fig. 4a). Pozostałe komórki CD45-CD31 są autofluorescencyjne dodatnie i wzbogacone w komórki endokrynologiczne. Analiza FAKSOWA wysepek z KbKO.ßOVA.myszy ßKb wykazywały ekspresję H-2kb w populacji autofluorescencyjnej wzbogaconej komórkami β na poziomach podobnych do obserwowanych na wysepkach B6 (Fig. 4a). Porównanie w modelu przeszczepu dwubiegunowego wykazało, że ekspansja OT-I była 14-krotnie większa w przypadku ekspresji antygenu poznanego na komórkach β (RRR=14,0±4,1 dla KbKO.ßOVA.ßKb: KbKO.ßOVA przeszczepy, P=0,0008, stosunek sparowany t-test, Fig. 4B).

(A) wykresy cytometrii przepływowej (bramkowane na żywych komórkach) wykazujące selektywne przywrócenie ekspresji H-2Kb na komórkach miąższowych. Histogramy przedstawiają wysepki z kbko (zacienione), B6 (przerywane) lub KbKO.ßKb (pogrubienie) myszy. B) całkowity podzielony OT-I w 6 dni po przeszczepie dwubiegunowym KbKO.ßOVA i KbKO. ßOVA.BKB. wysepki (N = 6 myszy biorących udział w trzech niezależnych eksperymentach). Dane dla tej samej myszy są połączone przerywanymi liniami; wartości p obliczane przez stosunek sparowany t-test.
komórki T proliferują w miejscu zapalenia
nasze powyższe wyniki wskazują, że w miejscu docelowym występowała miejscowa proliferacja. W celu wykrycia aktywnie proliferujących komórek skrzyżowaliśmy myszy OT-i/CD45.1 z myszami FucciRG, aby wygenerować FucciRG/OT-i / CD45.1 myszy (skrót FucciOT-I). U takich myszy komórki fluoryzują czerwony (FucciR) podczas fazy G0/G1 i zielony (FucciG) podczas fazy cyklu komórkowego s/G2/M25, 26. Stopniowa degradacja i akumulacja reporterów FucciR i FucciG podczas przejścia między fazami cyklu umożliwia dalsze rozróżnienie: bardziej intensywna ekspresja FucciR w spoczynkowych komórkach G0 w porównaniu do cyklicznych komórek G1, podwójnie ujemne komórki FucciR−G w bardzo wczesnym G1 i słabo podwójnie dodatnie komórki FucciR+G+ W G1/s (refs 26, 27). Spoczynkowe komórki FucciOT-I z niegraftowanych myszy były FucciG – (Fig. 5A, górny panel, niegrafowany). Aby uniknąć ingerencji w barwniki Fucci zastąpiliśmy CFSE CTV. U myszy, które otrzymały B6.ßOVA przeszczepy, analiza rozcieńczenia CTV wykazała, że podzielone FucciOT-I były obecne w odpływie nerki LN, a niektóre z nich były fuccig + sugerujące aktywny podział komórek (Fig. 5A, panel górny, odpływ LN). W miejscu przeszczepu wykryliśmy FucciOT-I, który przeszedł wiele podziałów (CTV nie jest już wykrywalny), a wiele z nich było fuccig+ wspierające trwającą proliferację (rys. 5A, górny panel, świeży przeszczep). Porównanie proporcji komórek FucciG+ w podzielonej populacji OT-I (Fig. 5c) wskazało, że postępująca proliferacja w świeżych przeszczepach (26,8±8,8% FucciG+) przewyższała tę w drenującym LN nerkowym (7,3±1,6%, P=0,008, niesparowanym dwuogonowym teście T z korekcją Welcha) lub nie drenującym LN nerkowym (2,1±2,1%, p=0,003, niesparowanym dwuogonowym teście T z korekcją Welcha). Rzeczywiście, badanie ekspresji zarówno FucciG, jak i FucciR wykazało, że większość infiltracji przeszczepem OT-I aktywnie dzieliła się, to znaczy bardzo niewiele komórek wykazywało wysoką ekspresję FucciR, która była charakterystyczna dla spoczynkowych komórek w ln u nieszczepionych myszy (Fig . 5A, dolne panele). Chociaż przypuszczaliśmy, że proliferacja w miejscu zapalenia została wywołana in situ, nie mogliśmy całkowicie odrzucić możliwości, że po prostu odzwierciedlało to niedawne pojawienie się proliferacyjnych komórek. Aby to wyjaśnić, zebraliśmy dwubiegunowe przeszczepy B6.wysepki ßOVA do analizy jednego przeszczepu natychmiast po wycięciu i hodowli drugiego przeszczepu przez 1 dzień (rys. 5A). Podczas gdy liczba OT-I nie wzrosła w okresie kultury (rys. 5b), prawdopodobnie odzwierciedlając śmierć komórki w nieoptymalnych warunkach ex vivo, wiele komórek FUCCIG+ OT-I nadal było wykrywanych (14,2±4,2% FucciG+, Fig. 5c). Profil hodowanego przeszczepu, bez możliwej rekrutacji na jeden dzień, wskazywałby na wysoką proliferację de novo w przeszczepie.

(a) schematyczne i reprezentatywne wykresy cytometrii przepływowej (zamknięte na żywotnych limfocytach CD45.1+CD8+Va2+) wykazujące odpowiedź komórek FucciOT-I w nerkowych LNs lub dwubiegunowych B6.ßOVA przeszczepy. LNs i przeszczep z jednego bieguna zbadano natychmiast (świeży po 6 dniach od przeszczepu), podczas gdy przeszczep z przeciwległego bieguna hodowano przez 1 dzień przed analizą. W celu wykazania braku podziału i ekspresji FucciG (górny panel) i przewagi wysokich komórek FucciR (dolny panel) w spoczynkowym FucciOT-I. (b) całkowity podział FucciOT-I w świeżych i hodowanych przeszczepach. Średnia + s. d., N = 5, wartości p obliczone na podstawie sparowanego testu T z dwoma ogonami. c) % FucciG+ podzielone OT-I w świeżych, nie drenujących i przeszczepionych przeszczepach nerkowych LN, jak również w świeżych i hodowanych przeszczepach. Średnia+s.d., n = 5 z wyjątkiem LN bez odprowadzania, dla których N = 4 z powodu utraty jednego LN podczas przetwarzania. Wartości P obliczono za pomocą dwuogonowego niesparowanego testu T z korektą Welcha. Dane są gromadzone z dwóch niezależnych eksperymentów.
interakcja poznawcza z komórkami miąższowymi napędza proliferację
następnie wykorzystaliśmy Model FucciOT-I do oceny roli innego potencjalnego lokalnego kierowcy proliferacji komórek T w przeszczepionym, pochodzącym z gospodarza APC, takim jak zapalny DC. W celu wyeliminowania jakiegokolwiek wkładu hosta APC najpierw uzyskaliśmy tło KbKO. Ponieważ myszy kbko odrzuciły komórki OT-I, stworzyliśmy KbKO BM do chimerów B6, aby używać ich jako gospodarzy; w związku z tym komórki krwiotwórcze nie miały H-2Kb, ale były permisywne dla komórek OT-I. Tym chimaerom podawano komórki T FucciOT-I i dwubiegunowe przeszczepy KbKO.wysepki ßOVA (pozbawione ekspresji H-2kb, a tym samym zdolności do prezentowania antygenu komórek jajowych)i KbKO.ßOVA.wysepki ßKb (zarówno H-2KB, jak i antygen komórek jajowych ograniczono do komórek β). Ponieważ Chimaera nie miała dodatniego APC H-2KB, konieczne było podanie komórek śledziony pokrytych peptydem OVA257-264 w celu zainicjowania odpowiedzi OT-I. Sukces tego gruntowania wykazano przez rozcieńczenie CTV w komórkach FucciOT-I w nerkowym LN, chociaż w czasie zbioru były to FucciG− i nie wydawały się aktywnie dzielić (0,1±0,0% FucciG+, Fig. 6a,d). Bardzo niewielu OT-i infiltrowało KbKO.ßOVA przeszczepy, ale były wyraźnie rozszerzone w obrębie KbKO.ßOVA.ßKb przeszczepy (RRR 61,4±26,6 dla KbKO.ßOVA.ßKb: KbKO.ßOVA, Fig. 6b, P=0,0008, dwubiegunowy stosunek sparowany t-test). Tak więc, nawet przy braku antygenu poznanego na APC gospodarza, poznany antygen na miąższowych komórkach β był wystarczający do napędzania ekspansji limfocytów T CD8 w miejscu przeszczepu. Nieliczne komórki T FucciOT-I obecne w KbKO.ßOVA przeszczepy przypominały te w LN zarówno pod względem ich nieefektywnej progresji do frakcji silnie podzielonej (Fig. 6a, c, 7,5±0,9% wysoko podzielone w LN i 19,3±3,3% wysoko podzielone w KbKO.ßOVA grafts) i brak ekspresji FucciG (rys. 6a, d, 0,1±0,0% w LN i 0,1±0,1% w KbKO.ßOVA przeszczepy) sugerujące, że mała proliferacja OT-I wystąpiła w miejscu przeszczepu przy braku antygenu poznanego. Natomiast OT-I w KbKO.ßOVA.szczepy ßKb były przeważnie silnie podzielone (92,3±1,0%, Fig. 6a, c), a niektóre z nich były FucciG+ i w ten sposób aktywnie się rozmnażają (rys. 6a, d, 5,0±1,2% FucciG+). Stąd prezentacja antygenu poznanego przez miąższowe komórki β Wysp była w stanie prowadzić de novo proliferację FucciOT-I in situ.

odpowiedź FucciOT-I na przeszczepy w kbko BM na myszy gospodarza B6, u których komórki krwiotwórcze gospodarza nie mają ekspresji H-2Kb. Szczepione myszy otrzymały komórki śledziony pokryte peptydem w dniu szczepienia w celu rozpoczęcia gruntowania OT-I. a) reprezentatywne wykresy cytometrii przepływowej (zamknięte na żywotnych limfocytach CD45.1 + CD8 + Va2+). Górny panel pokazuje brak podziału i ekspresji Fucciga w spoczynkowym OT-I u myszy, która nie była ani szczepiona, ani zagruntowana. Trzy dolne panele pokazują reakcje u dwubiegunowej szczepionej i zagruntowanej myszy: drenowanie nerki LN, KbKO.ßOVA i KbKO.ßOVA.przeszczepy KB. Podzielone komórki u szczepionych myszy podzielono na dwa sektory, przy czym silnie podzielone komórki trafiały do sektora, w którym CTV było rozcieńczane poza granicę wykrywalności. B) całkowity podział FucciOT-I w KbKO.ßOVA i KbKO.ßOVA.ßKb przeszczepy dwubiegunowe, wartości p obliczone przez dwubiegunowy stosunek sparowany t-test. (c) % silnie podzielone i (d) % FucciG+ OT-I w odprowadzaniu LN nerek i przeszczepach myszy szczepionych dwubiegunowo. Wartości P obliczono za pomocą testu T z dwoma ogonami. Wyniki dla poszczególnych myszy są połączone przerywanymi liniami, N = 6 myszy biorców zebranych z dwóch niezależnych eksperymentów.
IL-2 jest ważniejsza w miejscu zapalenia
pokazujemy, że ekspresja IL-2RA była ważniejsza dla proliferacji i akumulacji limfocytów T CD8+ w miąższu obwodowym (przeszczepy wysepek) niż w miejscu gruntowania w drenażu LN (Fig . 7a). Ponadto przeanalizowaliśmy odpowiedź w drugim miejscu oddalonym od miejsca gruntowania, czyli bez odprowadzania LN. Limfocyty T CD8 + znakowane CTV od myszy OT-I. il-2RAKO (IL-2RA−CD45.2+) I OT-i/Ly5.1 (IL-2RA+, CD45.1+CD45.2+) przeniesiono do myszy gospodarza B6.CD45.1 (CD45.1+) przed otrzymaniem pojedynczego przeszczepu B6.wysepki ßOVA. Odrębne sygnatury alleliczne CD45 każdej z przeniesionych populacji limfocytów T (w połączeniu z barwieniem dla CD8 i Va2) umożliwiły nam oszacowanie i porównanie stosunku podzielonego WT:IL-2RAKO OT-i (Fig. 7a, dodatkowe rys. 3). IL-2RA WT wyraźnie wykluczyła IL-2RA Ko OT-I w miejscu przeszczepu w porównaniu do drenażu (P=0,025, test T z dwoma ogonami) lub bez drenażu (P = 0,044, test T z dwoma ogonami) LN. Jest to zgodne ze zwiększoną zależnością limfocytów T CD8+ od IL – 2 w czasie wtórnego zetknięcia się z antygenem w miejscu zapalenia w porównaniu do początkowego podawania w drenażu LN.
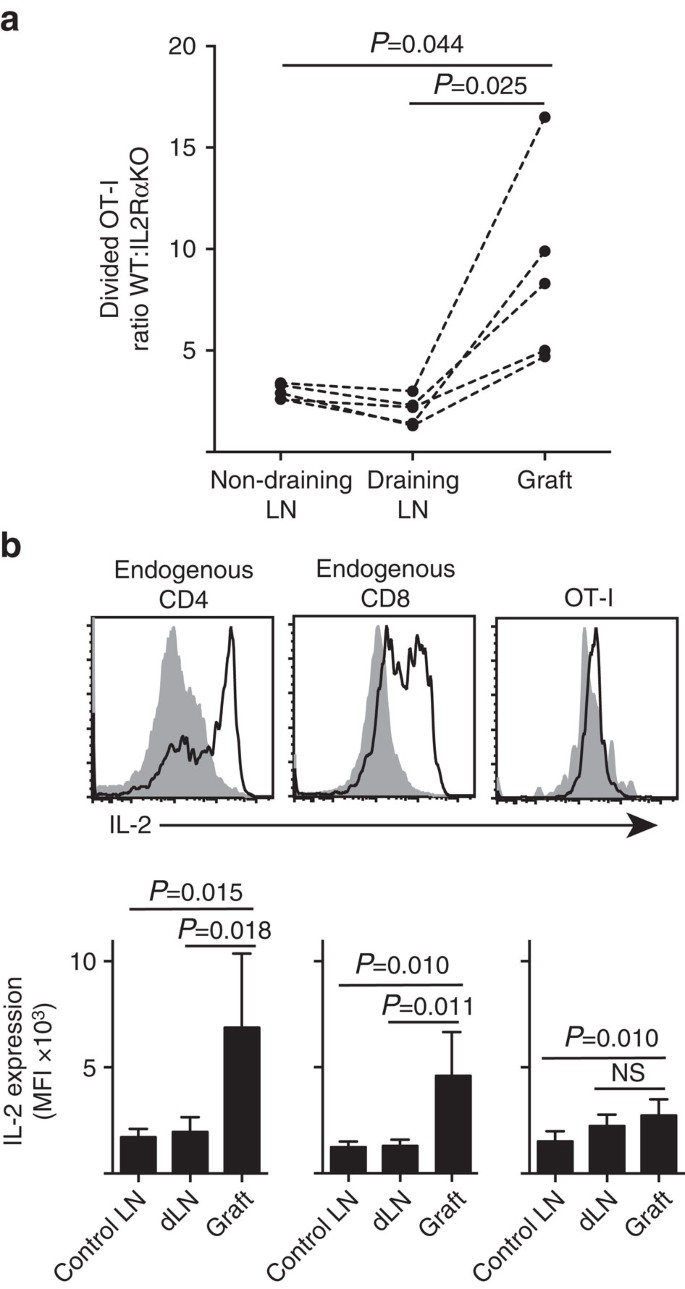
(a) stosunek podzielonych komórek IL-2RA WT: IL-2RA Ko OT-i odzyskanych z B6.przeszczep wysepki ßOVA, odprowadzający nerkowy LN i nie odprowadzający pachwinowy LN po przeniesieniu (po 106 z każdego) na myszy gospodarza B6. CD45. 1. Współczynniki obliczono dla poszczególnych narządów z wynikami dla pojedynczych myszy połączonych przerywanymi liniami i porównano za pomocą dwugoniastego sparowanego testu T. Wyniki pokazano dla n=5 myszy biorców i reprezentatywnych dla trzech niezależnych eksperymentów. B) ekspresji IL-2 w endogennych komórkach CD4+ i CD8+ oraz przeniesionych komórkach OT-I u biorców B6.przeszczepy wysepek ßOVA. Górne panele pokazują reprezentatywne wykresy cytometrii przepływowej dla przeszczepu odwadniającego nerkę LN (stała szara) i przeszczepu (czarna linia). Dolne panele podsumowują średnią intensywność fluorescencji (MFI) ekspresji IL-2 dla nerkowych LNs pobranych z ungrafted (Control LN), a także przeszczep i odprowadzanie nerkowych LN (dLN) szczepionych myszy. Wyniki pokazane jako średnia + s. d., N = 6 zebrane z dwóch niezależnych eksperymentów i porównane przez dwuogonowy niesparowany test t z korektą Welcha.
zwiększona zależność od IL-2 dla proliferacji limfocytów T CD8+ w miejscu zapalenia wywnioskowała konieczność lokalnej produkcji IL-2. Dlatego zbadaliśmy potencjał różnych limfocytów T (endogennych CD4+ i CD8 + pochodzących z gospodarza, jak również przeniesionych limfocytów T OT-i CD8+) dla zdolności do wytwarzania IL-2 (Fig. 7b). Zawiesiny komórkowe przygotowane z przeszczepów lub LN krótko (4 h) restymulowano PMA i jonomycyną przed barwieniem w celu ekspresji wewnątrzkomórkowej IL-2. Badanie endogennych komórek T pochodzących z gospodarza CD4+ i CD8 + dostarczyło przekonujących dowodów na wytwarzanie IL-2 w miejscu zapalenia przeszczepu z wyraźnym wzrostem mfi barwienia IL-2 w porównaniu z drenującym lub nie drenującym LN. Poziom IL-2 w limfocytach T OT-i CD8+ w miejscu zapalenia był umiarkowanie zwiększony w stosunku do poziomu w ln bez drenażu, ale nie różnił się znacząco od poziomu w ln bez drenażu. Jedną z interpretacji tych danych jest to, że poznane interakcje OT-I z komórkami miąższowymi indukują szybką proliferację, ale słabą produkcję IL-2, tak że OT-i są zależne od PARAKRYNY IL-2 pochodzącej z endogennych limfocytów T CD4+ i CD8+ w lokalnym środowisku przeszczepu. Jednak dodatkowy eksperyment wykazał, że egzogenna IL-2 bez antygenu miąższowego nie może prowadzić ekspansji komórek OT-i CD8+. IL-2 (rekombinowany hIL-2, 25 000 j. m.) podawano dootrzewnowo myszom B6, które otrzymały dwubiegunowe przeszczepy B6.wysepki ßOVA i B6. Porównanie odzysku OT-I w narządach odzyskanych od myszy leczonych IL-2 lub nośnikiem w dniu 6 po szczepieniu nie wykazało znaczącego wzrostu akumulacji podzielonych komórek OT-I w dwóch miejscach, w których nie ma miąższowego antygenu, a mianowicie przeszczepów wysepek b6 (3±3 u myszy leczonych nośnikiem w porównaniu do 49±64 u myszy leczonych IL-2, P=0. 342) i nie drenujący pachwinowy LN (1648+633 u leczonych nośnikiem w porównaniu do 1660+1023 u myszy leczonych IL-2, P=0,987, średnia±S. d., n = 3, dwuogonowy niesparowany test T z korekcją Welcha).