wartość prognostyczna wielkości guza w stadium II i III raka jelita grubego w populacji Tunezji
-
wielkość guza (tus) została zgłoszona jako prognostyczna w przypadku raka jelita grubego.
-
w naszym badaniu zbadaliśmy rolę prognostyczną TuS i zidentyfikowaliśmy wartość odcięcia o najwyższej wydajności przewidywania.
-
rozmiar 4 cm miał wpływ prognostyczny i zakłócał inne czynniki prognostyczne.
-
zaobserwowano, że wiek ≥65 lat, stadium III, inwazja żylna i pN+ powyżej 3 były istotnymi złymi czynnikami prognostycznymi u pacjentów z TuS ≥4, ale tylko stadium III było niezależnym czynnikiem prognostycznym w analizie wielowymiarowej.
-
podawanie chemioterapii było jedynym czynnikiem mającym znaczący wpływ na przeżycie w analizach jedno-i wielowymiarowych u pacjentów z TuS poniżej 4 cm.
rak jelita grubego (CRC) jest trzecim najczęstszym nowotworem na świecie i drugą najczęstszą przyczyną zgonów związanych z rakiem w krajach zachodnich . W Tunezji stanowi problem zdrowia publicznego. Jego częstość występowania wzrosła w ciągu ostatnich 15 lat . Pomimo poprawy procedur diagnostycznych i roboczych, a także ze względu na brak programów przesiewowych, większość przypadków CRC w Tunezji pozostaje wykrywana na etapie lokalnie zaawansowanym (pT3–T4, node-dodatni) lub przerzutowym . Prognozy poprawiły się w ostatnich latach, dzięki multidyscyplinarnemu zarządzaniu; 5-letnie całkowite przeżycie (OS) szacuje się na około 70% w stadium II i 50% w stadium III . Podjęto wiele starań, aby udoskonalić czynniki oceny ryzyka w CRC w celu identyfikacji pacjentów, którzy najprawdopodobniej odniosą korzyści z leczenia adiuwantowego. Czynniki te są głównie kliniczne, patologiczne, a ostatnio molekularne (niestabilność mikrosatelitarna/stabilność mikrosatelitarna, cDNA), niektóre z nich są nadal niedostępne w wielu krajach. Wielkość guza (tus) jest zastępczym markerem przeżycia w wielu nowotworach przewodu pokarmowego: raku żołądka, guz zrębu przewodu pokarmowego, rakowiaki . Jego znaczenie w CRC jest niejasne, ze sprzecznymi wynikami w kilku zgłoszonych seriach . TuS nie uwzględniał międzynarodowych wytycznych jako jednego z markerów do rozważenia przy ocenie ryzyka i wskazywaniu chemioterapii adiuwantowej . W niedawnym badaniu z patologiczną oceną 1443 nowych przypadków CRC w centralnym regionie Tunezji, 67,5% pacjentów miało TuS większy niż 5 cm, to odkrycie jest zupełnie inne niż przypadki w krajach zachodnich . W naszym bieżącym badaniu chcieliśmy zbadać wydajność TuS w przewidywaniu przeżycia w fazie II I III CRC oraz zbadać związek między TuS a znanymi czynnikami prognostycznymi.
pacjenci & metody
w latach 2003-2014 przeprowadzono retrospektywną ocenę kohorty 257 pacjentów, u których zdiagnozowano gruczolakoraka okrężnicy i/lub odbytnicy, leczonych w dwóch ośrodkach onkologicznych: Abderrahmen Mami Hospital i Clinique Taoufik Hospital. W 7 edycji American Joint Committee on Cancer (AJCC)/Union Internationale Contre le Cancer (UICC) uwzględniliśmy przypadki etapu II–III, leczone z zamiarem leczenia. Wzięliśmy pod uwagę tylko pacjentów z kompletnym badaniem i dostępnymi danymi patologicznymi, w tym TuS i danymi kontrolnymi. W okresie badania programowano obserwację po zakończeniu terapii leczniczej, co 3-4 miesiące w pierwszych 2 latach, co 6 miesięcy w latach 3-5, a następnie co rok. Podczas każdej wizyty pacjenci poddawani byli badaniom fizykalnym i sprawdzano ich pod kątem objawów i toksyczności terapeutycznej. Co 6 miesięcy wykonywano USG jamy brzusznej i RTG klatki piersiowej, począwszy od 2012 r. tomografię TK klatki piersiowej i markery nowotworowe (antygen Rakowo-błonowy, CA19-9) co 6 miesięcy.
TuS zdefiniowano jako poziome rozszerzenie guza mierzone maksymalną średnicą guza. Zastosowaliśmy charakterystykę receiver-operating characteristics (ROC), aby określić wydajność TuS w przewidywaniu przeżycia i zidentyfikować wartość odcięcia skorelowaną z przeżyciem. Porównaliśmy również cechy obu grup zgodnie z wartością odcięcia i zbadaliśmy czynniki prognostyczne w analizach jedno-i wielowymiarowych w każdej grupie.
analiza statystyczna
wszystkie analizy zostały przeprowadzone przy użyciu oprogramowania SPSS 20. Przeanalizowaliśmy krzywe ROC i przeanalizowaliśmy obszar pod krzywą (AUC)w celu określenia dokładności TuS w przewidywaniu przeżycia. AUC wynoszące 1,0 było bezbłędnym przewidywaniem raka u pacjentów, podczas gdy AUC wynoszące 0,50 oznacza połowę prawdopodobieństwa dokładnego przewidywania stanu nowotworu. Im wyższa wartość AUC–ROC, tym większa jest dyskryminacyjna Siła TuS dla wyniku. OS został zdefiniowany jako czas od daty diagnozy do śmierci z jakiejkolwiek przyczyny lub straty do obserwacji lub najnowszych wiadomości. OS oceniano zgodnie z metodą Kaplana-Meiera. Czynniki prognostyczne oceniano za pomocą analizy jednowymiarowej przy użyciu testu log-rank oraz analizy wielowymiarowej przy użyciu proporcjonalnego modelu zagrożeń Coxa. Wartość p mniejsza niż 0, 05 została uznana za statystycznie istotną.
wyniki
dla ogólnej populacji średnia wieku wynosiła 59 lat (zakres 25-85 lat), 57.2% stanowili mężczyźni. Chorobę III stopnia obserwowaliśmy u 53% chorych, spośród których 37,5% to pN2. Chemioterapię uzupełniającą otrzymywali wszyscy pacjenci w stadium III choroby (97,7% z oksaliplatyną). W stadium II choroby 53% chorych otrzymywało chemioterapię, w stadium pT4 u 22,5%, u 28% usunięto mniej niż 12 węzłów chłonnych, a u 15% chorych poddano zabiegowi chirurgicznemu. Średni TuS wynosił 7 cm .
w analizie ROC, AUC TuS w prognozowaniu przeżycia przedstawiono na fig.1. Wyniki TuS w przewidywaniu przeżycia porównano z wynikami w odniesieniu do liczby zaangażowanych węzłów chłonnych. AUC wynosiło 0.62 ± 0,048 dla TuS i 0,60 ± 0,56 dla dodatnich węzłów chłonnych.

rozmiar 4 cm zidentyfikowano jako predyktor przeżycia z czułością 88,2% i swoistością 59,2%. Obserwowaliśmy 98 pacjentów z TuS ≤4 cm i 159 pacjentów z tus powyżej 4 cm. U pacjentów z TuS większym niż 4 cm prawdopodobieństwo wystąpienia raka jelita grubego było większe (81,1 vs 70,4%, p = 0,002) i często pT4 (44 vs 22.4%, p = 0, 0001). Nie zaobserwowano istotnej różnicy w zależności od płci, operacji w nagłych wypadkach, liczby usuniętych węzłów chłonnych poniżej 12, liczby dodatnich węzłów chłonnych, stopnia zaawansowania i podawania oksaliplatyny pomiędzy pacjentami z TuS ≤4 cm a pacjentami z TuS powyżej 4 cm (Tabela 1).
| zmienne | wielkość guza ≤4 cm, % (n = 89) | wielkość guza > 4 cm, % (n = 159) | wartość p |
|---|---|---|---|
| wiek: | |||
| – Mediana (średnia) wieku – <65 lat – ≥65 lat |
56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| płeć: | |||
| – Mężczyzna – Kobieta |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| lokalizacja: | |||
| – Okrężnica – odbytnica |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| pogotowie chirurgiczne: | |||
| – tak – Nie |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 węzły chłonne zbadane§: | |||
| – tak – Nie |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡ (miesiące) | 26 | 34 | 0.13 |
†dostępny tylko u 168 pacjentów.
‡czas na nawrót.
§w obu etapach II i III.
*znaczące wartości P.
opublikowane za zgodą © Oxford University Press (2017).
OS był znamiennie lepszy w TuS ≤4 cm w porównaniu z tus większym niż 4 cm, średni czas przeżycia wynosił 158 w porównaniu z 106 miesiącami, współczynnik ryzyka = 2.92 (95% CI: 1,27-6,75, p = 0,01). 5-letni wskaźnik przeżycia pacjentów wynosił 84% u pacjentów z TuS ≤4 cm i 76% u pacjentów z tus powyżej 4 cm (P = 0, 008; patrz rycina 2).
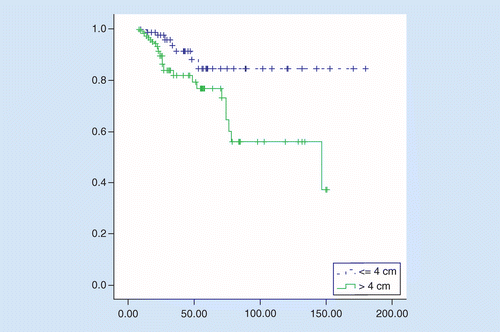
w obu grupach badano czynniki prognostyczne. W analizie jednowymiarowej zaobserwowano istotny zły wpływ wieku ≥65 lat, III stopnia, inwazji żylnej i pN + powyżej 3 na przeżycie u chorych z TuS powyżej 4 cm. Tylko w analizie wielowymiarowej, etap III był niezależnym czynnikiem prognostycznym. U pacjentów z TuS ≤4 cm chemioterapia w leczeniu adiuwantowym była głównymi czynnikami mającymi znaczący wpływ na przeżywalność w analizach jedno-i wielowymiarowych, nie stwierdzono wpływu prognostycznego pozostałych badanych czynników(Tabela 2).
| zmienne | wielkość guza< 4 cm (n = 159) | wielkość guza ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5-rok OS (%) | HR (95% CI) | 5-letni OS (%) | HR (95% CI) | |
| wiek: | ||||
| – <65 lat – ≥65 lat |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
*istotne wartości HR.
HR: współczynnik ryzyka; OS: całkowite przeżycie.
dyskusja
obecnie, w krajach zachodnich, integracja okultystycznych programów przesiewowych doprowadziła do diagnozy CRC na wcześniejszych etapach . W ostatnim badaniu opartym na danych SEER w latach 2006-2012, 38% przypadków raka jelita grubego i 43% przypadków raka odbytnicy zdiagnozowano na wczesnym etapie . W krajach o niskim średnim dochodzie taki program badań przesiewowych nie jest dostępny; a większość przypadków jest diagnozowana na etapie regionalnym lub zaawansowanym z wysokim TuS . Identyfikacja czynników prognostycznych jest ważnym narzędziem poprawy wyników w tych krajach. W naszym badaniu zbadano prognostyczną rolę TS w stadium II I III CRC w populacji tunezyjskiej. Zaobserwowaliśmy, że TuS ma nie tylko wpływ na przeżycie, ale także wpływa na inne czynniki prognostyczne. Stopień III był niezależnym czynnikiem prognostycznym w guzach o dużej objętości, podczas gdy wiele “klasycznych” czynników prognostycznych nie miało wpływu na mniejsze guzy. W kilku badaniach przedstawiono wartość prognostyczną TuS ze zmniejszonym czasem przeżycia związanym ze zwiększeniem TuS . W badaniu przeprowadzonym przez Kornprat et al., TuS był istotnie związany z przeżywalnością wolną od progresji i specyficzną dla nowotworu w analizach jedno-i wielowymiarowych w raku jelita grubego, ale nie w raku odbytnicy . W naszej serii wyższy TuS był bardziej powszechny w lokalizacji raka jelita grubego. W rzeczywistości rak jelita grubego może pozostać bezobjawowy przez dłuższy czas, co wyjaśnia wyższy TuS w diagnozie w porównaniu z rakiem odbytnicy. Nie stwierdzono jednak różnicy w przeżywalności pomiędzy guzami o długości ≥4 cm zlokalizowanymi w okrężnicy a guzami o długości ≥4 cm zlokalizowanymi w odbytnicy. Nie stwierdzono również wpływu lokalizacji guza w mniejszym guzie (<4 cm). W oparciu o tę analizę TuS nie odegrał roli w przewidywaniu rokowania na podstawie lokalizacji guza (okrężnica vs odbytnica). Saha i in. w dużej grupie pacjentów stwierdzono, że TuS jest pozytywnie skorelowany z ważnymi czynnikami prognostycznymi i negatywnie wpływa na przeżywalność w raku jelita grubego . Jego rola w raku odbytnicy nie jest jeszcze jasna.
wyższy TuS był również związany z etapem pT4, zgłaszano najgorsze rokowanie niż etap T1-2N1 (badanie międzygrupowe INT-0089). Obciążenie nowotworu może odzwierciedlać zdolność guza do rozprzestrzeniania się przez ścianę jelita, węzłów i innych narządów. W rzeczywistości, w naszym badaniu, tus miał predykcyjną wartość analizy ROC zbliżoną do wartości predykcyjnej liczby dodatnich limfocytów. W guzach mniejszych niż 4 cm nie zaobserwowano różnicy w przeżywalności pomiędzy pacjentami w stadium II i III. Stwierdzenie to można wyjaśnić faktem, że nasza populacja w II etapie była populacją wysokiego ryzyka o gorszym rokowaniu( zbliżonym do prognozy w III etapie): wiele stadiów pT4, wiele przypadków z mniej niż 12 usuniętymi węzłami chłonnymi, wiele przypadków operowanych w nagłych wypadkach (perforacja i niedrożność). W dwóch badaniach opartych na danych, mniejsze guzy miały gorsze rokowanie, czyli stadium II choroby. Autorzy wysunęli hipotezę, że mały TuS może być zastępczym markerem agresywności biologicznej, co skutkuje gorszym wynikiem w porównaniu ze stosunkowo większym TuS wśród etapu II . Te same obserwacje zaobserwowano we włoskim badaniu . Zbadaliśmy również rolę kilku czynników prognostycznych według TuS. Zaobserwowaliśmy, że kilka czynników prognostycznych, takich jak wiek, stopień zaawansowania, liczba zaangażowanych węzłów chłonnych, lokalizacja guza nie miało znaczącego wpływu w grupie pacjentów z niskim TuS. W naszym badaniu chemioterapia adiuwantowa miała pozytywny wpływ na małe guzy, czy TuS należy uznać za czynnik “wysokiego ryzyka”w stadium II? Potrzebne są dalsze badania skupiające się na tej konkretnej kwestii.
kilka pułapek można zauważyć w naszej serii: niewielki rozmiar próby, retrospektywne zbieranie danych i brak centralnego przeglądu raportu patologicznego w celu dokładnej oceny TS. Nie mieliśmy wystarczających dostępnych danych na temat dokładnej lokalizacji guza, więc nie mogliśmy przeprowadzić takiej analizy. Badania molekularne zostały wprowadzone w Tunezji w 2015 roku, w okresie badań nie były dostępne. Ocena TuS w zależności od stopnia zaawansowania i podawania oksaliplatyny nie została przeprowadzona dla zbyt małej liczby pacjentów, aby wyciągnąć wnioski.
wniosek
TuS jest obiektywnym parametrem, który można łatwo zmierzyć podczas badania patologicznego. Może stanowić dodatkowy czynnik prognostyczny w populacji o wysokim wskaźniku Stadium lokalnie Zaawansowanego.
perspektywy na przyszłość
Kilka i złożonych aletraion genetycznych i / lub ścieżek może być za TuS w raku jelita grubego, analiza molekularna biorąc pod uwagę wielkość guza może prowadzić do dokładniejszych wyjaśnień w jego prognostycznej roli.
finansowe & ujawnienie interesów konkurencyjnych
autorzy nie mają żadnych istotnych powiązań ani finansowego zaangażowania z jakąkolwiek organizacją lub podmiotem, którego interes finansowy lub konflikt finansowy dotyczy przedmiotu lub materiałów omawianych w manuskrypcie. Obejmuje to zatrudnienie, konsultacje, honoraria, własność akcji lub opcji, ekspertyzy, dotacje lub patenty otrzymane lub oczekujące, lub tantiemy.
przy tworzeniu tego rękopisu nie wykorzystano pomocy pisarskiej.
etyczne prowadzenie badań
autorzy oświadczają, że uzyskali odpowiednią akceptację instytucjonalnej komisji rewizyjnej lub przestrzegali zasad określonych w deklaracji Helsińskiej dla wszystkich badań doświadczalnych na ludziach i zwierzętach. Ponadto w przypadku badań z udziałem ludzi uzyskano świadomą zgodę od zaangażowanych uczestników.
- 1 Torre LA, Bray F, Siegel RL et al. Global cancer statistics, 2012. OK. Rak J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Rak jelita grubego w środkowej Tunezji: wzrost częstości występowania w okresie 15 lat. Asian Pac. J. Cancer Prev. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi a, Parkin DM et al. Trendy w zachorowalności na raka w regionie Sousse, Tunezja, 1993-2006. Int. J. Rak 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 Yang J, Du XL, Li ST et al. Charakterystyka inaczej zlokalizowanych nowotworów jelita grubego potwierdza klasyfikację proksymalną i dystalną: badanie populacyjne z udziałem 57 847 pacjentów. PLoS ONE 11 (12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang h et al. Wpływ wielkości guza na przeżycie chorych na raka żołądka pT4aN0M0. Am. Operacja. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. Wpływ wielkości guza na rokowanie u chorych na raka jelita grubego. Zhonghua Wei Chang Wai KE Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Mniejszy rozmiar guza jest związany ze słabą przeżywalnością w stadium II raka jelita grubego: analiza 7719 pacjentów w bazie danych SEER. Int. J. Surg. Lond. Engl. 33 (Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier JE, McMillan DC, McArdle CS et al. Wielkość guza jest związana z ogólnoustrojową odpowiedzią zapalną, ale nie przeżycie u pacjentów z pierwotnym operacyjnym rakiem jelita grubego. J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta GD et al. Wczesny rak jelita grubego: wytyczne praktyki klinicznej ESMO w zakresie diagnostyki, leczenia i obserwacji. Ann. Oncol. 24(Suppl. 6), VI64–VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Church TR, Bond JH et al. Wpływ badań przesiewowych krwi utajonej w kale na częstość występowania raka jelita grubego. N. Engl. J. Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Statystyki raka jelita grubego, 2017. CA Cancer J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer a, Rehak P, Langner C. Value of tumor size as a prognostic variable in colorectal cancer: a critical reapraisal. Am. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. Wielkość guza przewiduje długoterminowe przeżycie w raku jelita grubego: analiza krajowej bazy danych na temat raka. Am. J. Surg. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon AL et al. Przeżycie raka jelita grubego jest związane ze wzrostem liczby analizowanych węzłów chłonnych: wtórne badanie badania Intergrupy INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Niekorzystny wpływ małych rozmiarów guza na przeżycie specyficzne dla przyczyny w stadium IIA raka jelita grubego, badanie oparte na widzeniu. Int. J. Colorectal Dis. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi a, Cananzi FCM et al. Wielkość guza jako czynnik prognostyczny u pacjentów z rakiem okrężnicy w stadium IIa. Am. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar