zakażenie wirusem cytomegalii (CMV) u pacjentów z HIV/AIDS i wartości diagnostyczne CMV-wykrywanie DNA w różnych typach próbek
- wprowadzenie
- metody
- tematy
- włączenie i wykluczenie
- odczynniki i sprzęt
- oznaczanie ilościowe HIV-RNA
- liczenie limfocytów T CD4 +
- oznaczanie ilościowe CMV-DNA
- test przeciwciał CMV
- metody badań
- wykrywanie kwasu nukleinowego
- wykrywanie podgrup limfocytów T
- wykrywanie przeciwciał immunologicznych
- analiza statystyczna
- wyniki
- Dane ogólne
- dodatnie wskaźniki CMV-DNA, CMV-IgG i CMV-IgM
- korelacja między zakażeniem CMV a liczbą limfocytów T CD4+
- wykrywanie CMV-DNA w różnych próbkach
- dyskusja
- wnioski
- podziękowania
- przypis
wprowadzenie
wirus cytomegalii (CMV) jest powszechnym herpeswirusem, który jest szeroko rozpowszechniony w populacjach ludzi. Zakażenie CMV zwykle nie powoduje objawów i dotyczy głównie gruczołów ślinowych, nerek i innych narządów. Jednak replikacja wirusa może wystąpić u pacjentów z obniżoną odpornością i może przyczyniać się do uszkodzenia narządów i ich funkcji. Zakażenia oportunistyczne są częstsze i cięższe u pacjentów z HIV/AIDS. Zakażenie wirusem CMV jest powszechne u tych pacjentów i może wpływać na wiele narządów / układów, w tym na oczy, płuca, układ nerwowy i układ trawienny. W wielu badaniach zbadano cechy wirusologiczne i immunologiczne prostej infekcji CMV (1), zwłaszcza te występujące u kobiet i dzieci. Cechy immunologiczne zakażenia CMV są jednak dość unikalne u pacjentów z obniżoną odpornością HIV / AIDS. Istnieją różnice w charakterystyce klinicznej, sposobie leczenia, czynnikach prognostycznych pomiędzy pacjentami zakażonymi wirusem HIV z zakażeniem CMV a pacjentami z samym zakażeniem CMV (2). Wytyczne Chin zalecają natychmiastową terapię przeciwwirusową CMV i ART u pacjentów z HIV / AIDS z powikłaniami (zapalenie siatkówki, zapalenie płuc, zapalenie mózgu CMV, zapalenie jelit itp.) w przypadku stwierdzenia zakażenia CMV. Ze względu na niespecyficzność objawów klinicznych wywołanych zakażeniem CMV, badanie laboratoryjne jest główną podstawą rozpoznania zakażenia CMV. Najbardziej dwie powszechnie stosowane metody kliniczne to replikacja wirusa CMV i metody immunologiczne w surowicy, w tym wykrywanie CMV IgG, CMV IgM i antygenu CMV PP65 (2) u pacjentów z upośledzoną czynnością immunologiczną, wytwarzanie przeciwciał CMV jest osłabione lub opóźnione, co może prowadzić do fałszywie ujemnego wyniku i zwiększyć szybkość nieodebranej diagnozy, w związku z czym wykrywanie CMV-DNA metodą PCR stało się w dużej mierze standardową metodą diagnozowania zakażenia CMV i monitorowania leczenia (3). Daisuke Mizushima et al. stwierdzono, że CMV-DNA PCR w osoczu ma ważną wartość w diagnostyce zarówno CMV-EOD, jak i CMV-EOD u pacjentów z zaawansowanym zakażeniem HIV-1 (4). CMV – DNA PCR można wykryć w różnych typach próbek, takich jak osocze, mocz, płyn mózgowo-rdzeniowy, wodnisty humor, kał itp. (5). Jednak w kilku artykułach przeanalizowano i omówiono znaczenie i wartość wykrywania PCR CMV-DNA w próbkach innych niż osocze. W niniejszym badaniu retrospektywnie przeanalizowano testy laboratoryjne (w tym CMV-DNA, przeciwciało CMV, limfocyty T CD4+, miano wirusa HIV itp.) u 808 pacjentów z HIV/AIDS, którzy byli leczeni w naszym centrum w latach 2017-2019 w celu zrozumienia koinfekcji CMV oraz mocnych i słabych stron kilku metod wykrywania. Przedstawiamy poniższy artykuł / przypadek zgodnie z listą kontrolną raportowania MDAR (dostępną pod adresem http://dx.doi.org/10.21037/apm-20-1352).
metody
tematy
w okresie od stycznia 2017 r.do października 2019 r. w naszym centrum przyjęto łącznie 808 pacjentów zakażonych HIV/AIDS. U każdego pacjenta oznaczono HIV-RNA, liczbę limfocytów T CD4+, CMV-DNA i pokrewne przeciwciała. Diagnozę zakażenia HIV oparto na wytycznych dotyczących diagnostyki i leczenia HIV/AIDS (wydanie trzecie) (6), a wszyscy pacjenci zostali potwierdzeni jako zakażeni HIV przez Fuzhou Municipal Centers for Disease Control (CDC) lub lokalne CDC, które leczyły pacjenta. Rozpoznanie zakażenia CMV opierało się na następujących kryteriach: (i) CMV-dodatni wynik dna w osoczu, płynie do płukania pęcherzyków płucnych, moczu, płynie mózgowo-rdzeniowym (CSF) i/lub innych płynach ustrojowych; (II) CMV-immunoglobulina m (IgM) w surowicy; (III) okulistyczna diagnoza zapalenia siatkówki CMV; (IV) CMV zapalenie płuc objawiające się głównie jako gorączka, kaszel, flegma i ucisk w klatce piersiowej; CMV-DNA dodatnie w płynie do płukania pęcherzyków płucnych; (V) CMV zapalenie jelit lub przełyku objawiające się głównie jako dysfagia/ból połykania, biegunka lub ból brzucha i skuteczne diagnostyczne leczenie anty-CMV; (VI) CMV zapalenie mózgu objawiające się jako objawy ze strony układu nerwowego i CMV-DNA dodatnie w płynie mózgowo-rdzeniowym lub tkance mózgowej; (VII) CMV zapalenie wątroby objawiające się gorączką, nieprawidłową czynnością wątroby i dyskomfortem w okolicy wątroby oraz CMV-DNA pozytywne w biopsji wątroby. Rozpoznanie zakażenia CMV zostało postawione, jeżeli spełnione zostało którekolwiek z powyższych kryteriów z wyjątkiem ppkt (II) lub jeżeli ppkt (II) oraz jakiekolwiek inne kryterium zostało spełnione (7).
wszystkie procedury przeprowadzone w tym badaniu z udziałem ludzi były zgodne z deklaracją Helsińską (zaktualizowaną w 2013 r.). Badanie zostało zatwierdzone przez Komisję Etyki Lekarskiej naszego centrum (aprobata nr 101). KS2019-070-01). Dane są anonimowe i w związku z tym zrezygnowano z wymogu świadomej zgody.
włączenie i wykluczenie
kryteria włączenia: pacjenci z HIV / AIDS, którzy po raz pierwszy odwiedzili Mengchao Hepatobiliary Hospital of Fujian Medical University i ukończyli wykrywanie HIV-RNA, CMV-DNA, przeciwciał CMV-IgG, przeciwciał CMV-IgM i limfocytów T CD4 + w ciągu 14 dni. Wyklucz przypadki HIV / AIDS, które nie mogą ukończyć powyższych elementów testowych z powodu niewystarczającej wielkości próbki.
odczynniki i sprzęt
oznaczanie ilościowe HIV-RNA
fluorescencyjną ilościową reakcję łańcuchową polimerazy w czasie rzeczywistym (PCR) (FQ-PCR) przeprowadzono na systemie QPCR Mx3000p (Agilent, USA) przy użyciu zestawu do oznaczania ilościowego HIV-RNA produkowanego przez QiaGen (Shenzhen, Chiny).
liczenie limfocytów T CD4 +
przyrządem był Cytometr przepływowy FACSCalibur (BD Biosciences, USA), a zestaw odczynników BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, USA).
oznaczanie ilościowe CMV-DNA
FQ-PCR przeprowadzono na systemie QPCR Mx3000p (Agilent, USA) w celu wykrycia poziomów CMV-DNA w osoczu, moczu i płynie mózgowo-rdzeniowym. Używany zestaw został wyprodukowany przez Sansure Biotech (Hunan, Chiny).
test przeciwciał CMV
przeprowadzono Chemiluminescencyjny test immunologiczny w celu wykrycia przeciwciał anty-CMV-IgG i IgM na analizatorze Cobas e601 (Roche Diagnostics, Niemcy) z zestawami pomocniczymi (Roche Diagnostics, Niemcy).
metody badań
wykrywanie kwasu nukleinowego
po przyjęciu pacjentów z HIV/AIDS do naszego szpitala zebrano 3 mL antykoagulowanego kwasu etylenodiaminotetraoctowego (EDTA), a następnie odwirowano w temperaturze 3000 r/min przez 5 minut, aby zebrać 200 µL osocza do wykrywania HIV-RNA i CMV-DNA. U wszystkich pacjentów rano pobrano 5 mL próbki moczu i dokładnie wymieszano, a następnie zebrano 200 µL w celu wykrycia CMV-DNA. U pacjentów z objawami neurologicznymi uzyskano 1 mL płynu mózgowo-rdzeniowego w celu wykrycia CMV-DNA. Zgodnie z limitem wykrywalności i pozytywnym standardem oceny CMV-DNA kit i HIV-RNA kit. Próbki uznano za dodatnie, jeśli wartość CMV-DNA wynosiła powyżej 400 kopii/mL lub jeśli poziom HIV-RNA wynosił powyżej 500 kopii/mL.
wykrywanie podgrup limfocytów T
u pacjentów z HIV/AIDS podczas przyjęcia pobrano 3 mL próbki pełnej krwi przeciwzakrzepowej EDTA na czczo, a następnie dokładnie wymieszano w celu wykrycia podgrupy limfocytów T za pomocą CYTOMETRU przepływowego BD FACSCalibur przy użyciu pomocniczych odczynników.
wykrywanie przeciwciał immunologicznych
u pacjentów z HIV/AIDS pobrano 3 mL próbki krwi na czczo przy przyjęciu, odwirowano z prędkością 3000 obr/min przez 5 minut w probówce surowicy z separatorem żelowym, a następnie przetestowano na maszynie.
wszystkie powyższe badania przeprowadzono ściśle zgodnie z instrukcją odczynnika zawartą w instrukcji producenta i standardowymi procedurami obsługi przyrządów.
analiza statystyczna
analiza statystyczna została przeprowadzona przy użyciu oprogramowania SPSS 21.0. Normalnie rozłożone dane pomiarowe są prezentowane przy użyciu średniej ± odchylenia standardowego (x ±SD), a dane nieujęte normalnie są wyrażone jako mediana (25-75 percentyli). Dane liczbowe są wyrażone w procentach i stawkach. Porównanie nieregulaminowych danych pomiarowych między dwiema grupami przeprowadzono za pomocą nieparametrycznego testu sumy Rang, natomiast dane liczbowe porównano za pomocą testu Chi-kwadrat. Wartość P <0, 05 została uznana za statystycznie istotną.
wyniki
Dane ogólne
Dane ogólne dotyczące 808 pacjentów z HIV/AIDS przedstawiono w tabeli 1. Płeć i wiek nie wykazały istotnej różnicy między grupą CMV a grupą bez CMV. Bezwzględna liczba CD4 w grupie zakażonej CMV była istotnie mniejsza niż w grupie niezakażonej CMV (z=-8, 87, P<0, 001), a poziom HIV-RNA był istotnie wyższy w grupie zakażonej CMV niż w grupie nie zakażonej CMV (z = -3, 207, P<0, 05) (Tabela 1).
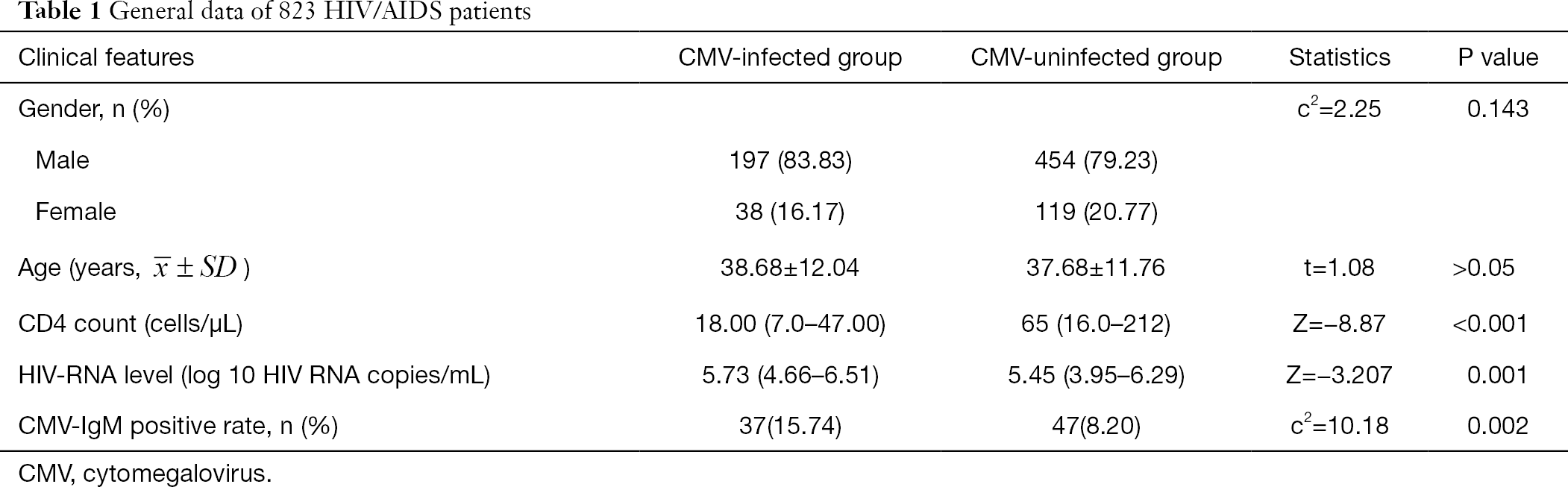
pełna tabela
dodatnie wskaźniki CMV-DNA, CMV-IgG i CMV-IgM
całkowity dodatni wskaźnik CMV-DNA wynosił 29,08% (235/808 26, 01% (77 / 296) w osoczu i 25, 75% (180 / 699) w moczu. Dodatni wskaźnik CMV-IgG wynosił 99,8% (806/808), a dodatni wskaźnik CMV-IgM wynosił 10,40% (84/808).
korelacja między zakażeniem CMV a liczbą limfocytów T CD4+
po zgrupowaniu liczby limfocytów T CD4+ stwierdziliśmy, że odsetek pacjentów zakażonych wirusem cytomegalii przy niskiej częstości występowania limfocytów T CD4+ był większy niż u pacjentów zakażonych bez CMV. Częstość występowania zakażenia CMV zwiększała się wraz ze zmniejszeniem liczby CD4 (Tabela 2).
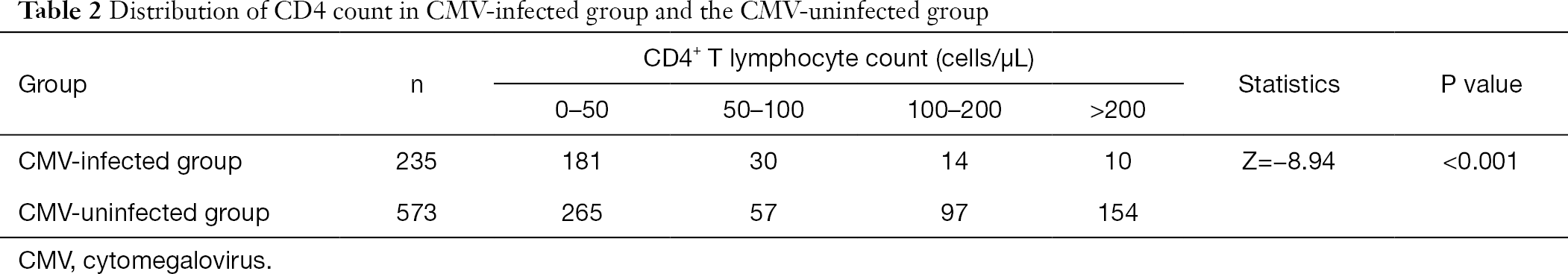
pełna tabela
wykrywanie CMV-DNA w różnych próbkach
spośród tych 808 pacjentów, 198 pacjentów otrzymało również testy na obecność CMV-DNA w osoczu i moczu oraz przeciwciał przeciwko-przeciwciała CMV-IgG i CMV-IgM. Wykorzystując analizę chi-kwadrat dla sparowanych danych, przeprowadziliśmy parowe porównanie CMV-DNA moczu i CMV-DNA osocza z przeciwciałem CMV-IgM osocza, odpowiednio. Stwierdzono, że wyniki wykrywania CMV-dna w moczu i osoczu znacznie różniły się od wyników badania przeciwciał CMV-IgG w osoczu (P<0, 001), podczas gdy wyniki wykrywania CMV-DNA w osoczu nie różniły się znacząco od wyników badania CMV-DNA w moczu (P>0, 05) (tabele 3,4).

pełna tabela
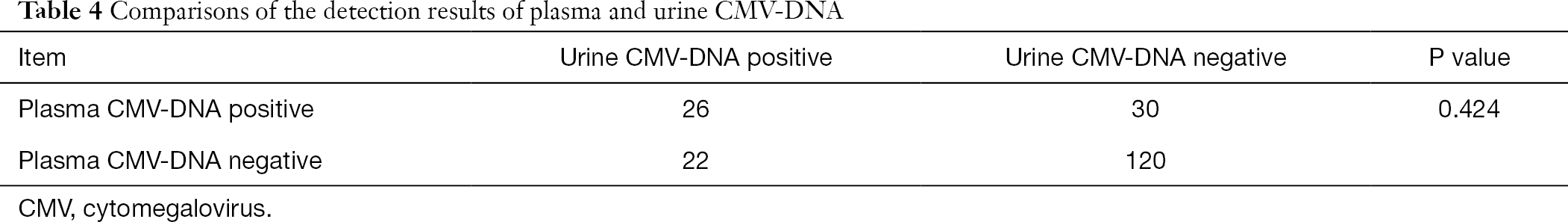
pełna tabela
dyskusja
CMV należy do grupy β-wirusa opryszczki i charakteryzuje się ścisłą swoistością gatunkową i powszechną częstością występowania w populacjach ludzi. Seroprewalencja CMV wynosi około 85% u dzieci i do 95% u dorosłych. W naszym obecnym badaniu pozytywny wskaźnik CMV-IgG osiągnął 99,8%. CMV jest w większości przypadków utajone, ale u osób z obniżoną odpornością wirus replikuje się wykładniczo i rozprzestrzenia się po całym ciele wraz z krwią, powodując wiremię CMV, a nawet organiczną chorobę CMV (8). Zakażenie CMV jest jednym z częstych zakażeń oportunistycznych u pacjentów z HIV / AIDS. Limfocyty T CD4+ są komórkami docelowymi wirusa HIV, a ich liczba może często odzwierciedlać przebieg AIDS i może być również stosowana jako wskaźnik do oceny stanu immunologicznego pacjentów z AIDS. W badaniu tym analizowano zakażenie CMV, liczbę CD4 i poziom HIV-RNA u 808 pacjentów z HIV / AIDS. Stwierdziliśmy, że dodatni wskaźnik CMV u pacjentów z AIDS zwiększał się wraz ze zmniejszeniem liczby CD4 i wzrostem miana wirusa HIV. Również w naszym obecnym badaniu do 77,02% pacjentów z CMV dodatnim miało liczbę CD4 <50 komórek/µL, co sugeruje, że CD4 < 50 komórek/µL jest czynnikiem ryzyka koinfekcji HIV-CMV, co jest zgodne z ustaleniami Deng i wsp. (9). Ilościowy poziom HIV – RNA w grupie zakażonej CMV był wyższy niż w grupie NIEZAKAŻONEJ CMV, co pośrednio sugerowało, że wysoki poziom miana wirusa HIV-RNA jest kolejnym czynnikiem ryzyka zakażenia CMV u pacjentów z HIV/AIDS .Dlatego zaleca się, aby pacjenci z HIV/AIDS jak najszybciej rozpoczęli leczenie ART w celu pobudzenia odbudowy odporności w celu zapobiegania zakażeniom oportunistycznym, a badania przesiewowe w kierunku HCMV są niezbędne u pacjentów z HIV/AIDS z liczbą CD4 <50 komórek/µL (2).
oceniliśmy również wartości testów wirusowego kwasu nukleinowego i metod immunologicznych w klinicznym wykrywaniu zakażenia CMV. Badania w Chinach i na świecie wykazały, że CMV-DNA pojawia się wcześniej niż objawy kliniczne i reakcje serologiczne zakażeń CMV. FQ-PCR jest obecnie najbardziej dokładną i szybką metodą ilościowego oznaczania drobnoustrojów i jest w stanie przezwyciężyć pewne problemy związane z tradycyjnym PCR (np. zanieczyszczenie produktem amplifikacji i brak ilościowego oznaczania) (10). W naszym obecnym badaniu dodatni wskaźnik CMV-DNA wynosił 5.70% (13/228) w próbkach płynu mózgowo-rdzeniowego u 228 pacjentów z objawami neurologicznymi, co było znacznie mniejsze niż w próbkach osocza i moczu, co można tłumaczyć barierą krew-mózg i wrażliwością narządową. Przeciwciało anty-CMV-IgM jest często stosowane jako marker aktywnej infekcji wirusowej; jednak dodatni wskaźnik przeciwciał anty-CMV-IgM wynosił tylko 10,40% (84/808) u naszych pacjentów z HIV/AIDS, co było niższe niż dodatni wskaźnik zakażenia CMV odnotowany w populacjach innych niż HIV/AIDS (11). Ponadto jego pozytywny wskaźnik miał słabą zgodność z wynikami wykrywania kwasu nukleinowego, co może być spowodowane osłabionym układem odpornościowym lub opóźnionym wytwarzaniem przeciwciał IgM u pacjentów z HIV/AIDS. Dlatego wykrywanie przeciwciał CMV-IgM ma ograniczoną rolę w badaniach przesiewowych HCMV u pacjentów z HIV / AIDS. Ponadto dodatni wskaźnik zakażenia CMV u 808 pacjentów wyniósł 29,05% (235/808) w naszym obecnym badaniu, co jest nieco wyższe niż 21,85% zgłoszone przez Li i wsp. i może wynikać z większej różnorodności próbek (w tym osocza, moczu i płynu mózgowo-rdzeniowego) zebranych w tym badaniu (12). Dodatni wskaźnik CMV-DNA wynosił 25,57% w moczu i 26,01% w osoczu, różnica nie była statystycznie istotna. W związku z tym zaleca się przeprowadzenie badań przesiewowych CMV-DNA w osoczu i moczu, gdy liczba limfocytów T CD4+ jest mniejsza niż 200 komórek/µL, zwłaszcza gdy <50 komórek/µL; ponadto wymagane jest wykrycie CMV-DNA w płynie mózgowo-rdzeniowym, jeśli występują oczywiste objawy neurologiczne.
wnioski
podsumowując, mała liczba limfocytów T CD4+ i wysokie miano wirusa HIV-1 są czynnikami ryzyka zakażenia CMV u pacjentów z HIV/AIDS. Wykrywanie CMV-DNA w moczu lub osoczu za pomocą FQ-PCR jest bardzo cenne w przesiewowych zakażeniach CMV u pacjentów z HIV/AIDS, podczas gdy wykrywanie poziomów CMV IgG i CMV IgM we krwi ma ograniczoną wartość kliniczną. Badanie krwi lub moczu CMV-DNA jest zalecane u pacjentów z AIDS w celu zapobiegania i wczesnego diagnozowania zakażenia CMV i poprawy jakości życia.
podziękowania
finansowanie: sponsorowane przez Key Clinical Specialty Discipline Construction Program of Fujian, P. R. C.
przypis
Lista kontrolna raportowania: autorzy wypełnili listę kontrolną raportowania MDAR. Dostępne pod adresem http://dx.doi.org/10.21037/apm-20-1352
Oświadczenie o udostępnianiu danych: dostępne pod adresem http://dx.doi.org/10.21037/apm-20-1352
konflikty interesów: wszyscy autorzy wypełnili jednolity formularz ujawnienia informacji ICMJE (dostępny pod adresem http://dx.doi.org/10.21037/apm-20-1352). Autorzy nie mają żadnych konfliktów interesów do zadeklarowania.
oświadczenie etyczne: autorzy są odpowiedzialni za wszystkie aspekty pracy, zapewniając, że pytania związane z dokładnością lub integralnością jakiejkolwiek części pracy są odpowiednio badane i rozwiązywane. Wszystkie procedury przeprowadzone w tym badaniu z udziałem ludzi były zgodne z deklaracją Helsińską (zaktualizowaną w 2013 r.). Badanie zostało zatwierdzone przez Komisję Etyki Lekarskiej naszego centrum (aprobata nr 101). KS2019-070-01). Dane są anonimowe i w związku z tym zrezygnowano z wymogu świadomej zgody.
Oświadczenie o otwartym dostępie: jest to artykuł o otwartym dostępie rozpowszechniany zgodnie z licencją Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), która pozwala na niekomercyjną replikację i dystrybucję artykułu ze ścisłym zastrzeżeniem, że nie są dokonywane żadne zmiany ani zmiany, a oryginalna praca jest prawidłowo cytowana (w tym linki do formalnej publikacji za pośrednictwem odpowiedniego DOI i licencji). Zobacz: https://creativecommons.org/licenses/by-nc-nd/4.0/
- Yu X, Tong m, He G. Wpływ zakażenia wirusem cytomegalii na komórki odpornościowe regulatorów u kobiet w ciąży Chińskich. Journal of Nosocomiology. 2017;27:2103-6.
- główny projekt National Science and Technology wspomaga grupę badawczą ds. zakażeń oportunistycznych podczas 13.planu pięcioletniego. Konsensus ekspertów w sprawie diagnostyki klinicznej i leczenia AIDS powikłanych chorobą cytomegalii .
- Hodowanec AC, Pikis a, Komatsu TE, et al. Leczenie i zapobieganie chorobie CMV u biorców przeszczepów: aktualna wiedza i perspektywy na przyszłość. J Clin Pharmacol 2019; 59: 784-98.
- Mizushima D, Nishijima T, Yashiro s, et al. Zastosowanie diagnostyczne ilościowego PCR DNA cytomegalii w osoczu w chorobach końcowych narządów cytomegalii u pacjentów z zakażeniem HIV-1. J Acquir Immune Defic Syndr 2015; 68:140-6.
- Michaelides a, Liolios L, Glare EM, et al. Zwiększone obciążenie DNA ludzkim wirusem cytomegalii (HCMV) w leukocytach krwi obwodowej po przeszczepieniu płuc koreluje z zapaleniem płuc HCMV. Transplantation 2001; 72: 141-7.
- zakażenie neurologii, Grupa AIDS Chińskiego Stowarzyszenia Medycznego. Wytyczne diagnostyki i leczenia HIV/AIDS (wydanie trzecie). Chinese Journal of Infectious Diseases 2015; (10): 577-93.
- Corrales I, Giménez E, Solano C, et al. Częstość i dynamika aktywnego zakażenia wirusem cytomegalii u pacjentów po przeszczepieniu allogenicznych komórek macierzystych według polimorfizmów pojedynczego nukleotydu w genach CCR5, MCP-1, IL-10 i TLR9 dawcy i biorcy. J Med Virol 2015; 87: 248-55.
- Tagarro A, Del Valle R, Dominguez-Rodríguez S, et al. Wzorce wzrostu u dzieci z wrodzonym zakażeniem wirusem cytomegalii. Pediatr Infect Dis J 2019; 38: 1230-5.
- Deng X, Liu J, Zhang M, et al. Analiza cech wirusologicznych i immunologicznych HIV / AIDS w połączeniu z zakażeniem wirusem cytomegalii. Chinese Journal of Hospital Infection 2019;29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analiza krążących ludzkich i wirusowych mikroRNA sin pacjentów z wrodzonym zakażeniem wirusem cytomegalii. J Perinatol 2016; 36:1101-5.
- Li L, Gao S, Zhang T, et al. Porównanie wykrywalności DNA i wykrywalności IgM infekcji ludzkim wirusem cytomegalii oraz omówienie ich łącznej wartości zastosowania. Chinese Journal of Experimental Diagnostics 2015; (1): 78-80.
- Li X, cao L, Yu C, et al. Badanie dotyczące zakażenia wirusem cytomegalii u pacjentów z AIDS. Nowoczesna Profilaktyka 2012;39:2278-9.
(English Language Editor: J. Gray)