Prognostischer Wert der Tumorgröße im Stadium II und III Darmkrebs in der tunesischen Bevölkerung
-
Es wurde berichtet, dass die Tumorgröße (TuS) bei Darmkrebs prognostisch ist.
-
In unserer Studie untersuchten wir die prognostische Rolle von TuS und identifizierten einen Grenzwert mit der höchsten Vorhersageleistung.
-
Eine Größe von 4 cm hatte prognostische Auswirkungen und beeinträchtigte andere prognostische Faktoren.
-
Wir beobachteten, dass Alter ≥65 Jahre, Stadium III, venöse Invasion und pN + größer als 3 signifikante schlechte prognostische Faktoren bei Patienten mit TuS ≥ 4 waren, aber nur Stadium III war ein unabhängiger prognostischer Faktor in multivariater Analyse.
-
Die Verabreichung einer Chemotherapie war der einzige Faktor mit signifikantem Einfluss auf das Überleben in univariaten und multivariaten Analysen bei Patienten mit TuS weniger als 4 cm.
Darmkrebs (CRC) ist die dritthäufigste Krebserkrankung weltweit und die zweithäufigste krebsbedingte Todesursache in westlichen Ländern . In Tunesien stellt es ein Problem der öffentlichen Gesundheit dar. Die Inzidenz hat in den letzten 15 Jahren zugenommen . Trotz der Verbesserung der Diagnose– und Aufarbeitungsverfahren und auch aufgrund fehlender Screening-Programme bleiben die meisten CRC-Fälle in Tunesien in einem lokal fortgeschrittenen (pT3-T4, knotenpositiv) oder metastasierten Stadium nachgewiesen . Die Prognose wurde in den letzten Jahren mit multidisziplinärem Management verbessert; Das 5-Jahres-Gesamtüberleben (OS) wird im Stadium II auf etwa 70% und im Stadium III auf 50% geschätzt . Es wurden viele Anstrengungen unternommen, um die Risikobewertungsfaktoren bei CRC zu verfeinern, um Patienten zu identifizieren, die am wahrscheinlichsten von einer adjuvanten Therapie profitieren. Diese Faktoren sind hauptsächlich klinisch, pathologisch und kürzlich molekular (Mikrosatelliteninstabilität / Mikrosatellitenstabilität, cDNA), einige von ihnen sind in vielen Ländern noch unerreichbar. Die Tumorgröße (TuS) ist ein Ersatzmarker für das Überleben bei vielen Magen-Darm-Krebsarten: Magenkrebs, Magen-Darm-Stromatumor, Karzinoidtumoren . Seine Relevanz in CRC ist unklar, mit widersprüchlichen Ergebnissen in mehreren Berichtsserien . TuS integrierte keine internationalen Richtlinien als einen der Marker, die bei der Beurteilung des Risikos und der Indikation einer adjuvanten Chemotherapie zu berücksichtigen sind . In einer kürzlich durchgeführten Studie mit pathologischer Beurteilung von 1443 neuen Fällen von CRC in der Zentralregion Tunesiens hatten 67,5% der Patienten einen TuS von mehr als 5 cm. In unserer aktuellen Studie, Wir wollten die Leistung von TuS bei der Vorhersage des Überlebens in den Stadien II und III CRC untersuchen und die Beziehung zwischen TuS und bekannten prognostischen Faktoren untersuchen.
Patienten & Methoden
Wir überprüften retrospektiv eine Kohorte von 257 Patienten mit der Diagnose Kolon- und / oder Rektaladenokarzinom, die zwischen 2003 und 2014 in zwei onkologischen Zentren behandelt wurden: Abderrahmen Mami Hospital und Clinique Taoufik Hospital. Wir schlossen Stadium II-III Fälle, nach dem American Joint Committee on Cancer (AJCC) / Union Internationale Contre le Cancer (UICC) 7. Auflage, mit kurativer Absicht behandelt. Wir betrachteten nur Patienten mit vollständiger Aufarbeitung und verfügbaren Pathologiedaten einschließlich TuS- und Follow-up-Daten. In der Studienzeit wurde das Follow-up nach Abschluss der kurativen Therapie alle 3-4 Monate in den ersten 2 Jahren, alle 6 Monate von den Jahren 3 bis 5 und danach jährlich programmiert. Bei jedem Besuch wurden die Patienten einer körperlichen Untersuchung unterzogen und auf Symptome und Therapietoxizitäten untersucht. Abdominaler Ultraschall und Röntgenaufnahme des Brustkorbs wurden alle 6 Monate durchgeführt, ab 2012 thorakoabdominaler CT-Scan und Tumormarker (karzinoembryonales Antigen, CA19–9) alle 6 Monate.
TuS wurde definiert als die horizontale Tumorausdehnung gemessen am maximalen Tumordurchmesser. Wir haben die Empfänger-Betriebscharakteristik (ROC) verwendet, um die TuS-Leistung bei der Vorhersage des Überlebens zu bestimmen und einen mit dem Überleben korrelierten Grenzwert zu identifizieren. Wir verglichen auch die Eigenschaften der beiden Gruppen nach dem Cutoff-Wert und untersuchten prognostische Faktoren in univariaten und multivariaten Analysen in jeder Gruppe.
Statistische Analyse
Alle Analysen wurden mit der Software SPSS 20 durchgeführt. Wir analysierten ROC-Kurven und analysierten die Fläche unter der Kurve (AUC), um die Genauigkeit von TuS bei der Vorhersage des Überlebens zu bestimmen. Eine AUC von 1,0 war eine fehlerfreie Vorhersage von Krebs bei Patienten, während eine AUC von 0,50 eine halbe Wahrscheinlichkeit für eine genaue Vorhersage des Krebsstatus darstellt. Je höher die AUC-ROC, desto größer ist die diskriminierende Kraft des TuS für das Ergebnis. OS wurde definiert als die Zeit vom Datum der Diagnose bis zum Tod aus irgendeinem Grund oder Verlust zu Follow-up oder neuesten Nachrichten. OS wurde nach der Kaplan–Meier-Methode bewertet. Prognostische Faktoren wurden durch eine univariate Analyse unter Verwendung des Log-Rank-Tests und mit einer multivariaten Analyse unter Verwendung eines Cox-Proportional-Hazards-Modells bewertet. Ein p-Wert von weniger als 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Für die Gesamtbevölkerung betrug das Durchschnittsalter 59 Jahre (Bereich 25-85 Jahre), 57.2% waren Männer. Wir beobachteten eine Erkrankung im Stadium III bei 53% der Patienten, von denen 37,5% pN2 waren. Alle Patienten mit Stadium-III-Erkrankung erhielten eine adjuvante Chemotherapie (97,7% enthielten Oxaliplatin). Im Stadium II Krankheit 53% der Fälle erhielten eine Chemotherapie, sie waren pT4 Bühne in 22,5%, weniger als 12 Lymphknoten in 28% entfernt und hatte eine Notoperation in 15% der Fälle. Der mittlere Durchmesser betrug 7 cm .
In der ROC-Analyse wurde die AUC von TuS bei der Vorhersage des Überlebens in Abbildung 1 gezeigt. Die Leistung bei der Vorhersage des Überlebens wurde mit der Leistung der Anzahl der beteiligten Lymphknoten verglichen. Die AUC war 0.62 ± 0,048 für TuS und 0,60 ± 0,56 für positive Lymphknoten.

Eine Größe von 4 cm wurde mit einer Sensitivität von 88,2% und einer Spezifität von 59,2% als Prädiktor für das Überleben identifiziert. Wir beobachteten 98 Patienten mit TuS ≤4 cm und 159 Patienten mit TuS größer als 4 cm. Patienten mit TuS größer als 4 cm hatten häufiger einen Krebs im Dickdarm (81, 1 vs. 70, 4%, p = 0, 002) und häufig pT4 (44 vs. 22.4%, p = 0,0001). Wir beobachteten keinen signifikanten Unterschied nach Geschlecht, Notoperation, weniger als 12 entfernten Lymphknoten Rate, Anzahl der positiven Lymphknoten, Stadium und Oxaliplatin-Verabreichung zwischen Patienten TuS ≤4 cm und Patienten mit TuS größer als 4 cm (Tabelle 1).
| Variablen | Tumorgröße ≤4 cm, % (n = 89) | Tumorgröße > 4 cm, % (n = 159) | p-Wert |
|---|---|---|---|
| Alter: | |||
| – Medianes (mittleres) Alter – <65 Jahre – ≥65 Jahre |
56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| Geschlecht: | |||
| – Männlich – Weiblich |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| Standort: | |||
| – Doppelpunkt – Rektum |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| Chirurgischer Notfall: | |||
| – Ja – Nein |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 lymphknoten untersucht§: | |||
| – Ja – Nein |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| PN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡ (Monate) | 26 | 34 | 0.13 |
† Nur bei 168 Patienten verfügbar.
‡ Zeit zum Rückfall.
§ In beiden Stadien II und III.
* Signifikante p-Werte.
Reproduziert mit Genehmigung von © Oxford University Press (2017).
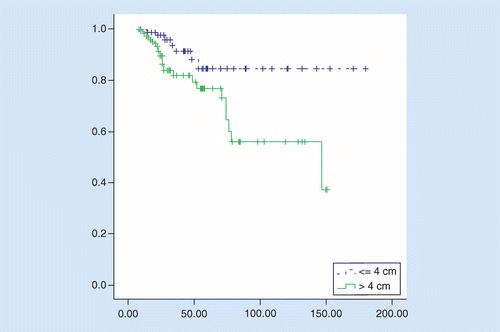
Das OS war bei TuS ≤4 cm signifikant besser als bei TuS größer als 4 cm, das mittlere Überleben betrug 158 versus 106 Monate, Hazard Ratio = 2.92 (95%-KI: 1,27-6,75, p = 0,01). die 5-Jahres-Überlebensrate der Patienten betrug 84% bei Patienten mit TuS ≤4 cm und 76% bei Patienten mit TuS größer als 4 cm (p = 0,008; siehe Abbildung 2).
Prognostische Faktoren wurden in beiden Gruppen untersucht. In der univariaten Analyse beobachteten wir einen signifikanten negativen Einfluss von Alter ≥65 Jahre, Stadium III, venöse Invasion und pN + größer als 3 auf das Überleben bei Patienten mit TuS größer als 4 cm. Nur in der multivariaten Analyse war Stadium III ein unabhängiger prognostischer Faktor. Bei Patienten mit TuS ≤4 cm war die Chemotherapie im adjuvanten Setting der Hauptfaktor mit signifikantem Einfluss auf das Überleben In univariaten und multivariaten Analysen gab es keinen prognostischen Einfluss der anderen getesteten Faktoren (Tabelle 2).
| Variablen | Tumorgröße < 4 cm (n = 159) | Tumorgröße ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5- jahr OS (%) | HR (95% -KI) | 5-Jahres-OS (%) | HR (95% -KI) | |
| Alter: | ||||
| – <65 jahre – ≥65 Jahre |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| PN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
* Signifikante HR-Werte.
HR: Hazard Ratio; OS: Gesamtüberleben.
Diskussion
Heutzutage führte die Integration okkulter Screening-Programme in westlichen Ländern zur Diagnose von CRC in früheren Stadien . In einer kürzlich durchgeführten SEER-datenbasierten Studie zwischen 2006 und 2012 wurden 38% der Darmkrebsfälle und 43% der Rektumkrebsfälle frühzeitig diagnostiziert . In Ländern mit niedrigem und mittlerem Einkommen ist ein solches Screening-Programm nicht verfügbar. und die meisten Fälle werden in einem regionalen oder fortgeschrittenen Stadium mit hohem RISIKO diagnostiziert . Die Identifizierung prognostischer Faktoren ist ein wichtiges Instrument zur Verbesserung der Ergebnisse in solchen Ländern. Unsere Studie untersuchte die prognostische Rolle von TS im Stadium II und III CRC in der tunesischen Bevölkerung. Wir beobachteten, dass TuS nicht nur einen Einfluss auf das Überleben hatte, sondern auch andere prognostische Faktoren beeinträchtigte. Stadium III war ein unabhängiger prognostischer Faktor bei großvolumigen Tumoren, während viele ‘klassische’ prognostische Faktoren bei kleineren Tumoren keinen Einfluss hatten. Mehrere Studien berichteten über den prognostischen Wert von TuS mit verminderter überlebensbedingter erhöhter TuS . In einer Studie von Kornprat et al., TuS war signifikant mit dem progressionsfreien und krebsspezifischen Überleben in univariaten und multivariaten Analysen bei Dickdarmkrebs assoziiert, jedoch nicht bei Rektumkarzinomen . In unserer Serie, höhere TuS war häufiger bei Darmkrebs Lage. Tatsächlich kann Darmkrebs länger asymptomatisch bleiben, was im Vergleich zu Rektumkarzinomen ein höheres Risiko bei der Diagnose erklärt. Es gab jedoch keinen Unterschied im Überleben zwischen Tumoren ≥4 cm im Dickdarm und Tumoren ≥4 cm im Rektum. Es gab auch keinen Einfluss auf die Tumorlokation bei kleineren Tumoren (< 4 cm). Basierend auf dieser Analyse spielte TuS keine Rolle bei der Vorhersage der Prognose basierend auf der Tumorlokalisation (Kolon vs. Rektum). Saha et al. berichteten in ihrer großen Serie von Patienten, dass TuS positiv mit wichtigen prognostischen Faktoren korreliert und das Überleben bei Darmkrebs negativ beeinflusst . Seine Rolle bei Rektumkrebs ist noch nicht klar.
Ein höherer TuS war auch mit dem pT4-Stadium assoziiert, von dem berichtet wurde, dass es die schlechteste Prognose als das T1–2N1-Stadium hat (Intergruppenstudie INT-0089) . Die Tumorlast kann die Fähigkeit eines Tumors widerspiegeln, sich durch die Darmwand, Knoten und andere Organe zu verbreiten. Tatsächlich hatte TuS in unserer Studie einen prädiktiven ROC-Analysewert, der dem prädiktiven Wert der Anzahl positiver Lymphe nahe kam. Bei Tumoren von weniger als 4 cm beobachteten wir keinen Unterschied im Überleben zwischen Patienten im Stadium II und III. Dieser Befund kann durch die Tatsache erklärt werden, dass unsere Stadium-II-Population eine Hochrisikopopulation mit schlechterer Prognose war (nahe der Stadium-III-Prognose): viele Stadium pT4, viele Fälle mit weniger als 12 entfernten Lymphknoten, viele Fälle operiert im Notfall (wegen Perforation und Obstruktion). In zwei SEER-datenbasierten Studien hatten kleinere Tumore eine schlechtere Prognose, dh eine Erkrankung im Stadium II. Die Autoren stellten die Hypothese auf, dass kleine TuS ein Ersatzmarker für die biologische Aggressivität sein können, was zu einem schlechteren Ergebnis im Vergleich zu relativ größeren TuS im Stadium II führt . Die gleichen Beobachtungen wurden in einer italienischen Studie beobachtet . Wir untersuchten auch die Rolle mehrerer prognostischer Faktoren nach TuS. Wir beobachteten, dass mehrere prognostische Faktoren wie Alter, Stadium, Anzahl der beteiligten Lymphknoten, Tumorlokalisation keinen signifikanten Einfluss auf die Gruppe der Patienten mit niedrigem TuS hatten. In unserer Studie hatte die adjuvante Chemotherapie positive Auswirkungen bei kleinen Tumoren, sollte TuS als Hochrisikofaktor im Stadium II angesehen werden? Weitere Studien zu diesem speziellen Thema sind erforderlich.
Mehrere Fallstricke können in unserer Serie festgestellt werden: die geringe Stichprobengröße, die retrospektive Datenerfassung und das Fehlen einer zentralen Überprüfung der Pathologie ermöglichen eine präzise TS-Bewertung. Wir hatten nicht genügend verfügbare Daten zur genauen Tumorlokalisation, so dass wir eine solche Analyse nicht durchführen konnten. Molekulare Tests wurden in Tunesien in 2015 eingeführt, in unserem Untersuchungszeitraum war es nicht verfügbar. Die Bewertung der TuS nach Stadium und Oxaliplatin-Verabreichung wurde nicht durchgeführt, für eine zu kleine Anzahl von Patienten, um Schlussfolgerungen zu ziehen.
Schlussfolgerung
TuS ist ein objektiver Parameter, der während der Pathologieuntersuchung leicht gemessen werden kann. Es kann einen zusätzlichen prognostischen Faktor in einer Population mit hoher Rate an lokal fortgeschrittenem Stadium darstellen.
Zukunftsperspektiven
Mehrere und komplexe genetische Aletraionen und / oder Signalwege könnten hinter der Diagnose von Darmkrebs stehen, molekulare Analyse unter Berücksichtigung der Größe des Tumors könnte zu genaueren Explantationen in seine Prognose führen die Rolle.
Finanziell & Offenlegung konkurrierender Interessen
Die Autoren haben keine relevanten Verbindungen oder finanziellen Beteiligungen an Organisationen oder Unternehmen, die ein finanzielles Interesse an oder einen finanziellen Konflikt mit dem im Manuskript diskutierten Gegenstand oder Material haben. Dazu gehören Beschäftigung, Beratungen, Honorare, Aktienbesitz oder Optionen, Gutachten, erteilte oder angemeldete Zuschüsse oder Patente oder Lizenzgebühren.
Bei der Herstellung dieses Manuskripts wurde keine Schreibhilfe in Anspruch genommen.
Ethisches Verhalten der Forschung
Die Autoren geben an, dass sie die entsprechende Genehmigung des Institutional Review Board erhalten haben oder die in der Erklärung von Helsinki dargelegten Grundsätze für alle experimentellen Untersuchungen am Menschen oder Tier befolgt haben. Darüber hinaus wurde für Untersuchungen mit menschlichen Probanden die Einverständniserklärung der beteiligten Teilnehmer eingeholt.
- 1 Torre LA, Bray F, Siegel RL et al. Globale Krebsstatistik, 2012. CA. Krebs J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Darmkrebs in Zentraltunesien: zunehmende Inzidenztrends über einen Zeitraum von 15 Jahren. Asiatische Pac. J. Krebs Prev. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Trends in der Inzidenz von Krebs in der Region Sousse, Tunesien, 1993-2006. Int. J. Krebs 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 Yang J, Du XL, Li ST et al. Merkmale unterschiedlich lokalisierter kolorektaler Karzinome unterstützen die proximale und distale Klassifikation: eine populationsbasierte Studie mit 57.847 Patienten. Plus EINS 11(12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang H et al. Der Einfluss der Tumorgröße auf das Überleben von Patienten mit pT4aN0M0 Magenkrebs. Uhr. Surg. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. Einfluss der Tumorgröße auf die Prognose bei Patienten mit Darmkrebs. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Eine kleinere Tumorgröße ist mit einem schlechten Überleben bei Darmkrebs im Stadium II verbunden: eine Analyse von 7719 Patienten in der SEER-Datenbank. Int. J. S. Lond. In: Engl. 33(Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier JE, McMillan DC, McArdle CS et al. Die Tumorgröße ist mit der systemischen Entzündungsreaktion verbunden, jedoch nicht mit dem Überleben bei Patienten mit primärem operierbarem Darmkrebs. In: J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta GD et al. Darmkrebs im Frühstadium: ESMO Clinical Practice Guidelines für Diagnose, Behandlung und Nachsorge. Ann. Oncol. 24(Suppl. 6), VI64-VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Kirche TR, Bond JH et al. Die Wirkung des okkulten Blutscreenings im Stuhl auf die Inzidenz von Darmkrebs. In: N. Engl. Dr. Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Darmkrebsstatistik, 2017. CA Krebs J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer A, Rehak P, Langner C. Wert der Tumorgröße als prognostische Variable bei Darmkrebs: eine kritische Neubewertung. Uhr. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. Tumorgröße sagt das langfristige Überleben bei Darmkrebs voraus: eine Analyse der National Cancer Data Base. Uhr. J. Surg. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon AL et al. Das Überleben von Darmkrebs ist mit einer zunehmenden Anzahl von Lymphknoten verbunden analysiert: eine sekundäre Umfrage der Intergruppenstudie INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Ungünstige Wirkung der kleinen Tumorgröße auf das ursachenspezifische Überleben bei Dickdarmkrebs im Stadium IIA, eine SEER-basierte Studie. Int. J. Kolorektale Dis. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi A, Cananzi FCM et al. Tumorgröße als prognostischer Faktor bei Patienten mit Darmkrebs im Stadium IIa. Uhr. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar