Ácidos, Bases, pH e
|
|||||||||
ÁCIDOS E SEU CONJUGADO BASES
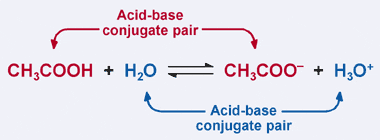
Lembre-se que o Bronsted–Lowry definição de um ácido: ácido é um doador de prótons. Claramente, em nosso exemplo anterior ácido acético doa seu próton a H2O na reação anterior, resultando na formação do íon acetato. No entanto, na reação reversa, o íon acetato aceita um próton de H3O+ para reverter para CH3COOH. A partir da definição Bronsted–Lowry, uma base é um aceitador de prótons.
|
Assim, o acetato de íon atua como uma base no reverso da reação, e é chamada base conjugada do ácido acético. O ácido acético e o íon acetato são conhecidos como um par conjugado ácido–base. Curiosamente, há um segundo par conjugado ácido–base na reação acima. Observe como na reação reversa, H3O+ doa um próton (tornando-o um ácido), enquanto na reação dianteira, H2O aceita um próton (tornando-o uma base). H2O e H3O+ são um par ácido–base conjugado, com H3O+ sendo o ácido conjugado e H2O sendo a base conjugada.
In a conjugate acid-base pair, the conjugate acid has one more proton than its corresponding conjugate base.