17.3: The Formation of Complex Ions
The Effect of the Formation of Complex Ions on Solubility
What happens to the solubility of a sparingly soluble salt if a ligand that forms a stable complex ion is added to the solution? Um desses exemplos ocorre na fotografia convencional a preto-e-branco. Recorde-se que as películas fotográficas a preto e branco contêm microcristais sensíveis à luz de AgBr, ou misturas de AgBr e outros halogenetos de prata. AgBr é um sal moderadamente solúvel, com um Ksp de 5,35 × 10-13 a 25 ° C. Quando o obturador da câmera se abre, a luz do objeto fotografado atinge alguns dos cristais no filme e inicia uma reação fotoquímica que converte AgBr para black Ag metal. Imagens negativas estáveis e bem formadas aparecem em tons de cinza, correspondendo ao número de grãos de AgBr convertidos, com as áreas expostas à luz mais escura. Para corrigir a imagem e evitar que mais cristais AgBr sejam convertidos para AG metal durante o processamento do filme, O AgBr não reagido no filme é removido usando uma reação de complexação para dissolver o sal moderadamente solúvel.
a reacção para a dissolução do brometo de prata é a seguinte::
\
com
\
o equilíbrio encontra− se muito à esquerda, e as concentrações de equilíbrio de Ag+ e Br-ions são muito baixas (7,31 × 10-7 M). Como resultado, remover AgBr não reagido de mesmo um único rolo de filme usando água pura exigiria dezenas de milhares de litros de água e uma grande quantidade de tempo. O princípio de Le Chatelier diz-nos, no entanto, que podemos conduzir a reacção à direita removendo um dos produtos, o que fará com que mais AgBr se dissolva. Íon brometo é difícil de remover quimicamente, mas íon prata forma uma variedade de complexos estáveis de duas coordenadas com ligantes neutros, tais como amônia, ou com ligantes aniônicos, tais como cianeto ou tiossulfato (S2O32 -). No processamento fotográfico, o excesso de AgBr é dissolvido usando uma solução concentrada de tiossulfato de sódio.
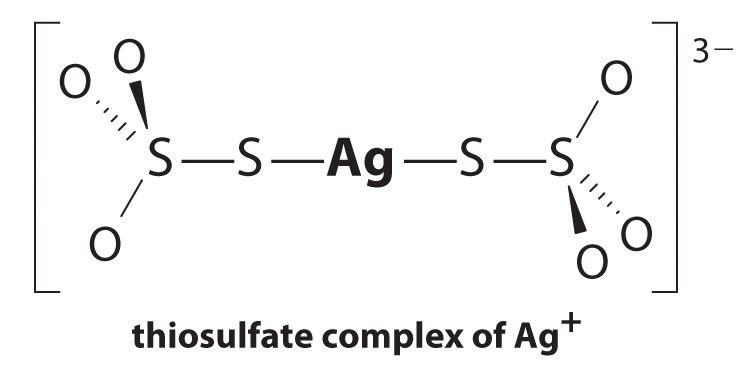
a reacção de Ag+ com tiossulfato é a seguinte::
\^{3−}_{( rótulo{17.3.5a}\]
com
\
A magnitude da constante de equilíbrio indica que quase todos Ag+ íons em solução será imediatamente complexado por tiossulfato para formar 3−. Podemos ver o efeito de tiossulfato de solubilidade do AgBr escrevendo apropriado reações e adicioná-los juntos:
\\ \mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f&=2.9\times10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15\end{align} \label{17.3.6}\)
Comparando K com Ksp mostra que a formação de complexos de íons aumenta a solubilidade do AgBr por aproximadamente 3 × 1013. O aumento dramático da solubilidade combinado com o baixo custo e a baixa toxicidade explica por que o tiossulfato de sódio é quase universalmente usado para o desenvolvimento de filmes a preto e branco. Se desejado, o prata pode ser recuperado a partir da solução de tiossulfato usando qualquer um dos vários métodos e reciclado.
se um íon complexo tem um Kf grande, a formação de um íon complexo pode aumentar drasticamente a solubilidade de sais moderadamente solúveis.
exemplo \(\PageIndex{2}\)
devido ao efeito iônico comum, podemos esperar que um sal como o AgCl seja muito menos solúvel em uma solução concentrada de KCl do que em água. Tal suposição seria incorreta, no entanto, porque ignora o fato de que o íon de prata tende a formar um complexo de duas coordenadas com íons cloreto (AgCl2 -). Calcular a solubilidade do AgCl em cada situação:
- em água pura
- em 1,0 M de KCl solução, ignorando a formação de complexos com íons
- a mesma solução, como na parte (b), exceto levando a formação de complexos de íons em conta, supondo que AgCl2− é a única Ag+ complexo que se forma em concentrações significativas
A 25°C, Ksp = 1.77 × 10-10 para AgCl e Kf = 1.1 × 105 para AgCl2 -.
Dado: Ksp de AgCl, Kf de AgCl2−, e a concentração de KCl
Pediu para: solubilidade do AgCl em água e em solução de KCl, com e sem a formação de complexos de íons
Estratégia:
- Escrever o produto de solubilidade expressão para AgCl e calcular a concentração de Ag+ e Cl− na água.
- calcular a concentração de Ag+ na solução KCl.
- Write balanced chemical equations for the dissolution of AgCl and for the formation of the AgCl2-complex. Adicione as duas equações e calcule a constante de equilíbrio para o equilíbrio geral.
- escrever a expressão constante de equilíbrio para a reação global. Resolver para a concentração do íon complexo.
Solução
- Um Se deixarmos x igual a solubilidade do AgCl, então, no equilíbrio = = x M. Substituindo este valor na expressão do produto de solubilidade,
Assim, a solubilidade do AgCl em água pura a 25°C é de 1,33 × 10-5 M.
- B Se x for igual a solubilidade do AgCl em KCl solução, então, no equilíbrio = x M e = (1.0 + x) M. Substituindo esses valores para o produto de solubilidade de expressão e supondo que x << 1.0,
Se o comum de iões de efeito foram o único fator importante, seria de prever que o AgCl é cerca de cinco ordens de magnitude a menos solúvel em um 1.0 M de KCl solução do que na água.
- C to account for the effects of the formation of complex ions, we must first write the equilibrium equations for both the dissolution and the formation of complex ions. Adicionar as equações correspondentes ao Ksp e ao Kf dá-nos uma equação que descreve a dissolução do AgCl numa solução KCl. A constante de equilíbrio para a reação é, portanto, o produto do Ksp e Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K_\textrm f&=1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9\times10^{-5}\end{align}\)
D Se deixarmos x igual a solubilidade do AgCl em KCl solução, então, no equilíbrio = x e = 1.0 − x. Substituindo estes valores na expressão da constante de equilíbrio para a rede de reação e supondo que x << 1.0,
isto é, o AgCl dissolve− se em 1,0 m KCl para produzir uma solução de 1,9 × 10-5 m do íon complexo AgCl2. Assim, nós prevemos que AgCl tem aproximadamente a mesma solubilidade em uma solução de 1,0 M KCl como em água pura, que é 105 vezes maior do que o previsto com base no efeito iônico comum. (Na verdade, a solubilidade medida do AgCl em 1,0 M KCl é quase um fator de 10 maior do que a da água pura, em grande parte devido à formação de outros complexos contendo cloreto.)
Exercício de \(\PageIndex{2}\)
Calcular a solubilidade de mercúrio(II) iodeto (HgI2), em cada situação:
- água pura
- 3,0 M de solução de NaI, supondo 2− é o único Hg-contendo espécies presentes em quantidades significativas
Ksp = 2.9 × 10-29 para HgI2 e Kf = 6.8 × 1029 para 2.Resposta
- 1.9 × 10-10 M
- 1.4 M
os agentes complexantes, moléculas ou iões que aumentam a solubilidade dos sais metálicos através da formação de complexos metálicos solúveis são componentes comuns dos detergentes para roupa. Os ácidos carboxílicos de cadeia longa, Os principais componentes das Sabonetes, formam sais insolúveis com Ca2+ e Mg2+, que estão presentes em altas concentrações em água “dura”. A precipitação destes sais produz um anel de banheira e dá uma tonalidade cinzenta à roupa. A adição de um agente complexante, como pirofosfato (O3POPO34−, ou P2O74−) ou trifosfato de adenosina (P3O105−) para detergentes impede o magnésio e o cálcio sais de precipitação, pois a constante de equilíbrio para complexos de iões de formação é grande:
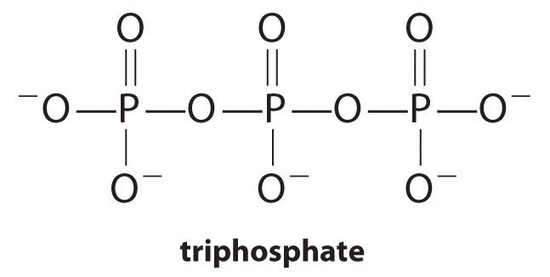
com
no Entanto, os fosfatos podem causar danos ambientais, promovendo a eutrofização, o crescimento de quantidades excessivas de algas em um corpo de água, o que pode levar, eventualmente, a grande diminuição dos níveis de oxigênio dissolvido, que matam peixes e outros organismos aquáticos. Consequentemente, muitos estados dos Estados Unidos proibiram a utilização de detergentes contendo fosfatos, e a França proibiu a sua utilização a partir de 2007. Os detergentes “sem fosfato” contêm diferentes tipos de agentes complexantes, tais como derivados do ácido acético ou outros ácidos carboxílicos. O desenvolvimento de substitutos de fosfatos é uma área de intensa pesquisa.
amaciadores de água comerciais também usam um agente complexante para tratar a água dura, passando a água sobre resinas permutadoras de iões, que são sais de sódio complexos. Quando a água flui sobre a resina, O íon de sódio é dissolvido e os sais insolúveis precipitam-se na superfície da resina. A água tratada desta forma tem um sabor mais salgado devido à presença de Na+, mas contém menos minerais dissolvidos.
outra aplicação de agentes complexantes encontra-se na medicina. Ao contrário dos raios-x, a ressonância magnética (MRI) pode dar imagens relativamente boas de tecidos moles, tais como órgãos internos. A ressonância magnética é baseada nas propriedades magnéticas do núcleo 1H de átomos de hidrogênio na água, que é um componente principal dos tecidos moles. Porque as propriedades da água não dependem muito se está dentro de uma célula ou no sangue, é difícil obter imagens detalhadas destes tecidos que têm um bom contraste. Para resolver este problema, os cientistas desenvolveram uma classe de complexos metálicos conhecidos como “agentes de contraste de ressonância magnética”.”Injetar um agente de contraste de ressonância magnética em um paciente afeta seletivamente as propriedades magnéticas da água em células de tecidos normais, em tumores, ou em vasos sanguíneos e permite que os médicos “vejam” cada um deles separadamente (figura \(\PageIndex{2}\)). Um dos íons metálicos mais importantes para esta aplicação é o Gd3+, que com sete elétrons não emparelhados é altamente paramagnético. Como o Gd3+(aq) é bastante tóxico, deve ser administrado como um complexo muito estável que não dissocia no organismo e pode ser excretado intacto pelos rins. Os agentes complexantes usados para o gadolínio são ligantes como o ácido dtpa5 – (dietileno triamina pentaacético), cuja forma totalmente protonada é mostrada aqui.
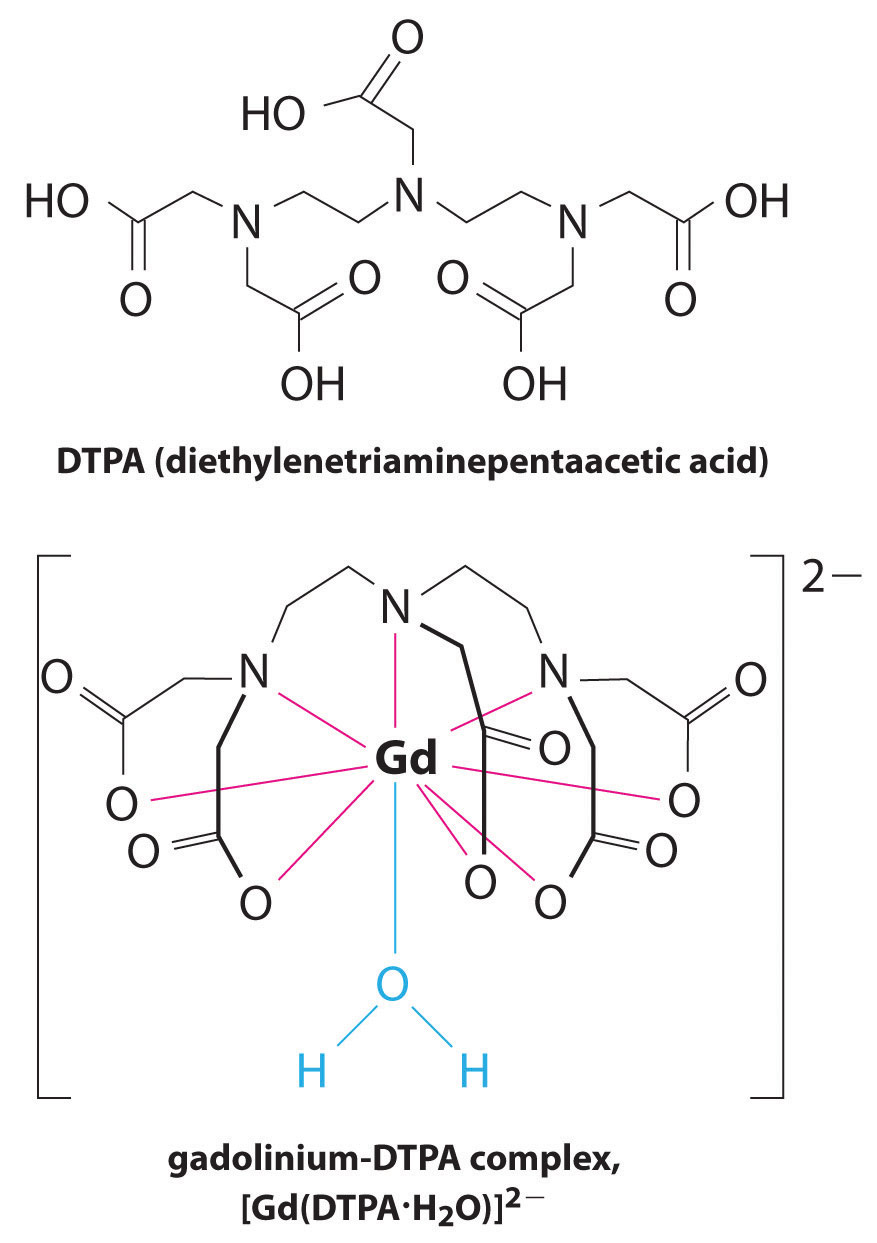
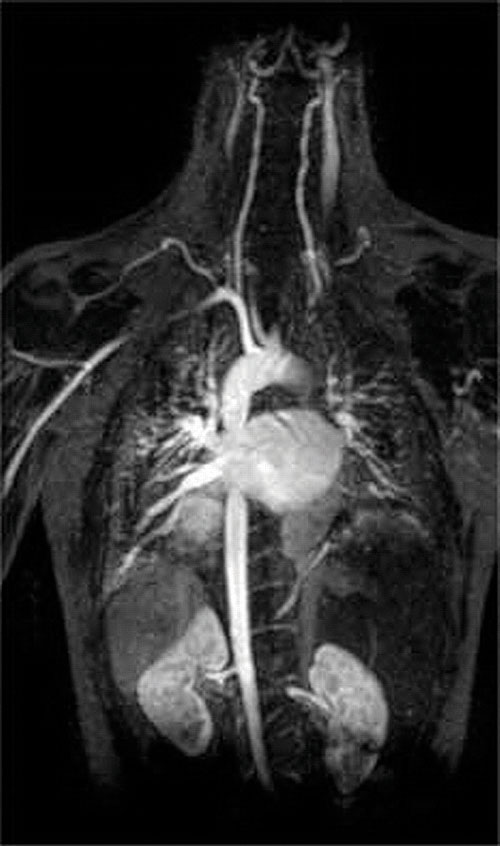
Figura \(\PageIndex{2}\): Uma Imagem de ressonância magnética do Coração, Artérias e Veias. Quando um paciente é injetado com um catião metálico paramagnético na forma de um complexo estável conhecido como um agente de contraste de ressonância magnética, as propriedades magnéticas da água nas células são alteradas. Como os diferentes ambientes em diferentes tipos de células respondem de forma diferente, um médico pode obter imagens detalhadas de tecidos moles.