2.3: Monóxido de Carbono e backbonding
Propriedades Gerais
CO é um dativo, o L-tipo de ligante, que não afeta o estado de oxidação do metal center com a ligação, mas não aumenta o número total de electrões por duas unidades. Recentemente vimos que existem realmente duas interações de ligação em jogo no ligando carbonila: um ligando-para-metal n → dσ interação e um metal-para-ligando dn → π* interação. A última interação é chamada backbonding, porque o metal doa a densidade de elétrons de volta ao ligante. Para me lembrar da existência de backbonding, eu gosto de usar a estrutura de ressonância direita sempre que possível; no entanto, é importante lembrar de tratar CO como um ligante de tipo L, não importa que forma de ressonância é desenhada.

interações orbitais em M=C = O.
CO é um forte doador σ (Ou σ-base) e um bom aceitador π (ou ácido π). As propriedades do CO ligado dependem profundamente da identidade do centro de metal. Mais especificamente, as propriedades eletrônicas do centro de metal ditam a importância da backbonding em complexos de carbonila metal. Mais descaradamente, mais centros de metal ricos em elétrons são melhores em backbonding para CO. Por que razão é importante determinar a força da backbonding?
a espectroscopia infravermelha tem sido usada para apoiar empiricamente a ideia de backbonding. A tabela abaixo organiza alguns complexos metal carbonila em ordem” periódica”e fornece a frequência correspondente ao modo de alongamento C=O. Note que, sem exceção, cada CO complexado tem uma frequência de alongamento menor que a do CO livre. Fugir é a culpa! A ordem de ligação C-O em monóxido de carbono complexado é (quase sempre) menor do que a de co livre.

c = o frequências de alongamento em complexos metal-carbonila. Há alguma coisa errada aqui?
a figura acima mostra um claro aumento na frequência (um aumento na ordem de obrigações C–O) à medida que nos movemos da esquerda para a direita através da tabela periódica. Este achado pode parecer estranho se considerarmos que o número de elétrons d no metal neutro aumenta à medida que nos movemos da esquerda para a direita. Os centros de metal com mais elétrons d não deveriam ser melhores em backbonding (e mais “ricos em elétrons”)? O que se passa aqui? Lembre-se da tendência periódica da energia orbital. À medida que nos movemos da esquerda para a direita, as energias orbitais d diminuem e as energias dos orbitais DN e π* se separam. Como resultado, a interação orbital backbonding torna-se pior (lembre-se que fortes interações orbitais requerem energias orbitais bem correspondidas) à medida que nos movemos para os metais de transição mais tarde eletronegativos! Podemos fazer uma analogia com enaminas e éteres enol da química orgânica. O átomo de oxigênio mais eletronegativo nos éteres de enol é um doador de elétrons pior do que o átomo de nitrogênio da enamina.

a importância da backbonding depende da eletronegatividade do metal e sua densidade de elétrons.
claro, a contribuição de outros ligantes no centro de metal para backbonding também não pode ser esquecida. Logicamente, ligantes doadores de elétrons tendem a tornar o backbond mais forte (eles fazem do metal um melhor doador de elétrons), enquanto ligantes de retirada de elétrons vão piorar a backbonding. A adição de ligantes de fosfina ricos em elétrons a um centro de metal, por exemplo, diminui a frequência de alongamento por co devido à melhoria da backbonding.
os ligantes carbonila são famosamente capazes de fazer a ponte de múltiplos centros de metal. A ligação em complexos carbonila bridged pode ser “tradicional” ou deslocalizada, dependendo da estrutura do complexo e do modo de ligação. A variedade de modos de ligação deriva dos diferentes doadores de elétrons e aceitadores presentes no ligando CO (e a possibilidade de ligação deslocalizada). Os modos de ligação conhecidos são mostrados na figura abaixo.
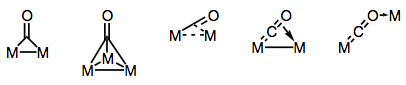
a construir pontes com ligandos carbonila!