7.4: Complexo III
Complexo III aceita elétrons do Complexo I e Complexo II. Os elétrons que chegam na forma de ubiquinol, UQH2, que oferece dois elétrons e dois prótons e é convertido de volta para a ubiquinona, UQ. A ubiquinona então vai de volta para o complexo I ou complexo II para coletar mais elétrons.
- complexo III é o destino para os electrões que chegam tanto do complexo i como do complexo II.
- o complexo III usa energia libertada em transferências de elétrons para bombear mais protões através da membrana mitocondrial interna.
- O gradiente de prótons através da membrana é utilizada para a unidade de formação de ATP no Complexo V.
- Complexo III, em seguida, envia os seus electrões no Complexo IV.
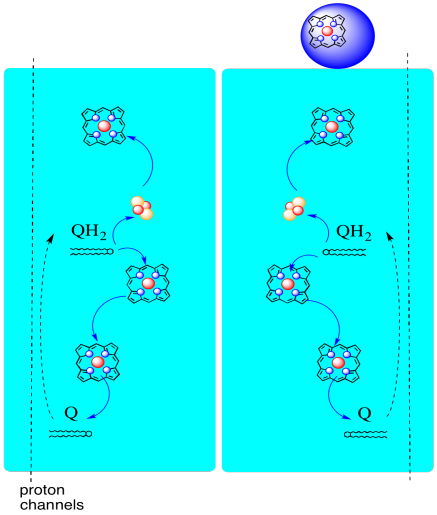
O caminho dos elétrons através do Complexo III é mostrado abaixo. Note que o complexo é uma estrutura dimérica, com dois caminhos equivalentes: um mostrado à esquerda e o outro à direita. Elétrons são entregues a partir de UQH2, ubiquinol, no meio da imagem, viajando para cima para o citocromo Móvel c no topo. Uma segunda via de elétrons permite viajar para baixo na imagem, em direção a outra molécula de ubiquinona, que recicla os elétrons em um loop.
- complexo III apresenta uma via de elétrons divergente incomum.
- um electrão viaja em direcção ao citocromo C.
- o segundo electrão é eventualmente reciclado noutro ubiquinol.
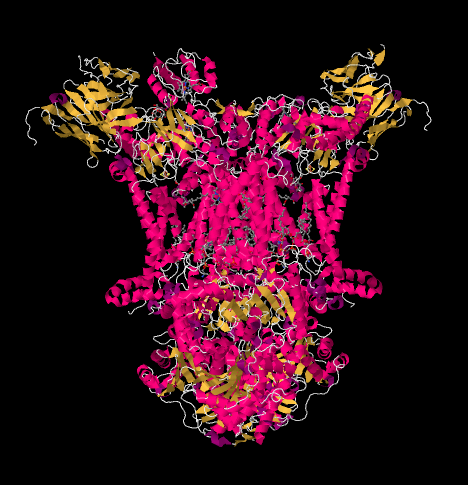
a estrutura de raio-X do complexo III é mostrada em forma de desenho animado abaixo. A membrana mitocondrial interna intersectaria a porção superior do meio do complexo. A maioria dos projetos complexos abaixo, na matriz (a parte inferior da imagem, nesta orientação), embora uma quantidade significativa também se projeta para o espaço intermembranar.
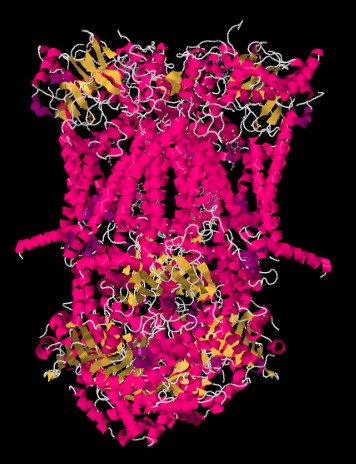
o complexo III continua a cadeia de transporte de elétrons, enviando elétrons para um maior potencial de redução (e menor energia livre) e para uma reunião com oxigênio molecular no complexo IV. Protões também são bombeados da matriz mitocondrial, através da membrana mitocondrial interna e para o espaço intermembranar. Ao mesmo tempo, um segundo elétron rota de resultados efetivos de reciclagem de metade dos elétrons para o complexo, aumentando o número de prótons bombeado por elétrons que chegam no Complexo III.
- tem sido sugerido que o elétron-reciclagem de loop fornece um mecanismo para desenho mais prótons até da matriz.
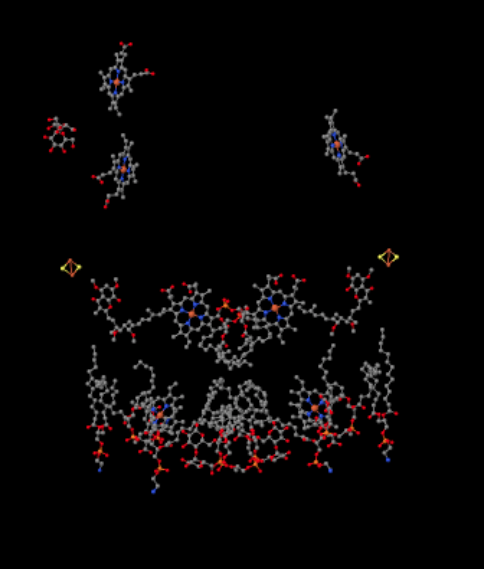
podemos ver este arranjo incomum se ignorarmos as proteínas para revelar os ligandos, abaixo. O complexo pode ser visto mais claramente como um dímero; a metade esquerda da imagem é exatamente a mesma que a direita, embora refletida da maneira oposta. Os elétrons entram no complexo através do portador móvel, ubiquinol, visível no lado direito e esquerdo da imagem a meio caminho; você pode ver o anel e uma corrente pendurada nele.
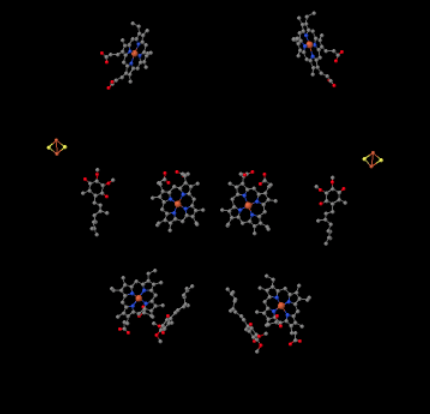
quando UQH2 se liga ao complexo III, um elétron é enviado para um aglomerado de FeS, enquanto o segundo é enviado para um centro de heme de ferro, chamado heme BL. O aglomerado FeS é visível logo acima do ubiquinol e até a borda da imagem. O heme BL está em direção ao centro da imagem.
embora não seja aparente na imagem de raio-X mostrada, este aglomerado de FeS é diferente dos que você viu anteriormente. Este é mantido no lugar com diferentes cadeias laterais de aminoácidos. Você não pode ver isso na imagem porque toda a proteína foi deixada de fora, juntamente com aqueles aminoácidos que estão se ligando ao aglomerado. Enquanto a maioria dos clusters FeS são mantidos no lugar exclusivamente por cisteínas, este cluster é mantido no lugar por dois cysteiens de um lado, mas por dois histidines do outro. Este peculiar aglomerado de FeS é chamado de aglomerado de Rieske.Os aglomerados de Rieske são importantes porque são “aglomerados de FeS de alto potencial”. Isso significa que eles têm potencialidades de redução excepcionalmente positivas em comparação com outros clusters FeS. O potencial de redução de qualquer ligante em uma proteína é altamente dependente de seu ambiente, e por isso há uma ampla gama de valores na maioria dos casos. Isso é verdade para os aglomerados de enxofre de ferro; normais têm potenciais de redução, que variam de -1.0 V a cerca de 0,05 V. Rieske clusters potenciais que variam de cerca de 0V para cerca de 0,4 V.
a Partir do FeS cluster, o elétron é enviado para outro ferro heme centro de uma membrana vinculado a unidade chamada citocromo c1. Citocromo c1 pode ser visto no topo da imagem. Como esta imagem é orientada da mesma forma que as outras estruturas de raio-X do complexo respiratório, podemos ver que este elétron está sendo transportado para o espaço intermembranar. Finalmente, este elétron é transferido para outro heme, mas este heme é ligado em uma pequena proteína móvel, chamada citocromo C. citocromo c é outro portador móvel de elétrons. Transporta o electrão para o complexo IV. voltaremos ao citocromo c um pouco mais tarde. Antes de chegarmos a isso, para onde vai o outro electrão? De heme BL, o segundo elétron é passado para outro complexo de porfirina de ferro, heme BH. Isso é em direção ao fundo da imagem, então esse elétron está sendo enviado de volta para a matriz. À espera do heme BL, no entanto, há outra ubiquinona, UQ. Está à espera do electrão. Ele realmente vai esperar por dois, em seguida, deixar a sua doca e voltar para o local de ligação ubiquinol (UQH2) para entregar os elétrons novamente.Para quê dar-se ao trabalho? Porque não enviar os electrões correctamente da primeira vez? Parece que estão a ser reciclados por alguma razão. Acredita-se que esta diversão permite que protões adicionais sejam bombeados através da membrana mitocondrial. Quando a segunda ubiquinona é reduzida a ubiquinol através da aceitação de dois elétrons, ela também pega mais dois prótons da matriz abaixo. Esses protões eventualmente serão passados para o espaço intermembranar quando o ubiquinol for oxidado novamente. Esta reciclagem, e espremendo um par de protões extras para aumentar o gradiente de protões, é chamado de laço Q.
a vantagem do laço-Q é explicada no diagrama seguinte. No diagrama, as entradas para o complexo III são mostradas em Vermelho, as saídas são mostradas em azul, e os elementos reciclados estão em verde. Se um ubiquinol simplesmente entregasse seus elétrons e prótons e fosse feito, haveria dois prótons entregues por ubiquinol. É uma saída de prótons por elétron que foi entrada.
um segundo ubiquinol faria exatamente a mesma coisa. Haveria quatro prótons de saída para quatro elétrons inicialmente de entrada. Isso ainda é uma saída de prótons por elétron que foi entrada.
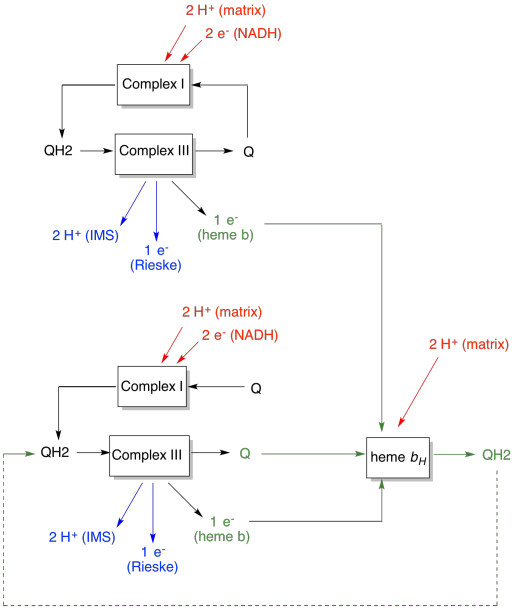
se, em vez disso, um elétron é reciclado de cada vez, então cada segundo ubiquinol leva à entrega de um par extra de prótons. Isso porque ao apanhar os electrões reciclados, uma ubiquinona teve de viajar de volta para o lado da matriz da membrana e apanhar mais dois protões. No geral, isso significa que seis prótons são entregues para quatro elétrons de entrada, ou 1,5 prótons de saída por entrada de elétrons. Uma vez que o gradiente de prótons é o que está gerando o ATP, então aumentando o número de prótons bombeados por elétron chegando, a eficiência é aumentada.
- o laço-Q aumenta o número de prótons bombeados por entrada de elétrons no sistema.
agora vamos voltar para o transportador de elétrons de saída, o citocromo c, que irá transportar os elétrons para o complexo IV. Na figura abaixo, a partir de uma estrutura de cristal de raios X diferente, o complexo foi encontrado com uma acoplagem cyctocromo c no local de ligação. Citocromo c é uma proteína globular rosa ligada no topo da imagem, na metade esquerda do dímero enquanto olhamos para ela aqui. Está na borda do espaço intermembranar, que é meio aquoso. Ao contrário da ubiquinona, que desliza através da camada lipídica da membrana, o citocromo c rola ou desliza ou nada sobre o topo para o seu destino.
a mesma visão é mostrada abaixo sem a proteína. A parte inferior da imagem é muito atulhado de lipídios, e há um açúcar pendurado na parte superior esquerda, mas a direita na parte superior você pode ver o ferro porfirina que é aninhado dentro do citocromo c.
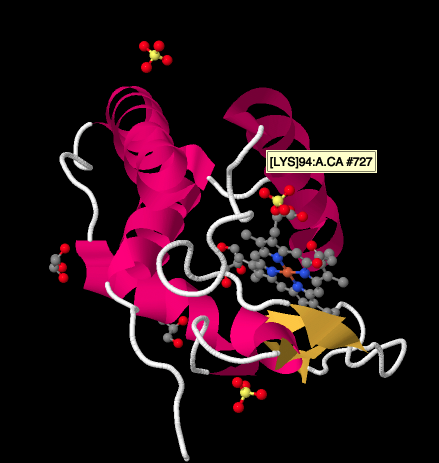
Um olhar mais próximo em um raio-X da estrutura de um cyctochrome c, abaixo, mostra uma forma relativamente simples de imagem comparado com os complexos temos vindo a estudar. Há um par de hélices, um par de lençóis, alguns laços, e aquela porfirina de ferro ou heme novamente. Alguns íons de sulfato estão flutuando nas proximidades, bem como um par de moléculas de glicerol, provavelmente introduzidas durante a purificação ou cristalização da proteína. Note que o heme é encontrado na borda da proteína. Essa localização pode torná-lo mais fácil para transferência de electrões do Complexo III, ou para o Complexo IV.
- o Citocromo c é o destino final de elétrons movendo-se através de um Complexo III.
- Citocromo c é um móvel, uma transportadora de elétrons.Citocromo c é na verdade uma pequena proteína hidrofílica.
- citocromo c encontra-se acima da membrana mitocondrial, na extremidade do espaço intermembranar.O que impede o ciclocromo c de vaguear pelo espaço intermembranar? Se o fizesse, interromperia o fluxo eficiente de elétrons. É possível que o citocromo c se mova para trás e para a frente entre o complexo III e o complexo IV através de um mecanismo chamado “direção”. Na direção, o transportador é guiado ao longo de um caminho através de cargas complementares. Por exemplo, se a membrana é carregada negativamente por causa de grupos polares na superfície da membrana, então cargas positivas na superfície do citocromo c podem restringir seu movimento à superfície da membrana. Isso por si só reduziria a sua mobilidade de três dimensões (em qualquer parte do espaço intermembranar) para duas dimensões (em qualquer parte da superfície da membrana). É possível que interações adicionais reduzam sua mobilidade ainda mais para uma faixa unidimensional entre os dois complexos.
- Direcção, com base em cargas complementares, evita que o citocromo c se perca no espaço intermembranar.
exercício \(\PageIndex{1}\)
sugerir possíveis resíduos de aminoácidos na superfície do citocromo c que possam ajudá-lo a permanecer numa superfície de membrana negativamente carregada.
Resposta
Arginina e lisina são carregadas positivamente em pH neutro.
Exercício de \(\PageIndex{2}\)
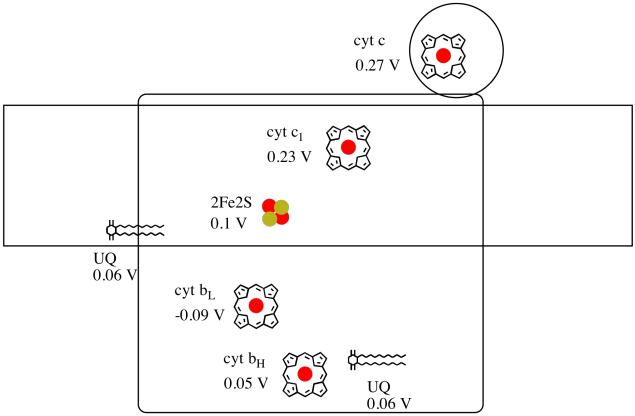
É difícil medir o potencial de redução de um site individual dentro de uma proteína. No entanto, os investigadores têm sido capazes de estimar estes valores medindo espectros EPR em várias condições. Supondo que os potenciais de redução abaixo, desenhe uma reação progresso diagrama para o transporte de um electrão todo o caminho desde a fase inicial de ubiquinona doador de todo o caminho para o citocromo c.
 Responder
Responder
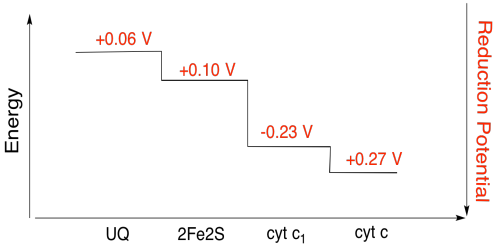
Exercício de \(\PageIndex{3}\)
Utilizando os valores da figura acima, calcular a mudança de energia quando um elétron é transferido do 2Fe2S de cluster para o citocromo c1.
Resposta
Supondo que os potenciais de redução são:
2Fe2S(ox) + e- → 2Fe2S(vermelho) Eored = 0.10 V
cyt c1(ox) + e- → cyt c1(vermelho) Eored = 0.230 V
, em Seguida, a diferença de potencial para a reação, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faraday relação ΔG = – n F ΔEo dá
ΔG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 12,543 J mol-1 = 12.5 kJ mol-1
Exercício de \(\PageIndex{4}\)
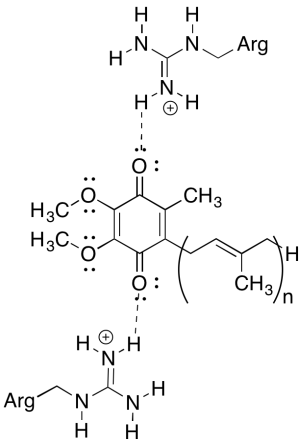
Uma das coisas desconcertantes sobre este complexo é que, no elétron de reciclagem de loop, transferência de electrões aparece para ir de um período inicial de ubiquinona para um final ubiquinona, sem geral de força motriz. No entanto, os potenciais de redução são muito sensíveis ao ambiente. Mostrar como os resíduos de arginina próximos podem tornar o potencial de redução de uma ubiquinona mais positivo.
resposta
os resíduos positivos de arginina confeririam uma carga parcial positiva sobre a ubiquinona através da ligação por hidrogénio; como resultado, a ubiquinona teria um potencial de redução mais positivo.
veja a página de foco sobre a estrutura do complexo III em Bioquímica Online.
raio-X da estrutura cristalina do Complexo III de: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C. A., Xia, D. base Estrutural para a quinona de redução na bc1 complexo: uma análise comparativa de estruturas cristalinas de mitocondrial citocromo bc1 com vinculado substratos e inibidores no Qi site. Bioquímica 2003, 4, 9067-9080. (1NTZ)
estrutura cristalina de raios X do complexo III com citocromo C ligado a partir de: Solmaz, S. R., Hunte, C. Estrutura do complexo III com citocromo C ligado em estado reduzido e definição de uma interface mínima para a transferência electrónica. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
raio-X da estrutura cristalina do citocromo c de: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. Estruturais evidência para um caminho de transferência de prótons, juntamente com a molécula de heme redução do citocromo c” do Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
Atribuição
Chris P Schaller, Ph. D., (Faculdade de são Bento / Saint John’s University)