7.5: Complexo IV
Complexo IV é o destino final na cadeia de transporte de elétrons. Aqui, os elétrons que têm viajado através dos outros membros do supercomplex respiratório são finalmente entregues ao O2, reduzindo-o à água. Isso é um feito impressionante, porque um número de espécies reativas de oxigênio devem ser formadas entre a adição inicial de um elétron e a liberação final de água, mas a reação é controlada de tal forma que a possibilidade de dano celular é minimizada. Ao mesmo tempo, mais protões são bombeados através da membrana mitocondrial interna.
- no complexo IV, os electrões são entregues ao seu destino final, uma molécula de O2.
- o O2 é reduzido a água.
exercício \(\PageIndex{1}\)
escrever uma meia reação redox equilibrada para mostrar quantos elétrons são necessários para reduzir uma molécula de oxigênio para a água.
Resposta
O2 → H2O
O2 → 2 H2O (S equilibrado)
O2 + 4H+ → 2 H2O (H equilibrado)
O2 + 4e- + 4H+ → 2 H2O (carga equilibrada)
O X-ray estrutura do Complexo IV é mostrado abaixo. Mais uma vez, a matriz está na extremidade inferior da imagem e o espaço intermembranar está no topo. É onde o citocromo c atracou, no topo.
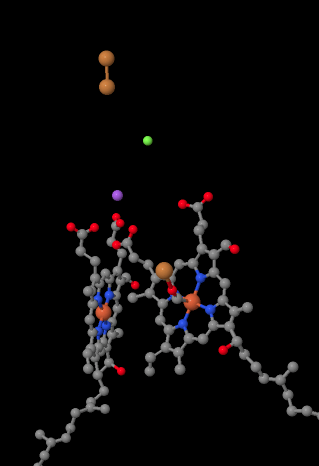
o portador móvel de elétrons, citocromo c, liga-se ao complexo IV e fornece um elétron a um local de cobre binuclear chamado CuA. Podemos ver aquele local de cobre binuclear quando olhamos para dentro da proteína, lá em baixo. Ele está ligado apenas à proteína e nada mais, então nós apenas vemos os dois íons de cobre por conta própria no topo da imagem. Este par de átomos de cobre envia o elétron para um heme, citocromo a, que você pode ver abaixo e para a esquerda. A partir daí, o elétron segue para outro aglomerado binuclear, desta vez consistindo de um ferro heme-bound (citocromo a3) e um cobre próximo (CuB). Este local binuclear realiza a redução de dioxígeno para a água. Na estrutura, existe uma molécula de monóxido de carbono ligada no local ativo entre o citocromo a3 e o CuB. Os átomos de carbono estão ligados ao ferro e o oxigénio Está ligado ao cobre. É onde a molécula de oxigénio se ligaria, à espera de ser reduzida a água.
se você pensar nisso, isso significa que os elétrons estão viajando na direção oposta do que vimos nos três primeiros complexos. Em complexos I e II, os elétrons foram liberados da matriz mitocondrial e viajaram para o espaço intermembranar, parando em uma ubiquinona na membrana mitocondrial. No complexo III, elétrons continuaram nessa direção “para cima”, da membrana mitocondrial ao citocromo c no espaço intermembranar. No complexo IV, os elétrons estão revertendo o curso, viajando de volta para a matriz mitocondrial. Lembre-se, a matriz mitocondrial é N dopada por causa do bombeamento de prótons, então esses elétrons estão viajando do lado positivo da membrana para o lado negativo. Deve ser difícil.
- no complexo IV, O transporte de elétrons está na direção oposta dos outros complexos.
- os electrões viajam do lado intermembranar do espaço para o lado da matriz mitocondrial, contra o gradiente de carga.
vamos dar outra olhada nos ligandos importantes para o complexo. Um desenho animado é mostrado abaixo. No desenho animado, a molécula de O2 é mostrada ligando-se nessa posição entre o heme a3 e a CuB. O local do metal dinuclear é onde a molécula de oxigénio é reduzida a água.
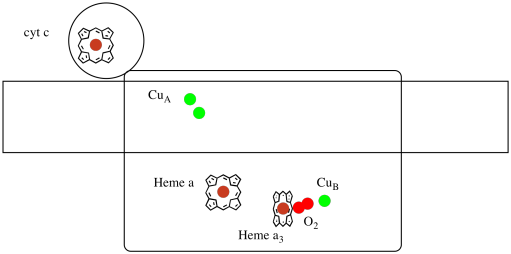
como quatro elétrons são necessários para reduzir O2 a H2O, quatro moléculas do citocromo c devem se ligar no complexo IV antes que essa redução possa prosseguir. É provável que o ambiente de coordenação da molécula de oxigênio — entre dois metais, ao invés de apenas ligado a um — permita que seja mais rapidamente reduzido até a água ao invés de formar espécies reativas de oxigênio que persistem na célula, como peróxidos.
exercício \(\page index{2}\)
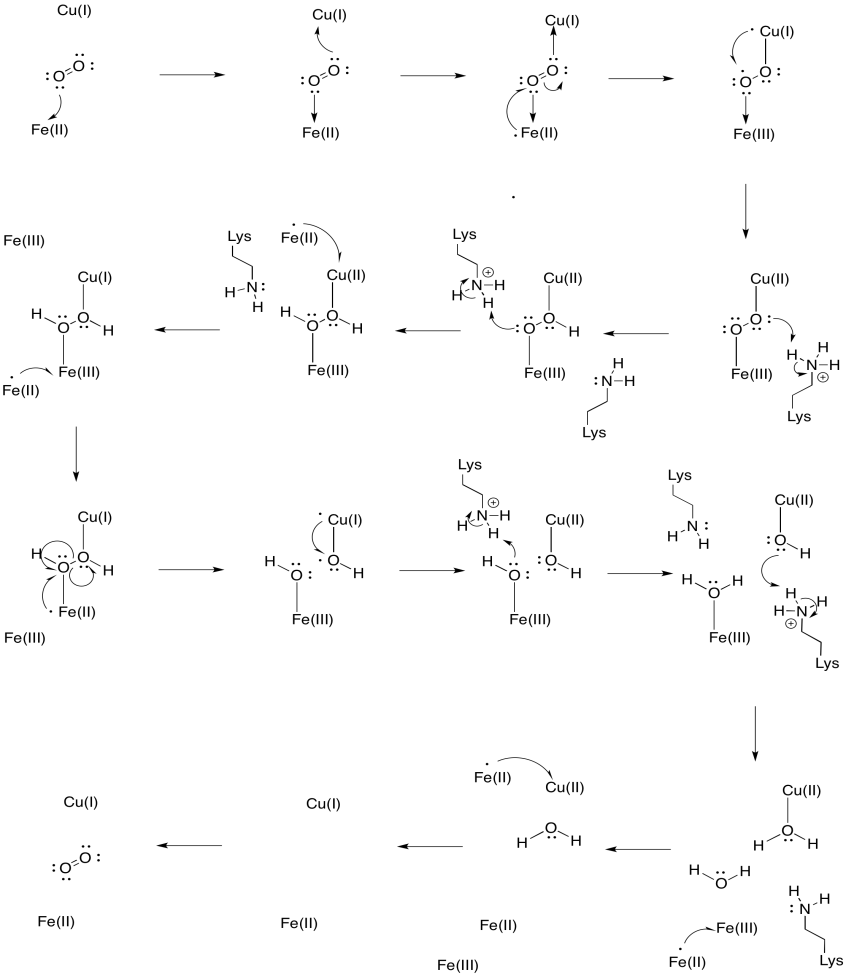
suponha que o ferro em heme a3 começa em um estado Fe(II) reduzido e o filhote começa em um estado Cu(I) reduzido. Fornecer um mecanismo para a redução do oxigênio para a água, com a adição de quatro elétrons e quatro prótons. Use Fe (II) como o doador de elétrons e lisina como o doador de prótons.Resposta
além destes dois metais, existe também um conjugado histidina-tirosina modificado ligado à CuB. Tem sido sugerido que esta tirosina fornece outra fonte de elétrons imediatos que podem ser usados na redução.
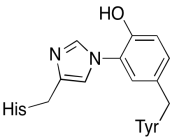
exercício \(\PageIndex{3}\)
mostrar por que uma tirosina pode ser uma fonte de um próton e um elétron em processos bioquímicos.Resposta
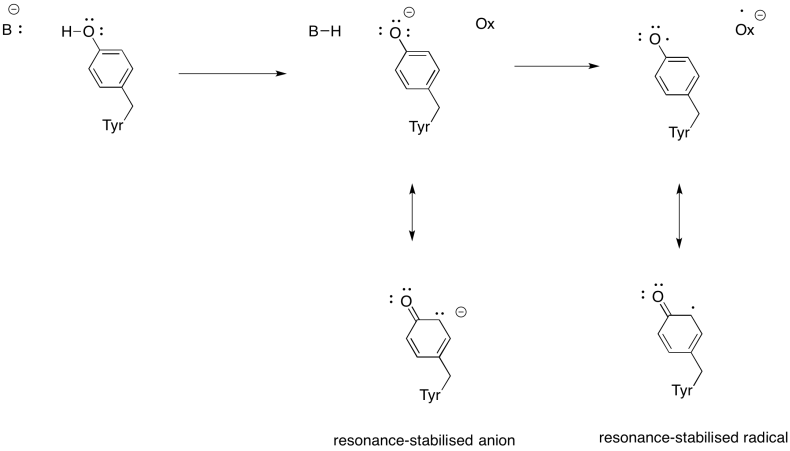
além da necessidade de reduzir o oxigénio à água, o complexo IV também contribui para o gradiente de protões, bombeando protões adicionais através da membrana mitocondrial. Essa tarefa apresenta desafios adicionais. Um simples mecanismo de acoplamento não é possível, porque os elétrons estão se movendo na direção oposta. É embora que o mecanismo envolve mudanças conformacionais na proteína que ocorrem quando os metais mudam estado de oxidação. Mudanças sutis no ambiente de coordenação podem resultar em deslocamento de resíduos de aminoácidos nas proximidades. É fácil imaginar que se um aminoácido particular se desloca para cima em direção ao espaço intermembranar, ele pode puxar um próton com ele.
- bombeamento de protões e transporte de electrões em direcções opostas no complexo IV e deve ser desengatado.Bombeamento de prótons no complexo IV deve depender de mudanças conformacionais.
exercício \(\PageIndex{4}\)
o site da CuA contém dois coppers, boound by two bridging cisteines. Ambos estão ligados por histidines terminais. Além disso, um cobre é ligado por uma metionina adicional, enquanto o outro é ligado por um carbonil da espinha dorsal proteica.
- extraiam os chumbos nos seus locais de ligação.
- descreve a geometria de cada cobre.
- se cada cobre é Cu (I), Qual é a contagem coordenada de elétrons em cada cobre no complexo?
- se cada cobre é Cu (I), Qual é a carga geral sobre o complexo?
Resposta a)
um)
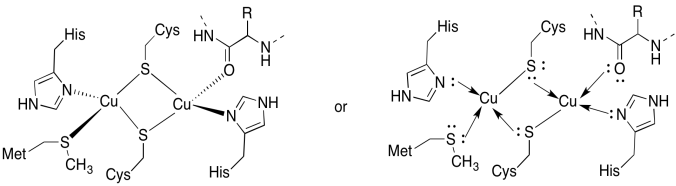
Resposta b)
b) tetraédrica
Resposta c)
c) Cu(I) = d10
4 doadores = 8 e-
> total = 18e-
a Resposta d)
d) 2 x Cu(I) = 2+
2 x Cys-S- = 2-
Todos os outros neutro
> Total = 0
Exercício de \(\PageIndex{5}\)
O cobre no Filhote site é ligado por dois histidines e a histidina-tirosina conjugado.
- extraiam o cobre no local de ligação.
- descreve a geometria do cobre.Se o cobre é Cu (I), Qual é a contagem coordenada de elétrons no complexo?Se o cobre é Cu (I), Qual é a carga geral sobre o complexo?
Resposta a)
um)
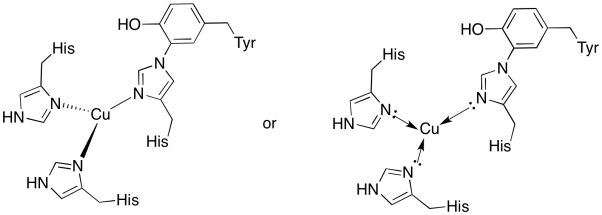
Resposta b)
b) trigonal planar
Resposta c)
c) Cu(I) = d10
3 doadores = 6 e-
> total = 16 e-
a Resposta d)
d) Cu(I) = 1+
histidines neutro
> Total = 1+
Exercício de \(\PageIndex{6}\)
É difícil medir o potencial de redução de um site individual dentro de uma proteína. No entanto, os investigadores têm sido capazes de estimar estes valores medindo espectros EPR em várias condições. Assumindo os potenciais de redução abaixo, desenhe um diagrama de progresso de reação para o transporte de um elétron de todo o caminho do citocromo c para o oxigênio molecular.Resposta
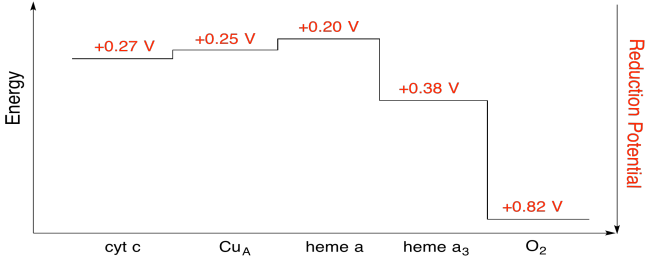
exercício \(\PageIndex{7}\)
usando os valores na figura acima, calcular a mudança de energia quando um elétron é transferido de heme a para heme a3.
resposta
assumindo que os potenciais de redução são:
heme a(ox) + e- → heme a(red) Eored = 0,20 V
heme a3(ox) + e- → heme a3 (red) Eored = 0.38 V
, em Seguida, a diferença de potencial para a reação, ΔEo = 0.38 – (0.20) V = 0.18 V.
Faraday relação ΔG = – n F ΔEo dá
ΔG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 17,367 J mol-1 = 17.4 kJ mol-1
Atribuição
Chris P Schaller, Ph. D., (Faculdade de são Bento / Saint John’s University)