Citrato de anticoagulação durante TRRC para lesão renal aguda
- Lesão renal Aguda
- Gestão de Aki – terapias de substituição renal para AKI
- Hemodiálise, hemofiltração e hemodiafiltration
- anticoagulação durante a terapêutica de substituição renal contínua (CRRT)
- Citrato – o mecanismo de sua ação anticoagulante e sua aplicação em TRRC
- Potencial de distúrbios metabólicos durante o citrato-anticoagulados TRRC
- a monitorização bioquímica dos doentes a receber CRT
Lesão renal Aguda
lesão renal Aguda (LRA), uma síndrome clínica com muitas causas possíveis, é definido simplesmente como uma súbita diminuição da função renal ao longo de um período de horas ou dias, o que é evidenciado pelo recente aumento na concentração de creatinina sérica e/ou redução na produção de urina .
é diferente da doença renal crónica (DRC) na qual a diminuição da função renal é lenta mas irreversivelmente progressiva, ocorrendo ao longo de um período de meses e anos. AKI pode, naturalmente, ocorrer em aqueles com CKD subjacente, e um diagnóstico de AKI está associado com maior do que o risco normal de um eventual diagnóstico de CKD .
orientações Internacionalmente acordadas estado que o diagnóstico de LRA pode ser feito se:
• creatinina sérica aumenta ≥ 0,3 mg/dL (26.5 µmol/L) no prazo de 48 horas; ou
• foi de 50 % ou aumento na creatinina sérica nos últimos 7 dias; ou
• volume de urina é
AKI abrange todo o espectro de gravidade desde uma leve diminuição na função renal (fase 1 AKI) a insuficiência renal (fase 3 AKI). Preparo depende de creatinina sérica de medição, com ou sem produção de urina de dados (Tabela I)
|
Fase |
a Creatinina Sérica |
da produção de Urina |
|
1 |
1.5-1.9 tempos de linha de base |
de 6 a 12 horas |
|
2 |
2.0-2.9 vezes de linha de base |
⩾ 12 horas |
|
3 |
3.0 tempos de linha de base |
para ⩾ 24 horas |
TABELA I: Os três estágios de AKI gravidade (de ref 1)
As causas AKI são convencionalmente classificados em três categorias: prerenal; renais (intrínseca); e pós-renal, enfatizando o fato de que AKI pode ter uma etiologia renal específica, mas também pode resultar de um problema primário fora do rim.
Qualquer condição que tem o efeito de reduzir o fluxo de sangue para o rim (perfusão renal) é uma causa potencial de prerenal AKI; estas condições incluem: hipovolemia, devido a vômitos, diarréia, hemorragia, queimaduras ou choque séptico; e redução do débito cardíaco devido a, por exemplo, a insuficiência cardíaca e insuficiência hepática (cirrose). A principal causa do AKI intrínseco é necrose tubular renal, resultante de isquemia renal ou ingestão de fármacos/toxinas nefrotóxicos.
Sepsis, a causa mais comum de AKI no doente crítico, deve-se, em parte, a uma lesão renal intrínseca mal definida, semelhante à necrose tubular renal . Finalmente, a AKI pós-renal resulta de qualquer condição que obstrua o fluxo de urina distal para o rim; estes incluem: cálculos renais (cálculos); doença da próstata (tumor/hipertrofia); disfunção da bexiga; e estenose uretral.
Gestão de Aki – terapias de substituição renal para AKI
não há tratamento específico para a AKI e a gestão é, em grande parte, de apoio com o tratamento dirigido para a causa subjacente. A retirada de fármacos nefrotóxicos, a reanimação de fluidos e a correcção de electrólitos e distúrbios ácido-base fazem parte deste tratamento geral de suporte . Pode ser necessária a administração de vasopressores ou fármacos inotrópicos para restaurar a pressão arterial normal e o débito cardíaco.
a terapia de substituição Renal (RRT), o foco deste artigo, representa o tratamento de último recurso para pacientes com AKI grave que não responde a um tratamento de suporte conservador. Cerca de 23% dos doentes da UCI com AKI (ou seja, cerca de 13% de todos os doentes da UCI) recebem RRT .
terapia de substituição Renal (RRT) é o termo genérico para todos os tratamentos que procuram substituir a função renal. O transplante de rim de doador para aqueles com doença renal terminal pode ser considerado o melhor RRT , mas o termo é mais frequentemente reservado para as terapias que substitua o sangue de filtragem e homeostático funções do rim por diálise, um processo que utiliza uma membrana semi-permeável como o sangue de filtro. Dois tipos amplos de RRT dialítico estão disponíveis para o tratamento do AKI (e, já agora, CKD em fase terminal): diálise peritoneal e hemodiálise.
em contraste, a hemodiálise envolve filtrar sangue em uma máquina fora do corpo (extracorpórea). O sangue é bombeado para o filtro/dialyzer, onde os resíduos e o excesso de fluido são removidos, e então retornado para o corpo. Este circuito extracorporal (a máquina de diálise e seus tubos de ligação de e para o paciente) é um ambiente procoagulante.
Hemodiálise, hemofiltração e hemodiafiltration
Modernas máquinas de diálise tem a opção para hemofiltração (HF), bem como a hemodiálise (HD), permitindo a possibilidade de três diferentes dialytic modalidades para o tratamento da AKI: hemodiálise (HD); hemofiltração (HF); e hemodiafiltration (HDF).
no núcleo de todas as três modalidades é a membrana semi-permeável que constitui um filtro de sangue. À medida que o sangue bombeado do paciente flui de um lado desta membrana, o excesso de água e solutos residuais passam através da membrana. O filtrado ou efluente é bombeado para resíduos à medida que o sangue filtrado é devolvido ao paciente.
o processo de hemodiálise (HD) envolve o uso de um fluido de diálise que flui continuamente e contracurntamente para o sangue do outro lado da membrana. A composição e o débito do fluido de diálise garantem um gradiente de concentração constante através da membrana semi-permeável em relação aos solutos sanguíneos. Estes gradientes de concentração, por sua vez, facilitam a difusão controlada de moléculas solúveis através da membrana.
Para solutos, como uréia e creatinina, que deve ser removido do sangue, o gradiente de concentração é tal que a direção da difusão é de sangue fluído de diálise, enquanto que para solutos como bicarbonato, que têm muitas vezes de ser adicionado ao sangue para corrigir a acidose associada a graves AKI, fluído de diálise com alta concentração de bicarbonato em relação ao sangue, garante que a difusão está na direção oposta, a partir de fluído de diálise para o sangue. O ajuste da composição do fluido de diálise e da taxa de fluxo assim permite a correção metabólica específica do doente.O excesso de fluido é frequentemente uma característica do AKI que é corrigido durante a hemodiálise. Isto é conseguido por ultrafiltração, que depende do gradiente de pressão hidrostática que existe através da membrana semi-permeável. A pressão hidrostática positiva relativa no lado sanguíneo da membrana efetivamente “empurra” a água do sangue para o fluido de diálise.
esta ultrafiltração também facilita a passagem de moléculas de soluto, que são arrastadas junto com água durante a ultrafiltração por um mecanismo chamado convecção de soluto (ou arrasto de solvente). O efeito combinado da difusão do soluto, convecção do soluto e ultrafiltração durante a hemodiálise visa assegurar que o volume e composição do fluido no compartimento extracelular e intracelular seja restaurado, o mais próximo possível, ao que se encontra entre aqueles com rins normalmente funcionais.
Hemodiafiltração (HDF) é a combinação de HF e HD. Permite uma depuração óptima de solutos de baixo peso molecular por difusão para o fluido de diálise, combinada com uma depuração óptima de solutos de alto peso molecular por convecção e ultrafiltração. Como em HF, HDF requer fluido de substituição contínuo; e como em HD, HDF requer fluido de diálise.Todas as terapias de substituição renal (PD, HD, HF e HDF) podem ser administradas intermitentemente (ou seja, normalmente em 3-4 sessões horárias) ou continuamente até a função renal ser restaurada. Para os doentes com insuficiência renal em fase terminal, que requerem uma RRT de vida longa (crónica), o tratamento é exclusivamente hemodiálise intermitente (IHD), quase invariavelmente administrada em quatro sessões horárias, três vezes por semana .
os doentes com AKI apenas têm um requisito temporário para a RRT suportar a função renal durante a resolução da doença crítica/aguda que precipitou a AKI. A duração média do RRT entre os pacientes com AKI é de cerca de 13 dias , embora em casos particulares possa ser necessário apenas por alguns dias, ou estender por muitas semanas.
Tradicional (valor absoluto) indicadores para a iniciação do RRT AKI incluem:
• hipercalemia (potássio plasmático > 6.0-6.5 mmol/L)
• uremia grave (plasma ureia > 30 mmol/L)
• sinais de urêmico encefalopatia
• acidose (pH • edema pulmonar agudo
pode ser benéfico para iniciar o tratamento antes que estes efeitos extremos do AKI são evidentes, mas o momento ideal para o início (e parando) RRT atualmente, não está claro e o tema da investigação em curso . Actualmente, não existem dados fiáveis que suportem um determinado tipo de RRT para a AKI e, consequentemente, foram utilizados todos os tipos de RRT.
as diretrizes atuais, no entanto, refletem um consenso de que, qualquer que seja a modalidade, a RRT deve ser entregue continuamente e não intermitentemente aos pacientes mais gravemente doentes (hemodinamicamente instáveis). Pesquisas recentes indicam que atualmente as terapias de substituição renal contínua (CRRTs) são usadas muito mais frequentemente do que as terapias intermitentes para o AKI, e que o CRRT mais comumente usado é a hemofiltração venosa venosa contínua (CVVHF), seguida por hemodiafiltração venosa venosa contínua (CVVHDF).
anticoagulação durante a terapêutica de substituição renal contínua (CRRT)
CRRT, em comum com todas as outras terapêuticas de substituição renal excepto a diálise peritoneal, envolve bombear sangue através de um circuito extracorporal não fisiológico. A propriedade inerente do sangue para coagular (coágulo) em contato com superfícies não fisiológicas determina que, a fim de manter um circuito extracorporal “livre de coágulos” do paciente, o sangue deve ser anticoagulado.
CRRT tem uma necessidade particular de anticoagulação, em comparação com modalidades intermitentes, por causa das sessões de tratamento prolongadas, e a taxa relativamente lenta em que o sangue é bombeado através do circuito . Além disso, o sangue de pacientes que necessitam de CRRT está muitas vezes em um relativo estado procoagulante devido a doença crítica subjacente (por exemplo, sépsis) ou trauma . Durante muitos anos, a heparina não fraccionada (UF) ou heparina de baixo peso molecular (LMWH) foi o único anticoagulante utilizado em procedimentos dialíticos, incluindo a CRRT. A heparina continua a ser utilizada; é um meio barato e geralmente seguro de anticoagulação para a maioria dos pacientes que necessitam de RRT.
no entanto, a anticoagulação sistémica da heparina, que não pode ser evitada, acarreta inevitavelmente um risco aumentado de hemorragia, de modo que a anticoagulação da heparina durante os procedimentos dialíticos está absolutamente contra-indicada para aqueles que estão actualmente a sangrar ou com um risco de hemorragia superior ao normal.
adicionalmente, a heparina pode, numa pequena minoria (
os riscos potenciais de hemorragia e de HIT-II associados ao uso de heparina realçaram a necessidade de um anticoagulante alternativo para alguns doentes que necessitem de RRT. O citrato forneceu essa alternativa. Anticoagulação Regional citrato do circuito de diálise, usado pela primeira vez com sucesso no início da década de 1980 , foi originalmente reservado para essa pequena minoria de pacientes para os quais heparina é contra-indicada. Isso mudou com os resultados de ensaios controlados aleatórios comparando CRRT heparina-anticoagulada com CRRT citrato-anticoagulado; estes demonstraram que o citrato é simultaneamente um anticoagulante mais eficaz e mais seguro do que a heparina . Consequentemente, o citrato tem emergido nos últimos anos como anticoagulante de eleição para todos os doentes AKI que necessitam de CRRT . Unidades de cuidados intensivos em todo o mundo estão agora relatando mudança de heparina para anticoagulação citrato regional para CRRT . Algumas autoridades estão mesmo recomendando o uso de citrato em vez de anticoagulação heparina para Hemodiálise intermitente (crônica) (IHD).
Citrato – o mecanismo de sua ação anticoagulante e sua aplicação em TRRC
Citrato, que tem sido usado para anticoagulate/preservar o sangue doado para transfusão por bem mais de um século , o que evita que o sangue coagule pela sua capacidade de vincular (quelato) o cálcio ionizado (iCa), que circula no plasma sanguíneo. Este iCa é um cofactor necessário tanto para a agregação plaquetária como para vários passos-chave nas vias intrínsecas e extrínsecas de coagulação que são responsáveis pela produção de fibrina e, consequentemente, pela formação de coágulos de fibrina.
a coagulação sanguínea é impedida pela redução da concentração plasmática de iCa para cerca de 0, 35 mmol/L (intervalo de referência normal de 1, 15-1, 30 mmol/L). Este estado hipocalcémico não fisiológico é atingido aumentando a concentração plasmática de citrato para cerca de 3 mmol/L (concentração plasmática normal de citrato ~0, 1 mmol/L ).
Apesar de existirem diferenças em detalhes descritos por Morabito et al , todos os protocolos de citrato de anticoagulação durante TRRC envolvem a infusão contínua de citrato contendo solução (geralmente de citrato trissódico ou ácido citrato-dextrose (ACD) solução) para o pré-filtro/diálise linha, perto de onde ela deixa o paciente, como uma solução separada ou combinada com predilution fluido de substituição. O caudal desta perfusão é ajustado para alcançar uma concentração de citrato sanguíneo de ~3 mmol/L, e assim um iCa plasmático de cerca de 0, 35 mmol / L.
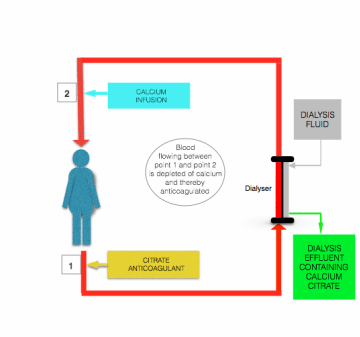
a hipocalcemia induzida pela perfusão de citrato é corrigida antes do sangue regressar ao doente, por perfusão de uma solução contendo cálcio (cloreto de cálcio ou gluconato de cálcio) na linha de pós-filtração, perto de onde entra no doente (ver figura acima).
a principal vantagem de segurança da anticoagulação citrato sobre a anticoagulação heparina é que a anticoagulação está confinada ao circuito extracorporal. Esta chamada “anticoagulação regional” é obtida porque a maior parte do citrato perfundido é removido (como aniões citrato ou quelato citrato-cálcio) do sangue durante a passagem pelo filtro/dialisador .
qualquer citrato remanescente no sangue pós-filtro é diluído na circulação sistémica e rapidamente metabolizado em dióxido de carbono e água pelo ciclo Krebs dependente de oxigénio na mitocôndria das células dos tecidos (predominantemente células hepáticas ).
o metabolismo do citrato está associado à produção de bicarbonato: para cada citrato de 1 mmol metabolizado, gera-se bicarbonato de 3 mmol. A rápida depuração do citrato (a semi-vida do citrato no sangue é normalmente de cerca de 5 minutos ) por esta via principalmente hepática normalmente garante a ausência de anticoagulação sistémica durante a CRRT, não havendo assim risco adicional de hemorragia.
Potencial de distúrbios metabólicos durante o citrato-anticoagulados TRRC
A aparente relutância de abraçar plenamente a citrato-anticoagulados TRRC para todos os pacientes com LRA, até recentemente, tem sido atribuída à preocupação em relação ácido-base e hidroeletrolítico distúrbios que podem ocorrer em pacientes recebendo tratamento .
foram notificadas as seguintes alterações electrolíticas e ácido-base em doentes a receber CRRT citrato-anticoagulado :
• hipocalcemia/hipercalcemia
• hypomagnesia/hypermagnesia
• hiponatremia/hipernatremia
• metabólica ao alkalosis
• acidose metabólica
Estes distúrbios podem surgir por uma série de razões, mas o acúmulo de citrato na circulação periférica (citrato de toxicidade), pode ser central para a maioria destes distúrbios. As razões pelas quais o citrato pode acumular-se durante a CRRT incluem:
• Progressiva redução na permeabilidade da membrana durante a diálise, com uma consequente redução da filtração do citrato e concomitante aumento de citrato de entrega para a circulação sistêmica
• erro Operacional – acidental aumento da taxa de citrato de infusão para o extracorpórea circuito e concomitante aumento de entrega de citrato para a circulação sistêmica
• produto Sanguíneo transfusão de citrato de conservante presente em produtos de sangue contribui para o citrato de carga em circulação sistêmica decorrente do TRRC
Independentemente da causa, a acumulação de citrato na circulação periférica pode resultar na quelação do citrato de cálcio ionizado circulante, com consequente redução da concentração plasmática de cálcio ionizado (hipocalcemia). Se hipocalcemia suficientemente grave pode causar arritmia cardíaca e, em última análise, paragem cardíaca .
embora o cálcio ionizado plasmático seja reduzido durante a acumulação de citrato (toxicidade), o cálcio total é aumentado (indicando hipercalcemia) porque a ligação do cálcio ao citrato está incluída na medida do cálcio total. Um aumento na relação entre o cálcio total e o cálcio ionizado (normalmente 2.0) para > 2.1 foi considerado o sinal mais fiável de toxicidade do citrato na ausência da estimativa rotineiramente disponível do citrato plasmático .
o risco de aumento do sódio plasmático (hipernatremia) associado à anticoagulação citrato deve-se ao elevado teor de sódio (hipertonicidade) de algumas soluções de citrato utilizadas na CRRT. Por exemplo, a solução de 4% de citrato trissódico que é usado em alguns protocolos contém sódio a uma concentração de 420 mmol/L. Na prática, o uso de hipotônico diálise/substituição de fluidos pode mitigar este risco e hipernatremia é por todas as contas, uma rara complicação de citrato de anticoagulação .
o risco de hipomagnesia (magnésio sérico reduzido) durante a anticoagulação citrato reflecte o facto de, tal como o cálcio, o magnésio ser um ião divalente que também se pode ligar ao citrato (quelato). Se as perdas de magnésio devidas à acção quelante do citrato não forem totalmente compensadas pelo magnésio em fluidos de diálise/de substituição, pode ocorrer hipomagnesia .
a monitorização bioquímica dos doentes a receber CRT
Point-of-care testing usando um sangue analisador de gás localizado dentro da unidade de terapia intensiva, permite a rápida e conveniente de medição da maioria dos parâmetros (cálcio ionizado, pH, bicarbonato, excesso de base, de sódio e lactato), mas soro total de cálcio e magnésio estimação não são, normalmente, essas plataformas e as amostras devem ser enviadas ao laboratório para estas medições.Dois estudos recentes provam que alguns analisadores de gases sanguíneos podem não ser confiáveis na medição do cálcio ionizado nas concentrações extremamente baixas e não fisiológicas (~0.3 mmol / L) presente no sangue pós-filtro, embora a sua capacidade de medir com precisão o cálcio ionizado plasmático na circulação sistémica (onde a concentração é muito mais elevada) não esteja em dúvida.
|
Parâmetro medido |
intervalo de Monitoramento |
valores-Alvo ou aprox. intervalos de referência |
Finalidade da medida |
ação Corretiva se fora alvo |
|
Postfilter cálcio ionizado (iCa) de concentração, i.e. sangue amostrados de postfilter porta. |
dentro de 1 hora após o início e após qualquer alteração da dose de citrato, em seguida, a cada 4-6 horas |
0.25-0.35 mmol/L |
|
Ajuste de citrate dose: aumento se iCa > 0.35, diminuir se iCa |
|
Sistêmica cálcio ionizado (iCa), i.e. uma amostra de sangue do paciente |
linha de Base (antes de começar), depois de 1 hora após a partida, então, pelo menos, a cada 4-6 horas |
1.15-1.30 mmol/L |
|
Ajuste de cálcio ritmo de infusão; aumento se iCa 1.30 |
|
Sistêmica total de cálcio (TotCa), i.e. sangue amostra de paciente (TotCa = iCa + cálcio ligado à albumina + cálcio dependente de citrato de) |
No mínimo, a cada 12 a 24 horas (deve ser simultânea sistêmica cálcio ionizado estimativa) |
necessário Apenas para a determinação de totCa:iCa ratio (veja abaixo) |
||
|
Proporção do total de cálcio ionizado (TotCa:iCa) |
No mínimo, a cada 12 a 24 horas |
Para detectar citrato de acumulação/toxicidade às vezes chamado de “o citrato de bloqueio” |
as Opções incluem::
|
|
|
sangue Arterial análise de gás
|
Linha de base (antes de começar) . no período de 1 hora após o início, então pelo menos de 4 a 6 horas. |
pH 7.35-7.45 bicarb 23-28 mmol/L SER–2-+3 mmol/L |
Para detectar ácido-básico, distúrbios: metabólica ao alkalosis acidose metabólica |
Opções no caso do metabólica ao alkalosis incluem:
|
|
níveis de sódio |
uma Vez por dia |
135-145 mmol/L |
Para detectar hipernatremia/hiponatremia |
Raro – verificar a correta diálise/fluido de substituição |
|
lactato Sérico |
linha de Base (antes de começar), de acordo com necessidades clínicas |
Para ajudar a identificar os que estão em risco de citrato de toxicidade |
Considere-se, juntamente com TotCa:iCa ratio, risco de citrato de toxicidade |
|
|
Soro de magnésio |
Pelo menos uma vez por dia |
Para detectar hypomagnesia |
Correção com infusão de magnésio |
TABELA II: Bioquímica monitoramento durante citrato-anticoagulados TRRC (Ref 24)