Cloreto de canais iônicos e transportadores: a partir de curiosidades da natureza e da origem da doença humana para alvos de medicamentos
Publicado: 20 de agosto de 2013 | |
logo no Início de seu ensino de graduação, o aluno é apresentado a vários tipos de integrais de membrana proteínas: receptores, proteínas de adesão, canais de íons, de iões de bombas e transportadores de íons. À medida que progridem através dos seus estudos, descobrem que as famílias discretas de genes e as estruturas proteicas são responsáveis por estas diferentes classes de proteínas e nunca há qualquer razão para considerar que possa haver alguma ambiguidade na atribuição de qualquer proteína particular à sua classe proteica apropriada.
isto satisfaz praticamente todos os casos da sala de aula para o laboratório de pesquisa até que consideremos canais de cloreto. Sabemos que existem, são importantes e podem ser bons alvos de drogas em várias áreas de doenças, mas até há pouco tempo, permaneceram um pouco estigmatizadas e insalubres no mundo da terapia. A falta de ligandos seletivos não ajudou em nada. A única exceção a isso foi o receptor GABA-um receptor que é acoplado a um canal de cloreto intrínseco que se abre após a ligação do neurotransmissor inibitório GABA. As benzodiazepinas têm potenciado este receptor desde que o Valium se tornou disponível na década de 1960, proporcionando efeitos sedativos e anticonvulsivantes. Isto introduz um conceito importante: existem várias famílias de genes e diferentes tipos de proteínas que podem ser descritos como sendo canais de cloreto.
isto está em contraste com o que entendemos dos canais iônicos seletivos cation, onde há pouca flexibilidade na estrutura proteica que pode formar um poro seletivo para potássio, sódio ou cálcio; a diversidade destes canais iônicos é provocada pelas variações nos domínios proteicos distintos do poro que influenciam o comportamento de abertura-fechamento. Para ser justo, não parece haver muitas razões fisiológicas pelas quais um canal de ânion deve exibir seletividade cloreto, uma vez que há pouco papel fisiológico no transporte de membrana de outros haletos ou aniões pequenos; qualquer canal de anião será, por padrão, um canal de cloreto de um ponto de vista fisiológico. Por outro lado, as correntes das membranas de potássio, sódio e cálcio desempenham papéis fundamentais diferentes e a permeabilidade seletiva das membranas a estas catiões é crucial para a função celular e, na verdade, para a própria vida.
os receptores GABA – A são membros das famílias de canais de iões pentaméricos de ciclo cys, que incluem vários tipos de canais excitatórios e inibitórios de neurotransmissores. A proteína do regulador transmembranar da fibrose cística (CFTR) é um canal de cloreto regulado para nucleótidos. É um membro da família de transporte ATP (ABC) e é o único que não parece transportar qualquer substrato através de uma membrana, mas funciona como um canal de cloreto. A família CLC de canais de cloreto com voltagem surge de outra família genética distinta e tem uma estrutura geral única entre as proteínas da membrana. Esta família de proteínas trouxe muitas surpresas ao longo dos últimos 30 anos e os membros desta família serão introduzidos aqui e também como eles podem ser considerados alvos de drogas.
outros desenvolvimentos excitantes do campo do canal de cloreto surgiram após a identificação molecular de proteínas subjacentes aos canais de cloreto ativado pelo cálcio (ClCa). Funcionalmente, sabemos sobre os seus papéis fisiológicos há algum tempo, mas a recente identificação molecular das proteínas do canal permitiu o desenvolvimento de ferramentas moleculares e farmacológicas para sondar e alterar a sua actividade. Esta revisão centra-se no potencial farmacológico de direccionar os canais ClCa e as proteínas CLC; a sua função e localização subcelular estão resumidas na Figura 1.
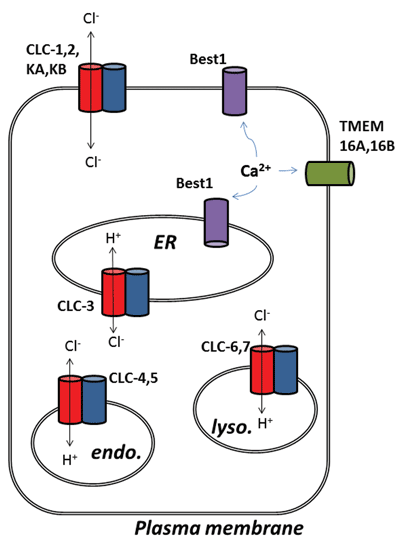
Figura 1
An introduction to CLC proteins
The nine members of this protein family are CLC-1 to 7, CLC-KA and KB. O membro fundador, CLC-1, é o canal de cloreto revestido de voltagem do músculo esquelético e será discutido abaixo. Muitos estudos funcionais foram realizados em um homólogo com o título honorário de CLC-0, isolado do órgão eletroplax elétrico, que permite que o raio atordoe suas vítimas aquáticas. A reconstituição do CLC-0 em bilayers lipídicos e o registo electrofisiológico das correntes que fluem através de canais iónicos únicos revelaram uma propriedade intrigante. Normalmente, ao gravar a corrente a partir de um pequeno pedaço de membrana contendo um único canal iónico, observa-se flutuações entre duas amplitudes de corrente: uma representando o canal fechado e a outra representando a corrente que flui através do canal aberto. As flutuações refletem transições entre Estados cinéticos abertos e fechados. Com CLC-0, no entanto, era evidente que a proteína do canal iônico único consistia de dois poros equivalentes que poderiam abrir independentemente1. Por conseguinte, este canal foi descrito como sendo de duas barras (Figura 2). Assim, não foi de grande surpresa que as estruturas cristalinas de homólogos de bactérias entéricas revelassem que o complexo proteico era um dímero, com cada subunidade possuindo um pathway2 condutor de iões (Figura 2).
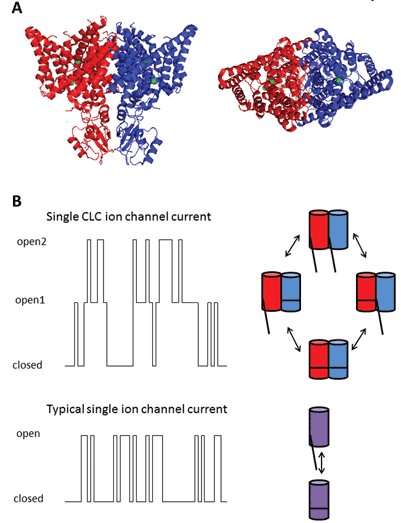
Figura 2
a segunda surpresa surgiu quando experiências funcionais detalhadas foram realizadas em CLC-ec1 de E. coli. Ao invés de funcionar como um canal de cloreto, como seu parente há muito perdido no músculo esquelético vertebrado, CLC-ec1 é um transportador de troca 2Cl-/H+, ou antiporter, com strict 2:1 stoichiometry3. Esta proteína é importante para a sobrevivência de bactérias entéricas em baixo pH4 e é provável que Explore um gradiente de cloreto para manter o pH celular em um nível tolerável. Consequentemente, os CLC procarióticos podem ser alvos de inibidores para tratar a E. coli patogénica ou a infecção por Salmonelas4. A descoberta do comportamento de troca de iões estimulou naturalmente outras tentativas para determinar se alguma desta troca cloreto-por-protões existia em CLCs de mamíferos, assumindo que a troca Cl–/H+ poderia ser a verdadeira função dos CLCs arquetípicos e aqueles identificados como canais de cloreto poderiam ser apenas exceções à regra. Este parece ser o caso, pois há fortes evidências de que CLC-3 até CLC-7 funcionam como transportadores de troca 2Cl–/H+, principalmente residentes em organelas intracelulares, enquanto CLC-1, CLC-2, KA E KB São canais iônicos condutores de membrana plasmática verdadeiros. Uma vez que a propriedade do CLC arquetípico é o transporte de troca, sendo encontrada em todas as formas de vida celular, a última subclasse de proteínas, os canais de cloreto de boa fé, pode, portanto, ser considerada como transportadores de cloreto “quebrados”, que perderam o acoplamento do transporte de cloreto ao movimento de um segundo íon substrato.
CLC-1
este fundador da família CLC é o canal de cloreto revestido de voltagem do músculo esquelético e serve para regular o potencial de membrana e repolarizar a membrana após potenciais de ação para relaxar o músculo. Na maioria dos tecidos, seria de esperar que os canais de potássio desempenhassem este papel, o que fazem no músculo cardíaco e liso, bem como regulando a excitabilidade da membrana em outros tipos de células. O sistema túbulo transversal é uma extensão da membrana plasmática (sarcolemma) e penetra no tecido contráctil. É fundamental para a rápida propagação da atividade elétrica em todo o músculo e orquestra a contração rápida e controlada. O efluxo de potássio das células musculares para o espaço confinado do túbulo aumentaria a concentração de potássio extracelular e colapsaria este gradiente iónico, o que levaria a uma despolarização prolongada da membrana. Com canais de cloreto desempenhando o papel predominante de repolarização, isso é evitado. A perda de mutações de função no CLC-1 conduz à miotonia no homem, cabras e ratinhos (para uma revisão recente, ver10) e caracteriza-se por uma diminuição do relaxamento muscular, consistente com a perda de uma corrente de membrana repolarizante.
com expressão confinada ao músculo esquelético, a CLC – 1 pode ser um alvo atraente para fármacos que controlam a contracção muscular através do aumento ou diminuição da função CLC-1 e assim reduzir ou aumentar a excitabilidade muscular, respectivamente. Compostos que aumentam a função CLC-1 podem ser capazes de tratar a miotonia, particularmente nos casos em que podem compensar a perda parcial da actividade do canal de cloreto. A inibição do CLC-1 pode reduzir o limiar de contracção muscular e pode ser útil em casos de fraqueza muscular ou doenças degenerativas, tais como Distrofia muscular.
CLC-2
o canal de cloreto retificante interiormente, CLC-2, tem uma distribuição tecidular um pouco generalizada. Pode ser encontrada nos neurónios centrais onde regula a actividade11-13 neuronal. Nos astrócitos, o seu alvo subcelular para as junções celulares é regulado por uma interacção com o GlialCAM (MLC1), mutações nas quais perturbam este alvo e causam leucoencefalopatia megalencefálica. Os interesses terapêuticos recentes envolvem a expressão CLC-2 na mucosa intestinal e bronquíolos pulmonares, onde desempenha um papel nas secreções intestinais e pulmonares, respectivamente. Lubiprostone, um medicamento usado clinicamente para aliviar a obstipação foi proposto para exercer seu efeito ativando CLC-2, mas este efeito é controverso. Embora este composto Active canais CLC – 2 em alguns estudos, noutros regula o tráfico CLC-2 e aumenta a função CFTR através da activação dos receptores prostaglandinas15,16. No entanto, continua a haver provas suficientes de que o aumento da função CLC-2 das vias aéreas poderia fornecer uma via alternativa de cloreto em fibrosis17 cística.
CLC-KA/KB
estes canais de cloreto são notavelmente expressos em epitélios renais e contribuem para a permeabilidade das membranas celulares ao fluxo de cloreto passivo. Eles têm um papel fundamental nos membros ascendentes e túbulos distais do nefron, proporcionando uma via basolateral para reabsorção de cloreto, após o transporte da urina primária através da membrana apical. O gene CLCKB, que codifica CLC-KB, é um dos cinco genes subjacentes à síndrome de Bartter. As mutações de perda de funções na CLC-KB resultam em reabsorção defeituosa de cloreto, o que leva a uma desordem de desperdício de sal, que está associada à poliúria. Uma das principais características dos indivíduos que são afetados por mutações CLC-KB (Tipo III de Bartter) é a pressão arterial baixa. Uma forma mais grave da doença é causada por mutações no gene BSND (Tipo IV de Bartter), que codifica Barttin, uma proteína acessória importante para o tráfico de CLC-KA E KB para o plasma membrane18. Esta forma de desordem também inclui surdez sensorial, que se acredita ser causada pela perda do tráfico de CLC-KA e KB para membranas epiteliais no ouvido interno. Presumivelmente, a perda de qualquer atividade CLC-KA ou KB, mas não ambas, pode ser tolerada pelo sistema auditivo. Isto sugere que os inibidores selectivos para CLC-KA ou CLC-KB, ou inibição parcial de ambos, podem actuar como um diurético de ciclo novo com potencial para baixar a pressão arterial e com poucos efeitos secundários. Isto levou ao estudo da sua farmacologia e ao desenvolvimento de novos inibidores derivados com baixa afinidade19 micromolar, que tiveram efeitos diuréticos quando administrados a rats20. Por outro lado, medicamentos que ativam canais CLC-KB podem aumentar a atividade residual de canais defeituosos em pacientes de Bartter tipo III.
CLC-7
da subclasse 2CL- / H+ do transportador de permuta, a CLC-7 é um alvo promissor para a acção do fármaco e a sua inibição pode ser benéfica na osteoporose. Mais uma vez, esta indicação tem a sua origem a partir de observações da doença humana causada por mutações de perda de funções no CLC-7, que causam osteropetrosis21. Nesta doença, a remodelação óssea por osteoclastos é deficiente, o que se pensa ser causado por secreção ácida e enzimática defeituosa. Isto conduz a osso denso, o que,se reproduzido por um inibidor CLC-7, pode reduzir a dissolução do osso e, portanto, reforçar o esqueleto dos pacientes com osteoporose 22, 23. Em estudos de demonstração do conceito, a inibição farmacológica da acidificação24 ou a interrupção da função CLC-7 por antitrobodies25 reduziram a reabsorção óssea. No entanto, a inibição CLC-7 pode não estar isenta de complicações porque estudos em seres humanos e em ratinhos sugerem que a falta de função CLC-7 Pode também estar associada a distúrbios de armazenamento e degeneração neuronais devido à redução da função lisossómica 26.
Perda-de-função humanos mutações – lições de CFTR
vale a pena uma breve pausa neste ponto, considerar que algumas das indicações terapêuticas para o romance CLC-drogas alvo objectivo para o tratamento de doenças distintas, e a extremidade oposta do espectro para aqueles que são causados por defeitos de CLC função. Além dos descritos acima, a doença de Dent I é uma doença renal associada a X que é causada pela perda da função CLC-5 (ver27 para uma revisão recente). Todos são doenças hereditárias raras e um grande defeito proteico envolve a redução da actividade proteica ou o tráfico para a membrana alvo. Na verdade, muitas mutações individuais causam retenção de ER e uma falta de maturação proteica. Um paralelo pode ser feito com fibrose cística, com a maioria dos indivíduos afetados possuindo a mutação ΔF508 retida pelo ER. Abordagens recentes e estratificadas para o tratamento da fibrose quística foram o resultado de um ataque duplo para corrigir a dobragem de proteínas mutantes (correctores CF) e/ou aumentar a actividade dos canais de cloreto de CFTR da membrana plasmática (potenciadores CF). O sucesso está emergindo com a classe potenciador28, que é eficaz em pacientes com mutações que reduzem a atividade de TFTR sem perda de biossíntese proteica ou tráfico (por exemplo, G551D), no entanto, a eficácia dos corretores dobráveis (que é necessária na maioria dos casos) permanece por estabelecer 29. Embora as doenças associadas à perda da função CLC sejam todas doenças genéticas raras, Podemos um dia ser capazes de tratar indivíduos com miotonia, síndrome de Bartter, doença de Dent e osteopetrose, bem como fibrose cística com medicamentos que corrigem a causa real da sua doença.
canais de cloreto ativados pelo cálcio
finalmente, será feita menção de canais de cloreto ativado pelo cálcio (ClCa), que têm papéis fisiológicos claramente definidos em uma série de tipos de células, ainda que sua identificação molecular sofreu alguns falsos e stuttered starts. A história envolve quatro tipos de proteínas: membros das famílias de genes CLCA, Bestrophin, Tweety e TMEM16. Em todos os casos, a sua sobre-expressão recombinante resultou na geração de correntes de cloreto de membrana que são estimuladas através do aumento da concentração intracelular de cálcio e, em graus variáveis, da despolarização da membrana. A viagem para a CLCA chegou ao fim quando se descobriu que esta era uma proteína que foi secretada, mas também provavelmente aumentou a expressão da membrana dos canais ClCa endógenos para a expressão System 30. As proteínas do Tweety e da Bestrofina não exibem todas as propriedades dos canais ClCa estudados nos principais tecidos, embora o Best1 pareça responsável por um componente da ClCa nos neurónios sensoriais 31 e possa também ser um importante regulador da libertação de cálcio do reticulum32 endoplasmático 33. Três estudos independentes propuseram TMEM16A (também chamado Ano1) como um candidato para um componente principal, se não na sua totalidade, para um canal de cloreto ativado pelo cálcio 34-36. Muitos estudos subsequentes, facilitados pela geração de ferramentas moleculares, têm apoiado isso. A TMEM16A é importante para regular a excitabilidade das membranas no músculo liso vascular, é upregulada num modelo animal de hipertensão pulmonar e o tónus pode ser reduzido pela inibição do canal 37,38. Nos neurónios sensoriais, a TMEM16A associa a presença de mediadores inflamatórios à hiperexcitabilidade das membranas e a inibição da TMEM16A tem efeitos antinociceptivos 39. Em modelos animais de asma, a expressão deste canal de cloreto em particular aumenta e a sua inibição pode ter efeitos benéficos 40. É também encontrada em células intersticiais de Cajal do intestino e a função do canal é necessária para a contração rítmica do músculo liso na parede intestinal 41. Além disso, a activação da TMEM16A pode fornecer uma via alternativa para a secreção de cloreto epitelial em fibrosis42 císticos. Enquanto ainda há algum debate em torno da função precisa do resto do TMEM16 família, ClCa função tem sido também atribuída a TMEM16B (Ano2), que é pensado para fundamentam a ClCa canal no olfativa cabelo cells43,44. Pode também haver papéis para esta classe de canal iónico na biologia celular do cancro e a sua inibição pode prevenir a proliferação celular 45-48.
observações conclusivas
esta revisão destacou os diversos papéis de condução de cloreto ou transporte de proteínas e como a sua disfunção está associada a desordem humana ou sintomas semelhantes a doenças em modelos animais. Há uma grave falta de reagentes farmacológicos que inibem, ativam ou melhoram o tráfico de membranas de canais de cloreto e transportadores. O progresso está sendo feito com medicamentos que revertem a função defeituosa de TFTR na fibrose cística, o que, esperamos, resultará em medicamentos que são específicos para os diferentes tipos de mutação hereditária. Os inibidores e activadores dos canais de cloreto activados pelo cálcio TMEM16A42,49 estão a provar a utilidade de ferramentas laboratoriais e novos compostos podem tornar medicamentos eficazes, particularmente se puderem produzir efeitos específicos nos tecidos. Moléculas específicas para CLCs particulares são provavelmente as mais elusivas. Compreender a base estrutural da activação50 da CLC relacionada com a tensão pode identificar domínios proteicos que são alvo de uma concepção racional da droga baseada na estrutura. Estas ferramentas permitir-nos-ão pôr à prova algumas das novas ideias terapêuticas que foram revistas e aqui apresentadas.
Autor Biography

Dr. Jon Lippiat completou seu doutorado sobre a estrutura, função e farmacologia dos canais de potássio na Universidade de Leicester. Estudou função pancreática das células beta e diabetes na Universidade de Oxford antes de ser nomeado Professor de farmacologia na Universidade de Leeds. Sua pesquisa envolve elucidar as propriedades estruturais e fisiológicas de vários tipos diferentes de canal iônico e transportador e seu potencial alvo por novos reagentes farmacológicos.
Problema
Problema 4 2013
tópicos Relacionados
canais de Cloreto, Alvos de medicamentos, os Canais de Iões