Clostridium acetobutylicum
A Microbial Biorealm page on the genus Clostridium acetobutylicum
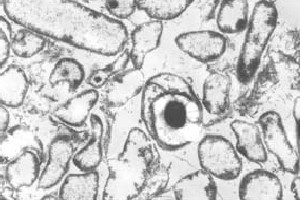
Classification
Higher order taxa
Bacteria (Domain); Firmicutes (Phylum); Clostridia (Class); Clostridiales (Order); Clostridiaceae (Family); Clostridium (género)
espécie
Clostridium acetobutylicum
Clostridium acetobutylicum ATCC 824 é considerada a estirpe tipo.
NCBI: Taxonomia
Descrição e significado
Clostridium acetobutylicum é um Gram-positiva bacillus (1). C. acetobutilicum é mais frequentemente habitada pelo solo, embora tenha sido encontrada em vários ambientes diferentes. É mesófilo com temperaturas óptimas de 10-65 ° C. Além disso, o organismo é sacarolítico (pode decompor o açúcar) (1) e é capaz de produzir diversos produtos comercialmente úteis, nomeadamente acetona, etanol e butanol (2).
C. acetobutilicum requer condições anaeróbias para crescer em seu estado vegetativo. Em seus Estados vegetativos, é móvel via flagela em toda a superfície. Ele só pode sobreviver até várias horas em condições aeróbicas, em que irá formar endósporos que podem durar anos, mesmo em condições aeróbicas. Só quando estes esporos estiverem em condições anaeróbicas favoráveis é que o crescimento vegetativo continuará (1). Foi isolado pela primeira vez entre 1912 e 1914 (2). Chaim Weizmann cultivou a bactéria para produzir acetona, etanol e butanol em um processo chamado método ABE. Assim, é adequado que C. acetobutilicum é muitas vezes chamado de “organismo Weizmann”.”Os produtos foram então utilizados na produção de TNT e pólvora na Primeira Guerra Mundial (3). Após a Primeira Guerra Mundial, o processo ABE foi amplamente utilizado até a década de 1950, quando os processos petroquímicos tornaram-se mais rentáveis devido ao custo e disponibilidade de fontes de combustível de petróleo. A recente crise dos combustíveis fósseis tem impulsionado mais pesquisas sobre C. acetobutylicum e a utilização do processo ABE (2).
além de ser uma bactéria importante para uso industrial, C. acetobutilicum é estudado como modelo para a formação de endosporos em bactérias. Foi comparado com a bactéria endospora mais estudada, Bacillus subtilis (2). Compreender as vias de formação de endosporos é importante porque muitas bactérias formadoras de endosporos são patógenos humanos, tanto nos gêneros Bacillus e Clostridium.
a estirpe mais frequentemente estudada é a estirpe-tipo ATCC 824. Esta estirpe foi descoberta e isolada em solo de um jardim de Connecticut em 1924. Pesquisas indicaram que o amplamente estudado ATCC 824 está intimamente relacionado com a estirpe Weizmann utilizada na produção industrial precoce de acetona (2).
estrutura do genoma
o genoma do clostridium acetobutylicum ATCC 824 foi sequenciado usando a abordagem da caçadeira. Esta é a estirpe modelo para bactérias produtoras de solventes. O genoma consiste de um cromossoma circular e um plasmídeo circular. O cromossoma contém 3.940.880 pares de base. Há pouco viés de cadeia, com aproximadamente 51,5% dos genes sendo transcritos da cadeia dianteira e 49,5% da cadeia complementar (2).
os genes notórios comuns às bactérias incluem os 11 operadores que codificam os ribossomas. É interessante que cada um destes operões está perto da oriC (origem da replicação) e orientado na direção da cadeia líder do garfo de replicação. (2). Esta é uma característica comumente observada conhecida como dosagem de genes, na qual genes altamente transcritos são colocados perto da oriC. Devido à orientação destes genes, eles serão transcritos em maior número enquanto o DNA está em processo de replicação e há cópias adicionais do gene presente dentro da célula.
além disso, o genoma contém um plasmídeo grande (chamado megaplasmídeo). Este plasmídeo parece conter quase todos os genes envolvidos com a produção de solventes e é apropriadamente chamado pSOL1. pSOL1 contém 192.000 pares de base e códigos para 178 polipeptídeos. O exame do plasmídeo não indica qualquer desvio em que a cadeia é a cadeia de codificação (2).
quando Clostridium acetobutylicum é cultivado em cultura contínua ou passa por muitas transferências, a estirpe degenera lentamente, perdendo a sua capacidade de produção de solventes. Experimentos para determinar quais as causas da degeneração mostraram que pSOL1 contém quatro genes que são vitais para a produção de álcool e acetona. Ao longo de muitas transferências ou crescimento vegetativo contínuo, este plasmídeo é perdido. Outra evidência para a perda deste plasmídeo que leva à degeneração da estirpe é que os mutantes que não possuem estes genes e que são incapazes de produzir a produção de acetona e álcool de retomada com solventes após a complementação dos genes através de plasmídeos (4).Outras estirpes de C. acetobutilicum, menos estudadas, tais como o ATCC 4259, demonstraram degeneração semelhante. O plasmídeo desta estirpe chama-se pWEIZ. Mais uma vez, a degeneração devido à cultura em série desta estirpe é pensado para ocorrer por causa de eventual perda pWEIZ. Vale a pena notar esta estirpe porque, curiosamente, estas estirpes degeneradas também não esporulam. Isto tem estimulado a idéia de que os genes envolvidos na esporulação também existem no plasmídeo em ambos ATCC 4259, bem como a estirpe tipo, ATCC 824 (4, 2).
metabolismo energético e subprodutos
Clostridium acetobutylicum é um quimioorganotrófico. Obtém energia através da fosforilação do substrato por fermentação. Como em toda a fermentação, o substrato são moléculas orgânicas que atuam como o doador de elétrons e aceitador. Segue-se que é heterotrófica com sua fonte de carbono vindo de moléculas orgânicas. Em particular, C. acetobutilicum requer uma fonte de hidratos de carbono capaz de sofrer fermentação para sobreviver (1).
além disso, C. acetobutilicum é um anaeróbio obrigatório. Ele só pode sobreviver horas em um ambiente aeróbico antes de passar por esporulação como um meio de sobreviver por períodos de tempo muito mais longos no ambiente aeróbico. Não apresenta atividade da catalase, uma enzima importante para organismos aeróbicos, a fim de converter um subproduto tóxico do metabolismo do oxigênio, peróxido de hidrogênio, para água e oxigênio (5). No entanto, contém muitas enzimas que lhe permitem sobreviver em ambientes microóxicos, como a superóxido dismutase. Estas enzimas são upreguladas na presença de oxigénio e contribuem para a sobrevivência celular a curto prazo em ambientes microóxicos (6).
C. acetobutilicum é capaz de usar uma série de diferentes carboidratos fermentáveis como uma energia, bem como carbono, Fonte. Códigos do genoma das proteínas que contribuem para a degradação do xilano, do levano, da pectina, do amido e de outros polissacáridos (2). Curiosamente, enquanto genes que comumente codificam celusomas, complexos proteicos que decompõem a celulose cristalina, estão presentes, o organismo é incapaz de crescer apenas em substratos de celulose (7).Foram investidas consideráveis pesquisas em vias metabólicas de Clostridium acetobutylicum, a fim de melhorar as operações de fermentação industrial. As vias metabólicas que produzem solventes úteis para a indústria são mais notáveis em C. acetobutilicum. Os solventes acetona, acetato, butanol, butirato e etanol são todos derivados do precursor comum, acetil-CoA (2). Além destes produtos, são produzidos CO2 e H2 (1).Outra via metabólica notável é que alguns clostrídios (incluindo C. acetobutilicum) são capazes de “fixar” o nitrogênio atmosférico. O processo de fixação do nitrogênio reduz o N2 atmosférico em amônia, que é então incorporado em moléculas através da biossíntese. Isto foi determinado usando uma forma rotulada de nitrogênio, 15N2. Após sequenciação, C. acetobutilicum ATCC 824, uma série de genes muito semelhantes aos genes fixadores de nitrogênio em C. pasteuriano foram encontrados, confirmando ainda mais a capacidade da bactéria de utilizar nitrogênio atmosférico (8).
estrutura celular e desenvolvimento
durante o desenvolvimento precoce de células, C. manchas de acetobutilicum São Gram-positivas, no entanto, pode manchar Gram-negativo com a idade da cultura. Durante o crescimento vegetativo, a célula tem flagela peritrichous (flagela que cobre toda a superfície da célula) (1). O aumento da motilidade das bactérias tem sido implicado no aumento da produção de solventes devido à quimiotaxia. Os atractivos incluem o ácido butírico e o açúcar. Repulsivos notáveis incluem acetona, butanol e etanol. Este mecanismo é lógico em permitir que a célula encontre nutrientes e se afaste dos subprodutos produzidos pelo seu próprio metabolismo (9).
além disso, diferentes subprodutos são produzidos em diferentes fases de crescimento em C. acetobutilicum. Durante a fase de crescimento exponencial, os produtos primários são acetato e butirato. Durante esse tempo, também ocorre fixação de nitrogênio (8). Algum tempo após a célula entrar em fase estacionária (18 horas), a produção de butanol e pico de acetona (1). Esta separação temporal da fixação do nitrogênio e da produção de solvente é vantajosa para evitar a concorrência dos redutantes pelo processo dois (8).
o principal estágio de desenvolvimento celular é caracterizado pela formação de um endosporo. Um endosporo é o tipo de célula mais resistente conhecido. Em certos sinais ambientais, a célula vegetativa produz um septo subcterminal( 1), um evento que pode ser visto com microscopia eletrônica . Este septo eventualmente se torna outra célula, chamada de forespore, engolida pela célula original, chamada de célula-mãe. O forespore é composto por uma camada de córtex (principalmente peptidoglicano) e proteínas de revestimento. Estas duas camadas altamente resistentes rodeiam o núcleo, que é um citoplasma altamente desidratado. O núcleo é definido por absolutamente nenhum metabolismo ocorrendo dentro da célula. A célula-mãe lyses liberta o esporo Maduro. Este esporo maduro é resistente a altas temperaturas, produtos químicos e muitos tipos de radiação, permitindo-lhe sobreviver por um número extraordinário de anos. Em outras pistas ambientais, como um ambiente anóxico, a célula germina e inicia novamente o ciclo vegetativo (10). A formação de esporos começa quando a célula é exposta a condições desfavoráveis. Condições aeróbicas, formação de subprodutos orgânicos, e dissipação do gradiente de protões fora da membrana citoplasmática, todos levam à esporulação. Isto está em contraste com o organismo modelo de formação endoespacial, Bacillus subtilis, que forma endósporos principalmente devido à limitação de nutrientes (10).
Ecology
While the type strain of C. acetobutilicum foi isolado do solo, C. acetobutilicum é onipresente. Foi encontrado em” lake sediment, well water, and clam gut ” (1). Além disso, foi registrado em um número de diferentes espécimes de fezes, incluindo fezes humanas, bovinas e caninas (1). Uma pesquisa na literatura revela que as relações patogênicas ou simbióticas não estão documentadas.
patologia
C. acetobutilicum é completamente benigno tanto para plantas como para animais, no entanto, muitas outras espécies do género Clostridium são agentes patogénicos conhecidos, incluindo:: Clostridium difficile, Clostridium botulinum, Clostridium tetani, e Clostridium perfringen. Em particular, C. botulinum e C. tetani, produzem algumas das neurotoxinas mais mortíferas conhecidas (11).Foi encontrado acetobutilicum no cólon humano, no entanto, não se sabe ser uma parte da flora humana normal (3). Além disso, como o organismo não parece ser tóxico para os mamíferos através da produção de substâncias intracelulares ou extracelulares, o organismo teria que estar presente em enormes quantidades para produzir qualquer ameaça (12).
a única questão da patologia com C. acetobutilicum é a aquisição de genes a partir de Clostridium patogénico como C. tetani ou C. botulinum. Embora não haja relatos de casos de C. acetobutilicum adquirindo esses genes, houve incidentes na literatura em que outras espécies de Clostridium causaram botulismo infantil com toxinas muito semelhantes às presentes em C. botulinum. A semelhança das toxinas sugere que a estirpe de Clostridium, normalmente não toxigénica, adquiriu genes codificadores de toxinas de C. botulinum, que estão provavelmente presentes num plasmídeo (13).
a aplicação à biotecnologia
Clostridium acetobutylicum tem desempenhado um papel importante na biotecnologia ao longo do século XX. Inicialmente, a acetona era necessária na produção de borracha sintética. Chaim Weizmann foi contratado para trabalhar no problema na Universidade de Manchester e a fermentação tornou-se uma rota atraente para adquirir a acetona necessária para o processo. Entre 1912 e 1914, Weizmann isolou uma série de estirpes. A melhor produção viria mais tarde a ser conhecida como Clostridium acetobutylicum. O método ABE concebido por Weizmann oferecia a vantagem de uma maior eficiência em relação a outros processos de fermentação. Além disso, poderia utilizar o amido de milho como substrato, enquanto outros processos exigiam a utilização de batatas (3).
a eclosão da Primeira Guerra Mundial em 1914 resultou em um enorme aumento na necessidade de acetona. Seria um ponto crucial no desenvolvimento do processo ABE utilizando o organismo de Weizmann. A acetona era para ser usada na produção de pólvora sem fumo, conhecida como cordite. Ao longo dos próximos anos, o processo de Weizmann seria utilizado em uma série de grandes fábricas industriais através da Grã-Bretanha. Quando a Grã-Bretanha foi cortada do acesso aos grãos durante a guerra, o processo foi transferido para fábricas no Canadá. Quando os Estados Unidos entraram na guerra em 1917, também abriram uma série de fábricas usando o método de Weizmann. Após o fim da guerra, a necessidade de acetona caiu abruptamente. No entanto, as fábricas ainda eram usadas para produzir butanol, um solvente útil na produção de lacas para a indústria automobilística em expansão. Anteriormente, o butanol tinha sido um produto residual do processo quando o foco era a produção de acetona. Ao longo do final dos anos 1920, a demanda por butanol continuou a aumentar devido ao crescimento da indústria automobilística e uma série de novas plantas abriram com enorme capacidade de produção. Duas dessas plantas descarregam 100 toneladas de acetona todos os dias. Além do butanol, o etanol industrial estava sendo produzido para uma variedade de propósitos. O gás de hidrogênio dado pelo processo foi usado para hidrogenar óleos usados para alimentos. Nesta época, o melaço tornou-se o principal substrato para a fermentação ABE. Era mais barato e mais eficiente do que o amido de milho. Quando a patente sobre a estirpe Weizmann expirou em 1937,mais novas plantas foram abertas em todo o país, bem como internacionalmente (3).No entanto, no final dos anos 1950 e 1960, a indústria petrolífera começou a subir a uma taxa inacreditável. Além disso, o preço do melaço utilizado em fermentação começou a subir acentuadamente. Enquanto métodos de fermentação mais eficientes foram desenvolvidos, eles finalmente não poderiam competir com a produção petroquímica dos solventes industriais e a maioria das plantas foram encerradas em 1957(3). No entanto, com o aumento contínuo dos preços do petróleo, tem havido desde estudos a fim de reconsiderar a fermentação como uma fonte de solventes industriais. Alguns destes processos tentaram aumentar a eficiência do processo através da manipulação genética (14). Outros examinaram a utilização de resíduos como substratos de soro de leite ou de madeira (15).
a pesquisa atual
C. acetobutilicum tem sido o foco da pesquisa como um mecanismo específico de fornecimento de medicamentos terapêuticos para regiões cancerosas do corpo. C. o acetobutilicum é necessariamente anaeróbico e, portanto, a injecção intravenosa de esporos resultará em germinação apenas em regiões hipóxicas de tumores sólidos no corpo. A manipulação genética de C. acetobutilicum, a fim de produzir enzimas que irão ativar medicamentos pro dentro da região tumoral fornece um mecanismo de entrega extremamente específico para estes locais tumorais (16).Algumas das mais recentes pesquisas investigaram métodos alternativos para produzir os solventes industriais que C. acetobutilicum tem sido usado no século passado para produzir. Em particular, o butanol recebeu especial atenção como possível fonte alternativa de combustível para automóveis. O Butanol e o etanol, ambos produtos de fermentação por C. acetobutilicum, foram estudados intensamente. Dos dois, o butanol tem vantagens sobre o etanol como fonte de combustível, bem como muitos benefícios possíveis sobre as fontes de combustível atuais, na medida em que pode oferecer menores emissões e maior eficiência. O fator mais importante no custo de produção de butanol está associado ao custo e disponibilidade do substrato. Estudos, portanto, têm sido voltados para novos métodos de utilização de substratos baratos. Em um estudo de 2006, foi proposta a fermentação de butanol através de um novo processo patenteado em substituição ao processo ABE. Envolve o uso de fibra de milho (especificamente xilem), como substrato para C. acetobutilicum, para produzir butanol barato. A principal vantagem desta técnica é que a fibra de milho é um subproduto em muitos processos agrícolas e fornece uma fonte abundante de substrato (17).Outra fonte intensa de estudo para C. acetobutilicum é a produção de gás hidrogênio como fonte de energia alternativa. O gás hidrogênio contém uma grande quantidade de energia, que pode ser uma gasolina alternativa extremamente benéfica. Em particular, a utilização de hidrogénio não produz dióxido de carbono nem gases com efeito de estufa. A maior parte do gás hidrogénio é actualmente produzido utilizando fontes não renováveis; um meio alternativo de produção através da fermentação seria extremamente valioso se os rendimentos pudessem ser aumentados tremendamente. Assim, uma série de diferentes métodos de fermentação que poderiam ser usados para melhorar os rendimentos estão sendo explorados na pesquisa mais recente envolvendo C. acetobutilicum. Em particular, um reator de cama trickle que usa glicose como substrato foi apresentado como uma possibilidade, embora os rendimentos são muito baixos para ser usado industrialmente. No entanto, algum tipo de aplicação de uma cama trickle é visto como um possível meio de produções no futuro (18).
taxonomia: NCBI
(1) Cato, E. P., W. L. George, and S. M. Finegold. 1986. Genus Clostridium, pp. 1141-1200. In: P. H. A. Sneath et al. (disfuncao.), Bergey’s Manual of Systematic Bacteriology, Vol. 2. Williams e Wilkins, Baltimore, MD.
(2) Nolling J et al., “Genome sequence and comparative analysis of the solvent-producing bacterium Clostridium acetobutylicum.”, J Bacteriol, 2001 Ago; 183 (16):4823-38.
(3) Jones, D. T., and D. R. Woods. 1986. Acetona-butanol fermentation revisited. Microbiol. Rev. 50: 484-524.
(4) Cornillot, E., R. V. Nair, E. T. Papoutsakis, and P. Soucaille. 1997. Os genes para a formação de butanol e acetona em Clostridium acetobutylicum ATCC 824 residem em um grande plasmídeo cuja perda leva à degeneração da estirpe. J. Bacteriol. 179:5442-5447.(5) Zhang H, Bruns MA, Logan BE.(5) Keis, S., Shaheen, R., and Jones, D.T. “Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii, and descriptions of Clostridium saccharoperbutylacetonicum sp. nov. and Clostridium saccharobutylicum sp. nov.” Int. J. Syst. Evol. Microbiol. (2001) 51:2095-2103.
(6) Kawasaki, S., Y. Watamura, M. Ono, T. Watanabe, K. Takeda, and Y. Niimura. 2005. Adaptive responses to oxygen stress in obligatory anaerobes Clostridium acetobutylicum and Clostridium aminovalericum. Appl. Environ. Microbiol. 71:8442-8450.
(7) Fabrice Sabathe, Anne Belaıch, Philippe Soucaille (2002) Characterization of the cellulolytic complex (cellulosome) of Clostridium acetobutylicum FEMS Microbiology Letters 217 (1), 15–22.
(8) Chen, J.S., Toth, J., and Kasap, M. (2001) Nitrogen-fixation genes and nitrogenase activity in Clostridium acetobutylicum and Clostridium beijerinckii. J Ind Microbiol Biotechnol 27: 281–286.
(9) Gutierrez, Noemi A., Maddox, Ian S. Role of Chemotaxis in Solvent Production by Clostridium acetobutylicum Appl. Environ. Microbiol. 1987 53: 1924-1927.
(10) P. Durre e C. Hollergschwandner, Iniciation of endospore formation in Clostridium acetobutylicum, Anaerobe 10 (2004), pp. 69-74.
(11) Hill, E. O. 1981. The genus Clostridium (Medical aspects), pp. 1756-1766. In: M. P. Starr et al. (disfuncao.), The Prokaryotes, Volume II. Springer-Verlag, New York.
(12) Gill, D. M. 1982. Toxinas bacterianas: uma tabela de quantidades letais. Microbiol. Rev. 46: 86-94.
(13) Gimenez, J. A. and H. Sugiyama. 1988. Comparação das toxinas de Clostridium butyricum e Clostridium botulinum tipo E. infecção e imunidade 56:926-929.
(14) Harris, L. M., R. P. Desai, N. E. Welker, and E. T. Papoutsakis. 2000. Caracterização das estirpes recombinantes do mutante da inactivação da butirato cinase de Clostridium acetobutilicum: necessidade de novos modelos Fenomenológicos para a solventogénese e inibição do butanol? Biotechnol. Bioeng. 67:1-11.
(15) McNeil, B. E B. Kristiansen. 1986. A fermentação de acetona butanol. Adv. Appl. Microbiol. 31:61-92.
(16) Nuyts S, Van Mellaert L, Theys J, Landuyt W, Lambin P, and Anne J. Clostridium spores for tumoral-specific drug delivery. quimioterapia. 2002 Fev;13(2):115-25.
(17) Nasib Qureshi, Xin-Liang Li, Stephen Hughes, Badal C. Saha, and Michael A. Cotta Butanol Production from Corn Fiber Xylan Using Clostridium acetobutylicum Biotechnol. Programa.; 2006; 22 (3) pp 673 – 680. Zhang H, Bruns MA, Logan BE. Produção biológica de hidrogénio por Clostridium acetobutylicum num reactor de fluxo insaturado. Water Res. 2006 Fev;40(4):728-34.
Editado por Mark Hower, estudante de Rachel Larsen e Kit Pogliano