Dr. Chittaranjan Das
O foco principal do nosso laboratório é compreender o papel funcional deubiquitinating enzimas (deubiquitinases ou Chama) no celular caminhos, particularmente aqueles envolvidos na neurodegeneration (perda gradual de neurônios), tais como a doença de Alzheimer (AD) e a doença de Parkinson (DP). Uma grande variedade de processos biológicos são controlados pela modificação reversível, pós-translacional de proteínas pela ligação covalente de ubiquitina, um polipéptido eucariótico de 76 resíduos altamente conservado. Ubiquitination can be thought of the starting event of a signaling cascade (ubiquitin signaling) that is eventually terminated by the hydrolytic removal of the ubiquitin tag by a DUB. Um levantamento do genoma humano revela a presença de cerca de 90 DUBs, sugerindo o seu envolvimento em uma grande variedade de vias bioquímicas. Nossa abordagem para estudar DUBs é baseada na aplicação combinada de uma série de ferramentas que incluem síntese química de pequenas sondas moleculares, cristalografia de raios X e proteômica baseada em espectrometria de massa.
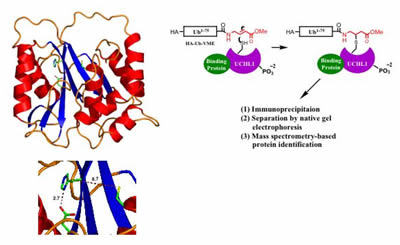
Estrutura de UCHL1 determinada por cristalografia de raios-X sugere que a enzima pode adotar dois estados, um estado inativo (em que o catalisador de resíduos estão desalinhados, mostrado à esquerda) e um suposto estado ativo, em que os resíduos são trazidos para o alinhamento pela interação da proteína com o desconhecido cofatores. A proposed method for identification of cofactors of UCHL1 via activity-based purification from whole-cell extracts (right).
Atualmente, estamos investigando a função normal do neuronal DUB hidrolase C-terminal hydrolase L1 (UCHL1)- PD-associados,neurônio-específica de proteína do desconhecido função fisiológica. Nossos esforços nesse sentido são destinados ao desenvolvimento de célula permeável à molécula pequena inibidores de UCHL1 que pode ser usado para provar a sua função (normal e a doença associada), determinando a sua ligação parceiros por afinidade com base purificação de toda a célula extratos, e definir a base molecular de como uma ocorrência natural variante desta enzima em que Ser na posição 18 é substituído por Tyr (chamado S18Y metamorfose)-fornece proteção contra a doença de Parkinson (DP). Além do UCHL1, estamos também conduzindo investigações estruturais e mecanísticas de outras enzimas relacionadas que se pensa estarem envolvidas em processos bioquímicos fundamentais, tais como reparação de DNA, modificação de histona e endocitose de proteínas da membrana plasmática.
Educação
- Ph. D., Indian Institute of Science, 2001
- bolseiro de Pós-doutoramento, Escola de Medicina de Harvard e Universidade de Brandeis, 2006
Reconhecimentos
- > Senior bolsa de Investigação, a Universidade Concede Comissão, Índia , 1996
Publicações
Lista de publicações