Fronteiras em Neurologia
- Introdução
- métodos
- indivíduos
- estudos de condução nervosa
- ultrassom
- Estatísticas
- Resultados
- Características Clínicas
- correlação entre maxCSA e a Pontuação da soma do Medical Research Council (MRC)
- correlação entre CSA e CB
- discussão
- limitações
- Declaração de disponibilidade de dados
- Declaração de Ética
- Autor Contributions
- conflito de interesses
- reconhecimentos
- material suplementar
- abreviaturas
Introdução
Multifocal motor de neuropatia (MMN) foi descrita pela primeira vez em 1988 (1) como puramente motor neuropatias afetando vários nervos motores, com a condução de bloco (CB). Motor CB é a principal marca eletrofisiológica para o diagnóstico de MMN. O ultrassom nervoso pode fornecer as características morfológicas dos nervos periféricos. O aumento multifocal dos nervos periféricos ou das raízes cervicais em áreas nervosas transversais (CSAs) foi notificado em MMN (2-4). Kerasnoudis et al. (5) relatou uma correlação entre potenciais de Acção motora composta (CMAPs) e CSAs do nervo mediano no braço superior (r = 0, 851, p < 0, 001). Beekman et al. (6) concluiu que os estudos de sonografia revelaram um aumento da CSA dos nervos compatível com anomalias da condução mais do que o esperado, por razões puramente clínicas. Além disso, alguns locais exibiram aumento de nervos sem CB. CBs multifocais foram distribuídos ao longo do nervo em MMN; no entanto, esses estudos mediram apenas alguns locais pré-determinados, fornecendo informação morfológica limitada. Neste estudo, o uso de varredura consecutiva ao longo do nervo e medição de CSA em vários locais com base em ultrassom permitiu uma correlação mais precisa entre bloco de condução e aumento de CSA em MMN.
métodos
indivíduos
entre dezembro de 2014 e maio de 2018, 12 doentes com MMN foram recrutados consecutivamente a partir do Hospital Universitário de Pequim, de acordo com os critérios propostos pela AANEM (7). Foram incluídos como controlos um mesmo número de controlos saudáveis (HC), acompanhado pela idade (±1 anos). Todos os pacientes e controles saudáveis foram submetidos a um exame clínico padronizado, incluindo testes de força muscular do pulso, polegar e dedo flexion, pollicis do adversário, pollicis brevis sequestrador, espalhamento do dedo e pollicis adductor, juntamente com testes sensoriais. Os exames clínicos, eletromiograma e ultra-som nervoso foram realizados no mesmo dia. O Comitê de Ética do Peking Union Medical College Hospital aprovou nosso protocolo de estudo, e todos os pacientes assinaram um formulário de consentimento informado de acordo com a Declaração de Helsinque.Foram realizados estudos de condução nervosa
estudos de condução nervosa
estudos de condução do nervo Motor (NCSs) em todos os indivíduos com mediana bilateral e nervos ulnar com estimulação do nervo supramaximal percutânea durante a gravação de CMAPs com eléctrodos de disco de 10 mm. Os segmentos padrão foram definidos como pulso a cotovelo e cotovelo a axila para o nervo médio, e como pulso a abaixo do cotovelo e cotovelo superior a axila para o nervo ulnar. Uma técnica de enfoque (estimulando ao longo do curso do nervo em incrementos de 2 cm) foi realizada em alguns segmentos padrão com um bloco de condução parcial, detectando o local exato de CB, juntamente com um teste de ultrassom consecutivo em todo o mesmo segmento. O diagnóstico CB dos segmentos padrão e a técnica de encravamento foram realizados de acordo com os critérios sugeridos pelo AANEM (7). Para incluir apenas bloco de condução verdadeira, CMAP distal teve que ser 1 mV. A temperatura ambiente foi mantida para assegurar que a temperatura da pele permaneceu a >31°C. Os técnicos ficaram cegos para informação do doente.
ultrassom
os testes de Ultrassonografia foram realizados através do rastreio do nervo desde o pulso até à axila na mediana bilateral e nos nervos ulnar com um transdutor linear de 10 MHz (GE LOGIQ e, EUA). A fim de eliminar o aumento artificial do tamanho do nervo, o uso de ampliação do zoom não foi permitido para estas medições. As configurações iniciais foram mantidas constantes durante todos os exames, incluindo profundidades. O transdutor foi mantido perpendicular ao nervo em um ângulo selecionado para obter a menor e mais brilhante imagem. Os CSAs nos locais pré-determinados em cada nervo foram medidos por traçamento dentro da borda hiperecóica do nervo. Dez locais pré-determinados foram medidos em cada nervo de acordo com um relatório anterior do nosso laboratório (8). Para o nervo mediano, os 10 sites incluídos na saída do túnel do carpo (M1), o ponto médio do pulso vinco (M2), a entrada do túnel do carpo (M3), de 4 cm proximal ao punho vinco (M4), o meio entre o pulso vinco e cotovelo (M5), a entrada na pronator redondo (M6), cotovelo (M7), de 4 cm acima do cotovelo (M8), 8 cm acima do cotovelo (M9), e a axila (M10). Para o nervo cubital, os 10 sites incluídos os de pulso (U1), 4 cm proximal ao punho (U2), o ponto de partida da artéria cubital (U3), juntamente com o ventre muscular do flexor ulnar do carpo (U4), a saída do túnel cubital (U5), dentro do túnel cubital (U6), a entrada do túnel cubital (U7), 4 cm proximal para a entrada do túnel cubital (U8), 8 cm proximal para a entrada do túnel cubital (U9), e a axila (U10). Com excepção dos locais acima referidos, foram igualmente efectuadas medições em quaisquer outros locais de alargamento. A ampliação da CSA foi referenciada aos valores normativos em nosso laboratório (no nervo mediano, os segmentos antebraço-cotovelo eram ≤ 10 mm2, e cotovelo-axila ≤ 9 mm2; no nervo ulnar, ambos os segmentos antebraço e braço eram ≤ 6 mm2). Após a medição da CSA, o nervo foi novamente rastreado continuamente e gravado cuidadosamente. Foram excluídas do estudo neuropatias de compressão comuns que resultaram num aumento do nervo. Os ultra-sonógrafos ficaram cegos para a informação do doente.
Estatísticas
as ZEC da MMN mostraram uma distribuição não normal. O teste de Mann-Whitney U foi usado para comparar MMN e controles saudáveis, e a diferença no CSAs máximo entre segmentos com CB e aqueles sem CB. O CSA máximo foi definido como o CSA máximo em todo o segmento padrão. Para todos os testes, um valor p de duas faces <0, 05 foi considerado estatisticamente significativo.
Resultados
Características Clínicas
Oito homens e 4 mulheres, com idade média de 43,7 anos (intervalo de 21-62, SD 13.2), 12 controles saudáveis (idade média de 43,6, gama 28-57, SD 13.3, 8 homens) foram incluídos neste estudo. A duração média da doença foi de 65 anos.3 (24-108) months. A altura média foi de 168 (155-186) cm e o peso médio foi de 65, 4 (56, 5–88) kg. Todos os doentes eram ingénuos em tratamento.Os valores de CSA para os nervos mediano e ulnar em MMN e HC nos 10 locais são apresentados na Tabela 1 e na Figura 1. Os alargamentos do CSA foram multifocais quando comparados com controlos saudáveis. Nos nervos medianos, valores mais elevados de CSA foram principalmente distribuídos no segmento do antebraço e no segmento superior do braço. Os locais abaixo do cotovelo e o segmento superior dos nervos ulnar mostraram uma ampliação mais óbvia da CSA. Curiosamente, locais comuns de compressão nervosa, como o canal carpo e túnel cubital não revelaram um aumento prevalente de CSA em pacientes com MMN comparando com controles saudáveis.

Quadro 1. CSA em diferentes locais de nervos medianos e ulnar em MMN e HC.

Figura 1. Distribuição de 10 CSA nos nervos mediano e ulnar. A linha de 10 mm2 foi criada para distinguir os locais Csa de anomalias significativas dos outros segmentos. A) para o nervo mediano: M1-a saída do carpelo turbina de canal, M2-ponto médio do pulso vinco, M3-a entrada do carpelo turbina de canal, M4-4 cm proximal ao punho vinco, M5-se o ponto do meio entre o pulso vinco e cotovelo, M6-a entrada na pronator redondo, M7-cotovelo, M8-4 cm acima do cotovelo, M9-8 cm acima do cotovelo, M10-a axila. B) para o nervo ulnar: U1-o pulso, U2-4 cm acima do pulso, U3-ponto de partida da artéria cubital, U4-juntamente com o ventre muscular do flexor ulnar do carpo, U5-saída do túnel cubital, U6-dentro do túnel cubital, U7-a entrada do túnel cubital, U8-4 cm proximal para a entrada do túnel cubital, U9-8 cm proximal para a entrada do túnel cubital, U10-axila. CSA, área transversal; MMN, neuropatia motora multifocal.
correlação entre maxCSA e a Pontuação da soma do Medical Research Council (MRC)
nos doentes com 12 MMN, no total 23 nervos medianos e 23 nervos ulnar foram incluídos porque um dos doentes com MMN foi amputado por lesão no trabalho. A tendência entre o CSA máximo do nervo de um nervo e a força muscular correspondente é dividida nos dois tipos seguintes (Figura 2): (1) aumento do CSA e diminuição do MRC. (2) a CSA aumentou e o MRC não apresentou qualquer alteração óbvia.
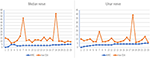
Figura 2. A correlação entre nerve maxCSA e MRC. A tendência entre a área transversal máxima do nervo (CSA) de um nervo e a força muscular correspondente. A abcissa indica 23 nervos bilaterais em 12 pacientes, um dos quais foi incapaz de registrar o nervo lateral devido à amputação; a ordenação representa a área transversal do nervo (mm2) ou a classificação da força muscular. MRC, Medical Research Council Sum Score; maxCSA, área transversal máxima de um determinado nervo.
correlação entre CSA e CB
com motor NCSs, 12 áreas CB definidas e 12 áreas CB prováveis foram detectadas em segmentos padrão de nervos medianos e ulnar. Com os estudos de ultrassom, foi detectado um aumento de CSA em 36 locais, removendo segmentos que eram suscetíveis a prensadas. No nervo mediano, a mediana (P25, P75) do CSA máximo de um segmento padrão foi 10.3 (8-12) mm2 para aqueles sem CB e 21.22 (8.5,38) mm2 para aqueles com CB (Z = 1.409, P = 0.159). No nervo ulnar, a mediana (P25, P75) do CSA máximo de um segmento nervo padrão foi de 7, 7 (5.8,7) mm2 para os sem CB e 6,25 (5,8, 25) mm2 para os com CB (Z = 0,744, P = 0,457).
havia 9 segmentos padrão com CB e aumento CSA (Figura 3, Vídeo 1), 15 segmentos com CB mas CSA normal (figura 4, Vídeo 2), e 27 segmentos com CSA aumentada mas sem CB (Figura 5, vídeo 3). A técnica de encravamento e varredura consecutiva com ultrassom foram realizadas em cinco segmentos dos quais blocos de condução quase não foram confirmados pela detecção de segmentos padrão com um bloco de condução parcial. Ao combinar técnicas de Enfiamento e ultrassom, outros dois segmentos mais mostraram CBs e aumentou CSA nos mesmos locais, e 3 segmentos mostraram CBs, mas CSA normal nos mesmos locais.
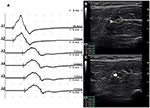
Figura 3. Modo 1. Um homem de 28 anos com 4 anos de progressiva fraqueza assimétrica das mãos bilaterais. O exame revelou músculos inervados da mão do nervo ulnar (MRC grau 3, Esquerda 4). Uma técnica de encolhimento usada no segmento do antebraço esquerdo do nervo ulnar mostrou bloqueio de condução e aumento de CSA no mesmo local em um paciente com MMN. (A) bloco de condução foi detectado entre A1 (latência 4.9 ms, duração 8.2 ms, amplitude 14.8 mv, área 38.2 mvms, velocidade de condução 66.6 m/s) e A2 (latência 5.2 ms, duração 8.2 ms, amplitude 9.5 mv, área 26.1 mvms, velocidade de condução 11.6 m/s). B) a ponta da flecha branca mostrou que o CSA de A1 era de 8 mm2. C) a seta indica que a ASC de A2 era de 19 mm2 (A1, cotovelo-6 cm; A2, cotovelo-4 cm; A3, cotovelo-2 cm) (Vídeo 1). CSA, área transversal; CB, bloco de condução; l, esquerda; r, direita.
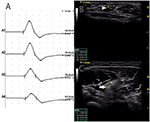
Figura 4. Modo 2. Uma mulher de 46 anos de idade com 11 anos de fraqueza assimétrica progressiva dos Membros Superiores bilaterais, com membro superior direito MRC grau 3 e esquerdo 4, mostrou bloco de condução e CSA normal no mesmo local. A) foram detectados blocos de condução entre A1 e A2. (B) O branco ponta de seta mostrou 6 mm2 em A1 (Latência 2,8 ms, a duração de 3,8 ms, a amplitude 12.4 mv, área de 13,3 mvms, condução de velocidade 50.9 m/s) e (C) A seta mostrou 8 mm2 A2 (Latência 6.8 ms, a duração de 3,9 ms, a amplitude 8.2 mv, área de 7,7 mvms, condução de velocidade de 63 m/s) (A1, pulso; A2, cotovelo) (Vídeo 2). CSA, área transversal; CB, bloco de condução; l, esquerda; r, direita.
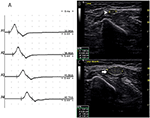
Figura 5. Modo 3. Uma mulher de 51 anos com 4 anos de fraqueza do membro superior esquerdo e MRC grau 4 mostrou aumento de CSA sem bloqueio de condução correspondente. (A) Standard segment motor nerve conduction study of the left ulnar nerve. Não foi detectado nenhum rádio. Estudo de ultra-sons nervosos no braço esquerdo do nervo ulnar mostra: (B) CSA (ponta branca da flecha) que foi de 8 mm2 no local de A3 (latência 8,7 ms, duração 8,0 ms, amplitude 8,2 mv, área 19,2 mvms, velocidade de condução 48.6 m/s) e (C) CSA (seta) do site 6 cm proximal ao cotovelo da ulna esquerda que foi 39 mm2 (latência 12,0 ms, a duração de 7,9 ms, a amplitude de 8,4 mv, área de 19,5 mvms, condução de velocidade de 18,2 m/s), mas não a CB foi detectada através de um mesmo segmento (A1, pulso; A2, abaixo do cotovelo; A3, acima do cotovelo; A4, axila) (Vídeo 3). CSA, área transversal; CB, bloco de condução; l, esquerda; r, direita.
discussão
estudos Electrofisiológicos refletem as características fisiológicas de um nervo, e estudos de ultrassom revelam as características morfológicas de um nervo. MMN é um dos modelos ideais para explorar a correlação entre CB motor e CSA, para o qual apenas o nervo motor está envolvido, e CB é a principal característica eletrofisiológica. Embora estudos anteriores tenham relatado uma correlação entre CB e CSA (5, 6, 9), locais limitados foram observados sem varredura contínua do nervo sob ultrassom, e as lesões em MMN foram distribuídas estocasticamente e nem sempre em locais pré-determinados.
neste estudo, realizamos varredura consecutiva ao longo de todo o nervo para gravar a CSA em locais anormais. Além disso, as CSAs foram medidas em 10 locais pré-determinados. A técnica de encravamento foi realizada se necessário. Embora a duração da doença neste grupo de doentes com MMN fosse longa e variada, o que pode ter afetado as características ultrassom e eletrofisiológicas, ainda encontramos três modos de relacionamento entre CSA e CB: CB com a correspondente ampliação CSA nervosa (Modo 1), CB sem a correspondente ampliação CSA nervosa (Modo 2), e alargamento CSA nervosa sem CB correspondente (Modo 3). Consequentemente, o CB nem sempre está correlacionado com o aumento do CSA.
o mecanismo potencial destes diferentes padrões de correlação entre CB e CSA ainda não é claro. Além disso, as verdadeiras manifestações patológicas correspondentes por trás do alargamento nervoso não foram claramente reveladas. O aumento hipoecóico do nervo pode reflectir inflamação activa e bolbos de cebola, enquanto o aumento do nervo com fascículos hiperecogénicos adicionais/tecido periscicular pode reflectir degeneração axonal (10). Isto é, tanto as lesões axonais como as lesões da bainha da mielina podem levar a um aumento da CSA nervosa (11). No que diz respeito ao modo 2, o CB sem a correspondente ampliação do CSA pode ser facilmente compreendido. Actualmente, o MMN é considerado uma neuropatia motora imunomediada, que está relacionada com a lesão de anticorpos anti-GM1 nos canais de na+voltados para a tensão no nó de Ranvier (12, 13). Teoricamente, os anticorpos anti-GM1 desencadeiam danos directos e dependentes do complemento aos axônios, levando a bloqueio de condução, enquanto pode não haver mudanças óbvias de mielina. Taylor et al. a hipótese de que o ataque de anticorpos poderia ser direcionado para os Componentes da mielina paranodal e descobriu que a alteração patológica axonal MMN predominou sobre a patologia mielina (14). Além disso, as nossas conclusões relacionadas com o CSA normal e o CB em MMN podem ser uma consequência do facto de apenas fascículos únicos serem alargados, enquanto o CSA do nervo principal permanece inalterado (15).
em relação ao modo 1 (CB com CSA aumentada), foi notificado aumento da CSA em MMN em estudos de imagiologia por ressonância magnética (MRI) (16) e outros estudos de ultra-sons (3). A constatação de que os pacientes com MMN tinham amplificação multifocal do nervo CSA e bloqueio de condução no mesmo local ao longo do nervo pode implicar que, no local do CB, não só havia danificados canais na+voltagem, mas também algumas lesões, tais como desmielinização, edema e formação de bolbo de cebola (6, 17). Este modo indica que CB pode ser causado por diferentes mecanismos, e MMN pode ser uma síndrome. Nem todos os casos de MMN são causados por anticorpos IgM anti-GM1, e outros processos de imunização também podem estar envolvidos, resultando em desmielinização/remielinização e processos de degeneração/regeneração axonal.
o mecanismo para o Modo 3 necessita de ser explorado. A ampliação da CSA nervosa sem CB em MMN, ou mesmo membros sem disfunção neurofisiológica, também foi encontrada em outros relatórios (6, 9, 18). Hipotetizamos que quando infiltrações inflamatórias, edema e disfunção do canal ocorrem nos nós de Ranvier no estágio inicial, o limiar de despolarização dos canais iônicos pode permanecer em um intervalo normal, de tal forma que a disfunção da transmissão de estímulo saltatório ainda não foi alcançado, e nenhum CB pode ser detectado. Em doentes com MMN, se for detectado aumento de CSA sem CB, as alterações morfológicas do nervo também devem ter significado clínico. A varredura consecutiva ao longo do nervo e medições em um maior número de locais para detectar mudanças morfológicas pode aumentar a sensibilidade diagnóstica para MMN.
em conclusão, três padrões de correlações entre CB e CSA existiram, e as mudanças eletrofisiológicas e morfológicas nem sempre foram consistentes em MMN. Os estudos de ultra-som podem detectar mais lesões ao longo do nervo em MMN, mesmo sem CB. A combinação de NCS motoras e estudos de ultra-sons poderia fornecer mais informações para o diagnóstico clínico da MMN.
limitações
este foi um único parâmetro de comparação, estudo transversal. As diferentes durações da doença dos doentes com MMN neste estudo, para além das suas diferentes alturas, pesos, podem afectar a CSA do nervo e a detecção da velocidade da condução do nervo. Além disso, apenas observamos se o CB do nervo motor foi apresentado e se houve alterações relacionadas no CSAs em um ultrassom; os mecanismos potenciais dos diferentes padrões de correlação entre CB e CSA requerem um estudo mais aprofundado. Apenas o CSA nervoso, o parâmetro mais importante, tinha sido incluído neste estudo, por isso, a fim de realizar pesquisas mais precisas, mais Índice como a intensidade do eco, deve ser envolvido.
Declaração de disponibilidade de dados
quaisquer dados não publicados no artigo estão disponíveis e serão partilhados a pedido de qualquer investigador qualificado.
Declaração de Ética
o Comité de Ética do Hospital da Faculdade de Medicina da União de Pequim aprovou o nosso protocolo de estudo, e todos os doentes assinaram um formulário de consentimento informado de acordo com a Declaração de Helsínquia.
Autor Contributions
YL: electrofisiological and ultrasonographic studies, acquisition of data, statistical analysis, and manuscript writing. JN: electrofisiological and ultrasonographic studies and statistical analysis. LC: study concept and design and manuscript editing. TL: data collection and manuscript editing. QD: estudos electrofisiológicos e ultra-sonográficos. SW and YG: electrofisiological studies. ML: conceito e design do estudo, revisão de dados, edição de manuscritos e revisão crítica.
conflito de interesses
ML recebeu apoio do Fundo Especial de capital de Pequim (Z171100001017220).
os restantes autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
reconhecimentos
reconhecemos com gratidão o financiamento do Fundo Especial de capital de Pequim (Z171100001017220).
material suplementar
o Material suplementar para este artigo pode ser encontrado em linha em:: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Video 1. Modo 1: Bloco de condução e ampliação do CSA no mesmo local em MMN.
Vídeo 2. Modo 2: Bloco de condução e CSA normal no mesmo local em MMN.
vídeo 3. Modo 3: ampliação do CSA sem bloco de condução correspondente.
abreviaturas
MMN, neuropatia motora multifocal; CB, bloco de condução do nervo motor; CSA, área transversal; NCS, estudos de condução do nervo motor.
1. Parry GJ, Clarke S. Multifocal adquiriu neuropatia desmielinizante mascarada de doença Neuron motor. Nervo Muscular. (1988) 11:103–7. doi: 10.1002 / mus.880110203
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Grimm A, Rattay TW, Winter N, Axer H. periférico nerve ultrasom scoring systems: benchmarking and comparative analysis. J Neurol. (2017) 264:243–53. doi: 10.1007 / s00415-016-8305-y
PubMed Abstract / CrossRef Full Text | Google Scholar
3. Rattay TW, Winter N, Decard BF, Dammeier NM, Hartig F, Ceanga M, et al. A ecografia nervosa como ferramenta de acompanhamento na neuropatia motora multifocal tratada. EUR J Neurol. (2017) 24:1125–34. doi: 10.1111 / ene.13344
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Loewenbruck KF, Liesenberg J, Dittrich M, Schafer J, Patzner B, Trausch B, et al. Ecografia nervosa na diferenciação da neuropatia motora multifocal (MMN) e esclerose lateral amiotrófica com doença neuronal inferior predominante (ALS/LMND). J Neurol. (2016) 263:35–44. doi: 10.1007 / s00415-015-7927-9
PubMed Abstract | CrossRef texto completo | Google Scholar
5. Neuropatia motora Multifocal: correlação entre ultrassom nervoso, eletrofisiologia e resultados clínicos. J Peripher Nerv Syst. (2014) 19:165–74. doi: 10.1111/jns5. 12067
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. A ultra-sonografia mostra extensas ampliações nervosas na neuropatia motora multifocal. Neurologia. (2005) 65:305–7. doi: 10.1212 / 01.wnl.0000169179.67764.30
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. critérios de consenso para o diagnóstico de neuropatia motora multifocal. Nervo Muscular. (2003) 27:117–21. doi: 10.1002 / mus.10317
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Niu J, Cui l, Liu M. múltiplos locais ultra-sonografia dos nervos periféricos na diferenciação de Charcot-marie-tooth tipo 1A a partir de poli-psicotropatia desmielinizante inflamatória crónica. Front Neurol. (2017) 8:181. doi: 10.3389 / fneur.2017.00181
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Pitarokoili K, Gold R, Yoon Ms. ultra-som nervoso em um caso de neuropatia motora multifocal sem bloqueio de condução. Nervo Muscular. (2015) 52:294–9. doi: 10.1002 / mus.24583
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hartig F, Ross M, Dammeier NM, Fedtke N, Heiling B, Axer H, et al. A ecografia do nervo prediz a resposta ao tratamento na poliadiculoneuropatia desmielinizante inflamatória crónica-um seguimento prospectivo. Neurotherapeutics. (2018) 15:439–51. doi: 10.1007 / s13311-018-0609-4
PubMed Abstract | CrossRef texto completo | Google Scholar
11. Tsukamoto H, Granata G, Coraci D, Paolasso I, Pádua L. ultrasom and neurofisiological correlation in common fibular nerve conduction block at fibular head. Clin Neurofisiol. (2014) 125:1491–5. doi: 10.1016 / j. clinph.2013.11.041
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Harschnitz o, Jongbloed BA, Franssen H, Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: alterações patológicas no local do bloqueio de condução. J Neuropathol Exp Neurol. (2004) 63:129–37. doi: 10.1093/jnen / 63.2.129
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Grimm A, Winter N, Rattay TW, Hartig F, Dammeier NM, Auffenberg E, et al. Um olhar dentro da morfologia nervosa dos fascículos nervosos em controles saudáveis e pacientes com polineuropatia. Clin Neurofisiol. (2017) 128:2521–6. doi: 10.1016 / j. clinph.2017.08.022
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Haakma W, Jongbloed BA, Froeling M, Goedee HS, Bos C, Leemans A, et al. A ressonância magnética mostra uma difusão mais espessa e alterada nos nervos mediano e ulnar na neuropatia motora multifocal. EUR Radiol. (2017) 27:2216–24. doi: 10.1007 / s00330-016-4575-0
PubMed Abstract | CrossRef texto completo | Google Scholar
17. Kaji R, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I, et al. Resultados patológicos no local do bloqueio de condução na neuropatia motora multifocal. Ann Neurol. (1993) 33:152–8. D. O. I.: 10.1002 / ana.410330204
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Gallardo E, Noto Y, Simon NG. Ecografia no diagnóstico de neuropatia periférica: a estrutura encontra-se funcional na clínica neuromuscular. Neurocirurgia Psiquiatria Neurol. (2015) 86:1066–74. doi: 10.1136/jnnp-2014-309599
PubMed Abstract | CrossRef Full Text | Google Scholar