Frontiers in Medicine
- Introduction
- Pacientes e Métodos
- Selecção de doentes na Vigilância, Epidemiologia e Resultados Finais de Banco de dados
- análise estatística
- resultados
- características do doente
- Melhor Risco de Fase T1 em Comparação Com Outros T Estágios no Contexto dos níveis Séricos de CEA Elevação
- efeito da elevação do CEA sérico pré – operatório na fase T
- discussão
- Declaração de disponibilidade de dados
- Declaração ética
- contribuições dos autores
- conflito de interesses
- agradecimentos
Introduction
Rectal cancer is one of the most common Malignes worldwide (1). De acordo com o sistema estadiamento do Comitê misto americano de câncer (AJCC), a extensão anatômica do tumor primário (estágio T) é um dos prognósticos mais importantes. No entanto, os doentes com o mesmo Estadio T de cancro rectal podem apresentar resultados clínicos consideravelmente diferentes.
foi relatado pela primeira vez em 1965, o antigénio carcinoembryónico (CEA) é uma glicoproteína 180-200 kDa e um membro da superfamília das imunoglobulinas (2). A CEA é secretada por uma variedade de tumores sólidos, incluindo 90% dos cancros colorectais (3). Como o biomarcador de prognóstico sérico mais importante e fiável no cancro colorectal, níveis elevados de CEA pré-operatória estão associados a pior prognóstico do cancro colorectal (4-9).Estudos anteriores demonstraram que a CEA estava associada à adesão de células cancerígenas e à imunidade inata no cancro colorectal. Além disso, a CEA também foi notificada para facilitar a ligação das células do cancro colorectal aos locais de metástase e suportar a progressão tumoral (10-12).Tradicionalmente, a propagação distante de células tumorais tem sido considerada um evento tardio, mas os resultados de vários estudos anteriores indicaram que a aquisição de potencial metastático poderia ocorrer no estágio inicial da progressão tumoral (13-16). Wo et al. (17) relatou que um tamanho muito pequeno do tumor envolvido na positividade dos gânglios linfáticos pode ser um substituto para a biologia agressiva. Então suspeitamos que o câncer rectal em estágio inicial com elevação do CEA sérico poderia sugerir a aquisição precoce do potencial metastático e prever uma sobrevivência muito pobre do câncer rectal.
no entanto, tanto quanto sabemos, poucos estudos foram relatados para investigar a Associação dos níveis séricos de CEA (C0 e C1) na determinação do prognóstico do câncer rectal. Portanto, nós realizamos este grande estudo baseado na população para examinar se estágio T muito precoce no contexto da elevação do CEA sérico pode ser um substituto para a doença biologicamente agressiva e prever para a sobrevivência pobre causa-específica (CSS) de câncer rectal. Para remover o efeito da positividade dos gânglios linfáticos na nossa investigação, excluímos os doentes positivos dos gânglios e centrámos a análise nos doentes em fase I-II.
Pacientes e Métodos
Selecção de doentes na Vigilância, Epidemiologia e Resultados Finais de Banco de dados
Como uma fonte autoritativa de informações sobre incidência de câncer e de sobrevivência, nos EUA, e uma fonte abrangente de base populacional, incluindo informações de todos os recém-diagnosticado casos de câncer que ocorrem na área de Vigilância, Epidemiologia e Resultados Finais (SEER)-territórios participantes, o VIDENTE de banco de dados abrange ~28% da população Americana. A base de dados SEER não continha quaisquer identificadores e estava publicamente disponível para os investigadores. SEER * Stat é um software fornecido pelo programa SEER para obter informações sobre pacientes usando o acesso online. No início, a sessão de Listagem de casos do SEER*Stat software (SEER*Stat 8.3.5) foi usada para listar todas as informações relacionadas ao paciente, e pacientes diagnosticados com câncer rectal estágio I-II (nodo-negativo) entre 1 de janeiro de 2004 e 31 de dezembro de 2015 foram identificados a partir da base de dados SEER (Figura 1). Os pacientes com câncer Rectal foram identificados pelos códigos C199 e C209 e código de comportamento 3 (itens 522 e 523 NAACR) (9). Optamos por incluir estes anos porque a informação de cea soro pré-operatório foi registrado a partir de 2004 e seguimento da SEER terminou em 2015.

Figura 1. Fluxograma das definições de coorte de doentes.
então, os que receberam radioterapia neoadjuvante, ausência de confirmação histológica positiva, com raça desconhecida, histologias não-adenocarcinoma, ou seguimento não activo foram excluídos do nosso estudo. Os doentes com CEA sérica pré-operatória disponíveis foram incluídos no nosso estudo, e agrupamos “positivo/elevado” e “negativo / normal”; dentro dos limites normais” como C1 e C0 (informação da fase C). Os valores-limite da CEA foram de 2, 5 ng/ml para não fumadores e de 5 ng/ml para fumadores, respectivamente. Além disso, as seguintes variáveis clinicopatológicas do paciente também foram recuperadas a partir do banco de dados SEER: estágio T, raça, sexo, localização do tumor, idade no diagnóstico, ano de diagnóstico, grau e histologia.
análise estatística
no presente estudo, o teste Qui-quadrado de Pearson foi utilizado para comparar todas as variáveis clinicopatológicas obtidas da base de dados SEER entre os níveis séricos de CEA normais e elevados pré-operatórios. Alguns modelos de risco proporcionais Cox multivariáveis foram construídos para identificar variáveis prognósticas independentes do câncer rectal em nossas análises. As curvas de sobrevivência foram geradas usando o método Kaplan–Meier, e as diferenças entre as curvas foram analisadas por teste log-rank. Os resultados primários de interesse no presente estudo foram a CSS e a sobrevivência global (OS). A CSS foi calculada desde a data do diagnóstico até a data da morte específica do câncer. As mortes atribuídas ao câncer rectal foram tratadas como eventos, e as mortes de outras causas foram tratadas como observações censuradas na data da morte. Para determinar se houve uma interação significativa entre o nível sérico de CEA pré-operatória e o estágio T na previsão de CSS, também definimos uma variável de interação (estágio T e nível sérico de CEA). P < 0, 05 de duas faces foi considerado estatisticamente significativo. Análises estatísticas foram realizadas principalmente usando a versão 22 do SPSS (IBM Corporation, Armonk, NY, EUA).
resultados
características do doente
globalmente, 19.184 doentes diagnosticados com cancro rectal de fase I–II foram identificados a partir da base de dados SEER entre 1 de janeiro de 2004 e 31 de dezembro de 2015 (Figura 1). Destes doentes, 13.007 (67, 8%) foram atribuídos ao estágio C0, e 6.177 (32, 2%) foram atribuídos ao estágio C1. O sistema de teste AJCC sugeriu que 6.077 pacientes estavam no estágio T1, 4.783 pacientes no estágio T2, 7.021 no estágio T3 e 1303 estavam no estágio T4. Um total de 2560 (13, 3%) Doentes morreram de cancro rectal no final do período de seguimento. O tempo mediano de seguimento de toda a coorte foi de 44 meses (0-143 meses). As características basais dos doentes estão resumidas na Tabela 1.
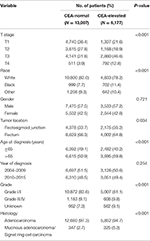
Quadro 1. Comparação das características basais do cancro rectal de fase I–II pelo nível do antigénio carcinoembryónico sérico (CEA).
Melhor Risco de Fase T1 em Comparação Com Outros T Estágios no Contexto dos níveis Séricos de CEA Elevação
verificou-se que C1 fase foi, mais provavelmente, para correlacionar com maior T palco, preto, junção retossigmóide, idade, grau superior, e cistadenocarcinoma adenocarcinoma/anel de Sinete carcinoma de células (Tabela 1, P < 0.05). Como mostrado na Tabela 2, raça, sexo, localização do tumor, idade no diagnóstico, ano de diagnóstico, grau, histologia, estágio T, e níveis séricos de CEA foram incluídos na análise multivariato Cox. Quando multivariada de Cox foi realizada análise, estamos convencidos de que o seguinte anatomoclínica características como fatores prognósticos independentes na fase I–II câncer retal; estas incluíram raça, sexo, localização do tumor, idade no momento do diagnóstico, o tumor de grau, T palco, e séricos de CEA nível, enquanto que o risco entre T2,C0 e T1,C0 foi não houve diferença estatística (P = 0.925). Foi demonstrado que, no contexto da elevação da CEA sérica, o Estadio T1 apresentou um risco inesperado mais elevado de mortalidade específica do cancro rectal em comparação com os estadios T2 e T3. Na doença de fase T1, o nível elevado de CEA sérica foi associado a um aumento de 227, 6% do risco de mortalidade em comparação com o nível normal de CEA sérica.

Quadro 2. Análise de regressão da Cox multivariada da sobrevivência específica da causa (CSS)no cancro rectal de fase I-II.As curvas de sobrevivência Kaplan–Meier são plotadas nas Figuras 2, 3 . 5-ano CSS taxa foi de 92,2% em T1C0, 75.2% em T1C1, 93.1% em T2C0, de 86,7% em T2C1, 84,6% na T3C0, de 76,3% em T3C1, de 62,9% em T4C0, e de 43,6% em T4C1 (Figura 2, P < 0.001). Por conseguinte, o T1C1 apresentou uma taxa CSS de 5 anos semelhante em comparação com o T3C1 (75, 2 vs. 76, 3%, P = 0, 388). Além disso, a conclusão foi ainda mais pronunciada no sistema operacional. De 5 anos, OS taxa foi de 78,6% em T1C0, 48,3% em T1C1, 77.1% em T2C0, 62,3% em T2C1, 68,5% T3C0, de 54,5% em T3C1, 45,3% no T4C0, e 30,0% em T4C1 (Figura 3, P < 0.001). T1C1 apresentou uma taxa de CSS significativamente inferior a 5 anos em comparação com T3C1 (48, 3 vs. 54, 5%, P < 0, 001).
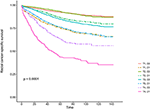
Figura 2. Curvas de sobrevivência específica da causa Kaplan–Meier (CSS) do Estadio T combinadas com o nível do antigénio carcinoembryónico sérico (CEA).
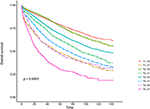
Figura 3. Curvas de sobrevivência global Kaplan–Meier (OS) do Estadio T combinadas com o nível do antigénio carcinoembryónico sérico (CEA).
efeito da elevação do CEA sérico pré – operatório na fase T
a parcela florestal foi desenhada para mostrar as razões de perigo (HRs) para comparar CSS entre os grupos CEA normais e elevados nas respectivas fases T (Figura 4). Em comparação com o nível normal dos níveis séricos de CEA, na fase T2, elevado nível sérico de CEA foi associado com 69,0% em aumento do risco de rectal-câncer de mortalidade específica ; na fase T3, elevado nível sérico de CEA foi associado com 67.2% de aumento de risco de rectal-câncer-específica de mortalidade (HR = 1.672, 95% CI = 1.486–1.882, P < 0.001); na fase T4, elevado nível sérico de CEA foi associado com 81,3% aumento do risco de rectal-câncer-específica de mortalidade (HR = 1.813, 95% CI = 1.485–2.213, P < 0.001); por outro lado, no entanto, na fase T1, elevado nível sérico de CEA apresentou até 211.6% Aumento do risco de mortalidade específica do cancro rectal (HR = 3, 116; 95% IC = 2, 639-3, 679, P < 0, 001).
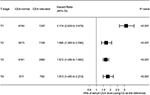
Figura 4. Razões de perigo (HRs) da sobrevivência específica da causa (CSS) entre o nível normal e elevado do antigénio carcinoembryónico sérico (CEA) de acordo com o Estadio T.
discussão
procurámos investigar a Associação dos níveis de T e de CEA sérica na determinação da CSS do cancro rectal. Nós hipotetizamos que o câncer rectal com estágio T muito precoce (estágio T1) e elevação do CEA sérico pode ser um substituto biológico para a doença agressiva, prevendo assim um fraco resultado oncológico. Com cerca de 20.000 pacientes diagnosticados com câncer rectal estágio I–II incluído em nosso estudo.
neste estudo, verificou-se que a elevação do CEA sérico era mais provável de se correlacionar com o Estadio T mais elevado, negro, junção de retosigmóides, idade mais avançada, e adenocarcinoma de grau e mucinous/carcinoma de células do anel Sinete. As análises de sobrevivência Kaplan–Meier mostraram que, no contexto da elevação sérica da CEA, a taxa de CSS de 5 anos no Estadio T1 foi de 75, 2%, o que não alcançou diferença estatística do Estadio T3 (76, 3%). Quando se trata de sobrevivência global, a taxa OS de 5 anos no Estadio T1 com elevação sérica pré-operatória (48, 3%) Foi ainda mais baixa do que o Estadio T3 envolvido na elevação da CEA (54, 5%) e não alcançou diferença estatística a partir do Estadio T4 (45.3%), o que significa que o nível sérico pré-operatório elevado da CEA poderia identificar um subgrupo de cancros rectais de fase T1 com CSS semelhante em comparação com algumas doenças T3 e com OS semelhantes em comparação com algumas doenças T4 de fase.
após ajustamento para os factores de prognóstico conhecidos do cancro rectal (raça, sexo, localização do tumor, idade no diagnóstico, ano de diagnóstico, grau e histologia), a variável de interacção (Estadio T e nível sérico de CEA) que definimos demonstrou ser um factor de prognóstico independente do cancro rectal. A análise da Cox multivariato demonstrou que, no contexto da elevação da CEA sérica, o Estadio T1 apresentou um risco inesperado superior de mortalidade específica do cancro rectal em comparação com os estadios T2 e T3. Na doença de fase T1, o nível elevado de CEA sérica foi associado a um aumento de 227, 6% do risco de mortalidade em comparação com o nível normal de CEA sérica. Além disso, raça, sexo, localização do tumor, idade no diagnóstico, e grau do tumor também foram identificados como fatores prognósticos independentes do câncer rectal estágio I–II. Para além do T1, verificou-se que a elevação da CEA sérica pré-operatória apresentou ~75% de riscos mais elevados de mortalidade específica do cancro rectal no respectivo Estadio T, mas o número aumentou significativamente para 211,6% no Estadio T1.
em 2000, o grupo de trabalho Colorectal do CCAH propôs a inclusão do nível sérico de CEA (Fase C) no sistema convencional de estadiamento do CCAH do cancro colorectal (18). Além disso, a American Society of Clinical Oncology e o European Group on tumoral Markers têm apoiado a inclusão do nível de CEA sérico pré-operatório como uma ferramenta prognóstica no câncer colorectal (19-21).
várias pesquisas anteriores relataram o nível sérico de CEA como um forte papel prognóstico no câncer de cólon (4-7, 22-26). Em 2011, Thirunavukarasu et al. (25) relatou que o nível sérico de CEA pré-operatória era um biomarcador de prognóstico independente do cancro do cólon, e o prognóstico foi pior em doentes com CEA elevada com um Estadio mais baixo em comparação com doentes com CEA baixa com um Estadio mais elevado. Nesse estudo, o CEA elevado foi até considerado tão forte quanto a positividade dos nódulos para prever resultados oncológicos pobres do câncer de cólon.
no entanto, poucos estudos se concentram em elucidar o papel prognóstico do nível sérico de CEA no cancro rectal. Em 2016, também usando a base de dados SEER, Tarantino et al. (9, 27) realizaram as duas grandes investigações baseadas na população, que forneceram provas convincentes de que o nível elevado de CEA sérica pré-operatória era um forte preditor da pior sobrevivência global e específica do cancro no cancro rectal. Em 2018, Liu et al. (8) demonstraram que o pré-operatório séricos de CEA foi um fator prognóstico independente de câncer de reto, e séricas de CEA nível apresentado evidentemente mais pobres de sobrevivência em comparação com níveis séricos normais de CEA nível em fases I–IV. No entanto, apenas dois estudos anteriores focado em investigar o papel prognóstico do pré séricos de CEA nível de não examinar a associação de CEA nível e T estágio na previsão do tumor resultados de câncer retal.
Embora o convencional mostra que o câncer adquire o potencial metastático, passo a passo, como eles crescem a um tamanho grande (28), no entanto, alguns estudos anteriores indicaram que a aquisição do potencial metastático pode ocorrer muito cedo na progressão tumoral. Uma pesquisa anterior demonstrou a sobrevivência extremamente pobre de tamanho tumoral muito pequeno quando envolvido na positividade dos gânglios linfáticos (17). Além disso, os resultados de nossa pesquisa mostram que a elevação do nível de CEA sérico pré-operatório em estágio muito precoce (estágio T1) câncer retal está associada com OS e CSS muito pobres e pode ser um substituto da biologia agressiva. Acreditamos que o envolvimento dos gânglios linfáticos e a elevação do CEA sérico são considerados como a aquisição de capacidade metastática. O nosso estudo, combinado com o de Wo et al. consistentemente sustentam a idéia acima mencionada de que a aquisição do potencial metastático pode ocorrer muito cedo na progressão tumoral, assim associada a resultados oncológicos pobres, e a característica biológica inicial são mais propensos a determinar o potencial de metástases distantes durante a progressão do câncer, em vez da capacidade metastática acumulada (29).Além disso, os resultados do nosso estudo são de significado clínico. Atualmente, o câncer rectal estágio I é tratado apenas com ressecção cirúrgica radical por causa de resultados oncológicos relativamente favoráveis. No entanto, aproximadamente 10-15% dos pacientes irão desenvolver recorrência tumoral após ressecção radical (30, 31). No presente estudo, acontece que identificamos um subgrupo de câncer rectal estágio T1 com prognóstico muito fraco em comparação com o resto do câncer rectal estágio I, O que significa que aqueles estágio T1 câncer rectal com envolvimento de elevação do CEA sérico pré-operatório deve chamar mais atenção dos oncologistas.No entanto, existem duas limitações no nosso estudo. Por um lado, este estudo não incluiu alguns fatores prognósticos conhecidos de câncer rectal em nossas análises, incluindo estado de instabilidade microssatelite e complicações pós-operatórias, que não estavam disponíveis a partir da base de dados SEER e podem introduzir vieses em certa medida. Não podemos fornecer gamas e valores médios da CEA em ambos os grupos. Por outro lado, o presente estudo foi retrospectivo e não baseado em dados prospectivos. Portanto, nossos achados ainda precisam ser validados em outras coortes, especialmente em grandes estudos clínicos prospectivos.
em conclusão, o nosso estudo demonstra que o cancro rectal em Estadio T1, quando envolvido na elevação do CEA sérico pré-operatório, pode ser um substituto da doença biologicamente agressiva e correlacionado com OS desfavoráveis e CSS. Além disso, este subgrupo de cancro rectal merece mais atenção clínica por parte dos oncologistas. As nossas descobertas, se validadas em futuros estudos de bases de dados, forneceriam uma nova ideia terapêutica para o cancro rectal em fase precoce.
Declaração de disponibilidade de dados
os conjuntos de dados gerados para este estudo estão disponíveis A pedido do autor correspondente.
Declaração ética
pacientes neste estudo foram identificados a partir da base de dados SEER, e a aprovação para uso dos dados foi obtida através de um pedido submetido ao programa SEER. A aprovação pelo Conselho de revisão institucional não foi necessária porque a base de dados SEER está disponível publicamente.
contribuições dos autores
SW e WG deram uma contribuição substancial e direta para este estudo, e o aprovaram para submissão.
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
este trabalho foi apoiado em parte pelo Projecto do plano de Ciência Médica e Desenvolvimento Tecnológico de Yancheng (YK2015075).
1. Bray F, Fernay J, Soerjomataram i, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstract / CrossRef Full Text | Google Scholar
2. Gold P, Freedman SO. Demonstração de antigénios específicos do tumor no carcinoma do cólon humano através de tolerância imunológica e técnicas de absorção. J Val. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Goldstein MJ, Mitchell EP. Antigénio carcinoembryónico no estadiamento e acompanhamento de doentes com cancro colorectal. Investimento No Cancro. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Becerra AZ, Probst CP, TEJANI MA, Aquina CT, González MG, Hensley BJ, et al. Avaliação do papel prognóstico de níveis elevados de antigénio carcinoembryónico pré-operatório em doentes com cancro do cólon: resultados da base de dados nacional sobre o cancro. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245/s10434-015-5014-1
PubMed Abstract | CrossRef texto completo | Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. O nível elevado de antigénio carcinoembriónico do soro pré-operatório pode ser um indicador eficaz para a necessidade de quimioterapia adjuvante após ressecção potencialmente curativa do cancro do cólon de fase II. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstract / CrossRef Full Text | Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identificação de doentes com cancro do cólon em Estadio II de alto risco para terapêutica adjuvante. Dis Colon Recto. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-Z
PubMed Abstract / CrossRef Full Text | Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. A incorporação de CEA melhora a estratificação do risco no câncer de cólon estágio II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstract | CrossRef texto completo | Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinação do antigénio carcinoembryónico com o sistema de ensaio do Comité Misto americano de TNM cancerígeno no cancro rectal: um estudo baseado no mundo real e na grande população. O Onco Ataca Ali. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Tarantino i, Warschkow R, Schmied BM, Güller U, Mieth m, Cerny T, et al. Valor preditivo da CEA para a sobrevivência na fase I do cancro rectal: uma análise emparelhada da propensão baseada na população. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogene. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstract / CrossRef Full Text | Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Acessando novo significado prognóstico do antigénio carcinoembriônico pré-operatório no câncer colorectal que recebe ressecção tumoral: mais do que positivo e negativo. Cancro Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstract / CrossRef Full Text | Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. O processo de metástase para o cancro da mama. Cancro Da Europa. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstract | CrossRef texto completo | Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. A propagação sistémica é um passo precoce no cancro da mama. canceroso. (2008) 13:58–68. D. O. I.: 10.1016 / j. ccr.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Semeadura e propagação de células mamárias do rato não transformadas no pulmão. Ciência. (2008) 321:1841–4. doi: 10.1126 / science.1161621
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis a, Granzow M, Ahr a, Blankenstein TJ, et al. De células disseminadas latentes a metástases overt: análise genética da progressão sistémica do cancro da mama. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Efeito do tamanho muito pequeno do tumor na mortalidade específica do cancro no nódulo positivo do cancro da mama. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. peito.2012. 01. 026
Texto Integral / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostic factors consensus conference: colorectal working group. Cancer. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::AUXÍLIO-CNCR30>3.0.CO;2-T
PubMed Abstract / CrossRef Full Text | Google Scholar
19. Duffy MJ, van Dalen a, Haglund C, Hansson L, Holinski-Feder e, Klapdor R, et al. Marcadores tumorais no cancro colorectal: directrizes para a utilização clínica do Grupo Europeu dos marcadores tumorais (EGTM). Cancro Da Europa. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 update of recommendations for the use of tumoral markers in gastrintestinal cancer. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini a, Kalousová M, Holubec L, et al. Marcadores tumorais em câncer colorretal, câncer gástrico e câncer de estromal gastrointestinal: European group on tumor markers 2014 guidelines update. Int J. Cancer. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstract / CrossRef Full Text | Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. O antigénio carcinoembryónico pré-operatório prevê resultados em doentes com cancro do cólon nodo-negativo: uma análise multivariada de 572 doentes. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstract | CrossRef texto completo | Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Antigénio carcinoembryónico pré-operatório como um factor prognóstico independente no cancro potencialmente curativo do cólon. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstract / CrossRef Full Text | Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata a, Nakagawa Y, Fujita S, et al. Incorporação dos níveis séricos de antigénio carcinoembryónico no sistema de agrupamento prognóstico do cancro do cólon. Int J Colorect Diss. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstract | CrossRef texto completo | Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-stage in colon cancer: implications of carcinoembryonic antigen biomarker in staging, prognosis, and management. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093/jnci / djr078
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Margalit o, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Avaliar o valor prognóstico dos níveis de antigénio carcinoembryónico nos estádios I e II do cancro do cólon. Cancro Da Europa. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
PubMed Abstract / CrossRef Full Text | Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. CEA pré-operatória elevada está associada a uma maior sobrevivência em doentes com cancro rectal de fase I-III. Cancro Br J. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstract / CrossRef Full Text | Google Scholar
28. Norton l, Massague J. O cancro é uma doença de auto-semeadura? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Efeito do Grande Tamanho do tumor na mortalidade específica do cancro no nódulo negativo do cancro da mama. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j. mayocp.2012.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Cancro rectal de fase I: identificação de doentes de alto risco. J Am Coll Surg. (1998) 186: 574-9; discussão: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstract | CrossRef texto completo | Google Scholar
31. Gunderson II, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic M, et al. Impacto dos estadios T E N e do tratamento na sobrevivência e recidiva do cancro rectal adjuvante: uma análise conjunta. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstract | CrossRef Full Text | Google Scholar