o envolvimento do antigénio cognato nas células parenquimais estimula a proliferação de células T CD8+ in situ
- as células CD8+ T cognato são encontradas no LN e no tecido inflamado
- as células T CD8+ expandem-se no local da inflamação
- a interacção cognata com Ilhéus promove a expansão
- a interacção cognata com as células parenquimais é importante
- as células T proliferam no local da inflamação
- Cognato em interação com células parenquimatosas de unidades de proliferação
- a IL-2 é mais importante, no local da inflamação
as células CD8+ T cognato são encontradas no LN e no tecido inflamado
em experiências iniciais(Fig. 1) estabelecemos um modelo no qual podem ser analisadas as respostas das células T CD8 a um antigénio parenquimal, ovalbumina (OVA). Ot-i mice express a transgenic TCR that mediates CD8+ T-cell recognition of OVA257-264 peptide presented on the MHC class I molecule H-2kb. As células T CD8 foram enriquecidas a partir de ratos OT-i/CD45.1, ratos marcados com corante CFSE e transferidos adotivamente por I. V. para ratos hospedeiros B6 (CD45.2+). As células T transferidas adotivamente podem ser distinguidas das células hospedeiras por coloração CD45. 1 (bem como CD8 e a cadeia Va2 do TCR OT-i) enquanto a diluição do corante CFSE foi usada para identificar células que proliferaram (por exemplo, Fig. 1a, Supplementary Fig. 1). O antígeno parênquimal foi introduzido por enxertia B6.ilhéus ßOVA (tais Ilhéus exprimem óvulos em células β parenquimáticas sob o promotor de insulina no rato, quadro suplementar 1) por baixo da cápsula renal de ratinhos hospedeiros que já tinham recebido células OT-i/CD45.1 T. Todas as três fontes (hospedeiro, doador de células T e doador de Ilhéus) têm um fundo B6 e, portanto, expressam H-2Kb. Assim, embora a expressão do antigénio do OVA se limitasse a células β enxertadas, assumimos que a apresentação de óvulos derivados de células β Por APC não parênquima,tal como DC via apresentação cruzada, seria necessária para a primagem e, talvez, para as respostas locais às células T17, 18.

células OT-i divididas (CD45.1+CD8+Va2+ porta) na drenagem de LN e enxerto renal 3 ou 6 dias após a recepção de um único enxerto de 400 B6.ilhotas ßOVA. a) parcelas de citometria de fluxo representativas. A posição do Pico ot-i não dividido foi determinada utilizando o controlo “sem antigénio” de um enxerto de ilhéu B6. b) número Total de OT-i dividido em LN renal e enxerto, em que cada ponto representa um rato individual. Dados agrupados de sete experiências independentes: n = 8 receptores do enxerto no dia 3 e n = 14 receptores do enxerto no dia 6. Um dia, o enxerto 6 foi perdido devido a um mau funcionamento do citómetro. As barras horizontais são médias, os valores de P foram calculados por ensaio T sem emparelhamento, de duas caudas, com correcção de Welch.
as células T CD8+ expandem-se no local da inflamação
como esperado, foi detectada uma potente resposta OT-I primeiro na LN renal que drena o local do enxerto e esta foi dependente da presença do antigénio OVA (Fig. 1a, b). Aos 3 dias pós-enxerto, OT-I dividido podia ser detectado em LNs drenando o B6.enxertos de ilhéus de ßOVA (Fig. 1a) E eram abundantes (Fig. 1b, média = 9.2 × 104). Em contraste, 100 vezes menos células ot-I divididas poderiam ser detectadas dentro do B6.enxertos de ßOVA (Fig. 1a, b, mean=6.6 × 102). O número de células OT-I divididas aumentou 300 vezes no local do enxerto desde o dia 3 até ao dia 6 (Fig. 1b, média = 6.6 × 102 no dia 3 a 2.1 × 105 no dia 6, P<0.0001, teste T de duas caudas não emparelhado com correcção de Welch) enquanto que não houve aumento no LN(Fig. 1b). A resposta OT – i em B6.enxertos de ßOVA podem ser explicados pela infiltração de células OT-I que proliferaram no LN. No entanto, os perfis CFSE eram diferentes entre o enxerto e os locais LN, dado que as células OT-i em enxertos estavam mais divididas do que as do LN no dia 6 (Fig. 1a). Há pelo menos duas explicações possíveis para esta diferença. Apenas células que se tinham dividido muitas vezes se infiltraram no enxerto. Alternativamente, as células que atingem o enxerto dividem-se mais rapidamente, possivelmente devido à abundância do antigénio disponível. O aumento do número absoluto de células no enxerto comparado com LN no dia 6 levou-nos a investigar esta última explicação.
a interacção cognata com Ilhéus promove a expansão
para determinar a possível contribuição do cognato MHC no enxerto para a expansão local que usamos ilhotas derivadas da bm1.ratos ßOVA (quadro suplementar 1). Na bm1.ratos ßOVA, a molécula H-2Kbm1 é incapaz de apresentar o peptídeo OVA257–264 devido a três mutações a H-2Kb (ref. 19). A comparison of responses to B6.ßOVA e bm1.os enxertos de ilhéus de ßOVA mostraram que, apesar de respostas OT-I semelhantes no LN renal drenante, a expansão do LT-I foi reduzida seis vezes na bm1.ßOVA em comparação com B6.enxertos de ßOVA (média = 4.7 × 104 em comparação com 2.6 × 105 ot-I dividido; P=0.0153 ensaio T de duas caudas não emparelhado com correcção de Welch; Fig. 2a). Esta expansão menos eficiente de células OT-I infiltrando-se na bm1.enxertos de ßOVA sugeriram que as interacções cognatas com células de Ilhéus enxertados contribuíram para a expansão local das células T.

análise da citometria de fluxo das células OT-I (CD45.1+CD8+Va2+ porta) 6 dias após enxerto. a) a divisão total do OT-i no LN e no enxerto renal drenante após recepção de um único enxerto de 400 B6.ßOVA ou bm1.ilhotas ßOVA. Dados do B6.os ratos enxertados de ßOVA são um subconjunto do apresentado na Fig. 1b. cada ponto representa um rato individual. Os dados agrupados de duas experiências independentes são apresentados em cada painel: n = 5 receptores de B6.enxertos de ßOVA e n = 6 receptores de bm1.enxertos de ßOVA. As barras horizontais são médias, os valores de P foram calculados por ensaio T sem emparelhamento, de duas caudas, com correcção de Welch. b) esquema do modelo do enxerto bipolar em que os enxertos de 200 Ilhéus são colocados em pólos opostos do mesmo rim e partilham um LN renal drenante comum. Total dividido OT-I Em c) B6.ßOVA e KbKO.Enxertos bipolares ßOVA e B6.os enxertos bipolares ßOVA e B6 (n = 5 ratos receptores agrupados a partir de dois ensaios independentes em cada um dos dados c E d) para o mesmo rato são ligados por linhas tracejadas: os valores de P foram calculados pelo rácio emparelhado em t-test.
para eliminar qualquer contribuição por H-2Kbm1 aloantigen nós geramos KbKO.ßOVA ratinhos que exprimem o antigénio OVA nas células beta ilhotas, mas que carecem de aloantigeno ou H-2Kb (tabela Complementar 1). Utilizámos então um “modelo bipolar de enxerto” para comparar as respostas ao B6.ßOVA e KbKO.enxertos de Ilhéus ßOVA colocados em pólos opostos do mesmo rim num rato hospedeiro B6, de modo a que as células T infiltradas pelo enxerto fossem derivadas de células T preparadas no mesmo LN (Fig. 2b). Havia 10-100 vezes mais células T presentes em B6.ßOVA que KbKO.enxertos de ßOVA (Fig. 2c). Usando a relação de ot-i dividido em pólos opostos do rim calculada para ratos individuais, nós derivamos uma relação de resposta relativa (RRR). A RRR indicou que a expansão local das células T foi 26 vezes maior quando ocorreu o envolvimento cognato com as células do enxerto (RRR=26, 4±14, 1 em B6.kbko.enxertos de ßOVA, P=0, 0025, rácio emparelhado t-test, Fig. 2c).
também comparámos as respostas ao B6 bipolar.Enxertos ßOVA e B6( sem antigénio) (Fig. 2d). Muito poucos ot-i poderiam ser detectados dentro de enxertos B6 (Fig. 2d) e consideramos provável que muitos destes estavam circulando OT-I derivado da contaminação sanguínea. Assim, a inflamação não específica associada com a transplantação de enxertos que carecem de antigénio não leva a uma expansão eficiente das células T dentro do tecido inflamado. Pelo contrário, a resposta ao B6.os enxertos de ßOVA foram novamente muito potentes e mais de 900 vezes superiores aos dos enxertos de B6 (RRR=950±252 para B6.ßOVA: enxertos de B6, P < 0, 0001, rácio emparelhado t-test, Fig. 2d).Estas experiências indicaram que a expansão das células T CD8 no tecido alvo inflamado foi significativamente promovida pela apresentação local do antigénio. Isto não exclui necessariamente outras contribuições para a expansão da Célula-T, por exemplo, apresentando a DC Hospedeira no enxerto. Só sabemos que a interacção cognata entre as células T e as células de ilhéu resulta numa expansão substancial das células T.As ilhotas são grupos complexos de células que incluem células β, células endoteliais e leucócitos residentes dos Ilhéus (IRL). Portanto, em seguida, procurámos esclarecer quais as células de ilhéu que apresentaram antigénio para infiltrar as células T para conduzir a expansão das células T. O candidato mais óbvio seria IRL. Estas células CD45+ têm sido definidas como DC ou macrófagos, Co-express CD11c e F4 / 80,e tem sido mostrado para processar e apresentar antigénios 20,21,22, 23. Examinámos, portanto, o papel do dador IRL na condução da expansão local das células T CD8. B6.ratos ßOVA foram cruzados para CD11c. DTR.GFP mice in order to obtain CD11c. DTR.GFP.beta ratos cujas células β exprimem óvulos e cujas células CD11c+ podem ser abatidas por injecção de toxina difteria (DT) 8. Nós testamos pela primeira vez por FACS que Ilhéus isolados de CD11c. DTR.Os ratos GFP tratados com DT apresentavam depleção de células CD11c+ (Fig. 3a, b). CD11c+ IRL em ratos de controlo não tratados foram identificados através de coloração para CD45 e CD11c, bem como a sua expressão do relatório GFP e foram claramente esgotados pelo tratamento DT (Fig. 3a, b, P=0, 0002, teste T de duas caudas não emparelhado com correcção de Welch). Também confirmámos que o CD11c+IRL Co-expressava F4/80 E H-2 Kb MHC classe I (suplementar Fig. 2-A) e, consequentemente, as células F4/80+ também se esgotaram das ilhotas de ratinhos tratados com DT (Figo suplementar. 2b). CD11c.DTR.GFP.as ilhotas ßOVA isoladas de ratinhos não tratados e tratados com DT foram enxertadas em pólos opostos do mesmo rim. O número de OT-I dividido foi semelhante entre os enxertos, indicando que a depleção IRL não teve efeito na expansão das células T CD8+ no local do enxerto(Fig. 3c). Para confirmar que a IRL não era importante para a expansão local de células T CD8, realizamos um segundo conjunto de experimentos. KbKO.os ratos ßOVA foram irradiados e reconstituídos com kbko ou B6 medula óssea( BM) para gerar uma fonte de ilhotas ßOVA em que a expressão H-2Kb estava ausente de todas as células ou foi restaurada selectivamente para IRL (Fig. 3d). A comparação destas ilhotas no modelo do enxerto bipolar mostrou níveis semelhantes de expansão das células OT-I em ambos os enxertos (Fig. 3e). Assim, a IRL não são os principais motores da expansão local de células T CD8.

análise da citometria de fluxo mostrando depleção de CD11c+ IRL em CD11c. DTR.GFP ratinhos tratados com DT: a) parcelas representativas que mostrem a distribuição de CD11c+IRL em Ilhéus de controlo não tratados e a sua depleção no dia seguinte a um único tratamento com DT, e b) Contagem de CD11c+IRL em ratinhos não tratados e tratados com DT. Cada ponto representa uma preparação individual de Ilhéus contendo Ilhéus agrupados de 1 a 8 ratinhos, n = 5 preparações de Ilhéus não tratados e 6 preparações de Ilhéus tratados com DT agrupadas a partir de quatro experiências independentes. Valor de P calculado por ensaio T de duas caudas não emparelhado com correcção de Welch. c) total dividido em OT-i aos 6 dias após enxerto bipolar de ilhotas obtidas a partir de CD11c.DTR.GFP.ßOVA ratinhos que não foram tratados ou tratados com DT (n=6 ratinhos receptores combinados com duas experiências independentes). Os dados do mesmo rato são ligados por linhas tracejadas; os valores de P são calculados por relação emparelhada de ensaio em T. d) parcelas representativas que mostrem a ausência ou a presença de expressão H-2Kb em CD11c+IRL de ratos KbKO reconstituídos com KbKO ou B6 BM, respectivamente. Implantado em células viáveis. e) um enxerto de Ilhéus bipolar dividido ao fim de 6 dias após o enxerto bipolar obtido de ratinhos chimaéricos (n=3 ratinhos receptores de uma única experiência). Os dados do mesmo rato estão ligados por linhas tracejadas; Valores de P calculados por rácio emparelhado em t-test.
a interacção cognata com as células parenquimais é importante
B6.Ratinhos RIP-Kb expressam transgenicamente H-2Kb em células β sob o controlo do promotor de insulina de rato 24. Cruzando estes ratos para KbKO.ratos ßOVA nós geramos KbKO.ßOVA.ratos ßKb em que a expressão H-2Kb se limitava às células β (tabela Complementar 1). A expressão de H-2Kb em células β foi confirmada pela análise FACS de Ilhéus(Fig. 4a). Nós acasalamos em células hematopoiéticas de ilhéu (CD45+) e células endoteliais (CD31+) e mostramos que o H-2kb não foi expresso nestas células em qualquer um dos KbKO.ßOVA ou KbKO.ßOVA.ratos ßKb em comparação com a expressão forte em ratos B6 (Fig. 4a). As células CD45−CD31 restantes são autofluorescentes positivas e enriquecidas em células endócrinas. Análise FACS de ilhotas de KbKO.ßOVA.ratos ßKb mostraram expressão H-2Kb dentro da população autofluorescente enriquecida com células β em níveis semelhantes aos observados em ilhotas B6 (Fig. 4a). A comparação no modelo do enxerto bipolar indicou que a expansão do OT-i foi 14 vezes maior quando o antigénio cognato foi expresso em células β (RRR=14, 0±4, 1 para o KbKO.ßOVA.kbko.enxertos de ßOVA, P=0, 0008, rácio emparelhado t-test, Fig. 4b).

(a) parcelas de citometria de fluxo (fixadas em células viáveis) que demonstrem a restauração selectiva da expressão H-2Kb nas células parênquimas. Histogramas representam ilhotas de KbKO (sombreado), B6 (Track) ou KbKO.ratos ßKb (negrito). b) total dividido OT-i aos 6 dias após enxerto bipolar de KbKO.ßOVA e KbKO. ßOVA.bkb. Ilhéus (n = 6 ratinhos receptores combinados com três experiências independentes). Os dados do mesmo rato são ligados por linhas tracejadas; os valores de P são calculados por relação emparelhada de ensaio em T.
as células T proliferam no local da inflamação
os resultados acima indicados indicam que houve proliferação local no local alvo. Para detectar células em proliferação activa, cruzámos o rato OT-i /CD45.1 para o rato FucciRG para gerar o rato FucciRG/OT-i/CD45.1 mice (abreviado FucciOT-I). Nesses ratinhos, as células fluorescem vermelho (FucciR) durante G0/G1 e verde (FucciG) durante o ciclo celular s/G2/M fases25,26. A degradação gradual e acumulação de FucciR e FucciG repórteres durante a transição entre as fases do ciclo permite que outras distinções a serem feitas: mais intensa FucciR expressão em quiescente G0 versus bicicleta G1 células, duplo negativo FucciR−G− células muito cedo G1, e fracamente duplo positivo FucciR+G+ células em G1/S refs (26, 27). Células fucciot-I Quiescentes de ratos não enxertados eram FucciG – (Fig. 5a, Painel superior, não enxertado). Para evitar interferências com os corantes Fucci, substituímos a CFSE pela CTV. Em ratos que receberam B6.enxertos de ßOVA, a análise da diluição CTV indicou que FucciOT-I dividido estava presente no LN renal drenante e alguns deles eram Fucig+ sugestivos de divisão celular activa(Fig. 5a, Painel superior, drenando LN). No local do enxerto, detectamos FucciOT-I que havia sofrido muitas divisões (CTV não mais detectável) e muitas delas eram Fucig+ apoiando a proliferação contínua (Fig. 5a, Painel superior, enxerto fresco). Comparação da proporção de células Fucig+ na população ot-I dividida (Fig. 5c) indicou que a contínua proliferação dentro de enxertos frescos (de 26,8±8.8% FucciG+), excedeu-se que em ambos os drenagem renal LN (7.3±1.6%, P=0,008, não pareado bicaudal, teste t com correção de Welch) ou não-drenagem renal LN (2.1±2.1%, P=0,003, não pareado bicaudal, teste t com correção de Welch). Na verdade, o exame da expressão FucciG e FucciR indicou que a maioria das infiltrações de enxerto OT-I estavam se dividindo ativamente, ou seja, muito poucas células exibiam alta expressão de FucciR que era uma característica das células Quiescentes no LN de ratos não enxertados (Fig. 5a, painéis inferiores). Embora tenhamos imaginado que esta proliferação no local da inflamação foi gerada in situ, não poderíamos descartar completamente a possibilidade de que isso simplesmente refletia a chegada recente de células em proliferação. Para esclarecer isto, colhemos os enxertos bipolares de B6.ilhéus ßOVA para analisar um enxerto imediatamente após a excisão e cultura do outro enxerto durante um dia (Fig. 5a). Enquanto o número de OT-I não aumentou durante o período de cultura (Fig. 5. B), presumivelmente reflectindo a morte celular em condições subóptimas ex-vivo, muitas células Fucig+ OT-I continuaram a ser detectadas(14, 2±4, 2% Fucig+, Fig. 5c). O perfil do enxerto cultivado, sem possível recrutamento por um dia, indicaria que havia alta proliferação de novo no enxerto.

(a) Esquemático e representante da citometria de fluxo parcelas (gated viáveis CD45.1+CD8+Va2+ linfócitos) mostrar resposta FucciOT-eu células renais LNs ou bipolar B6.enxertos de ßOVA. O LNs e o enxerto de um pólo foram examinados imediatamente (frescos 6 dias após o enxerto), enquanto o enxerto do pólo oposto foi cultivado durante 1 dia antes da análise. O LN de um rato não enxertado foi incluído para mostrar ausência de divisão e expressão de Fucig (Painel superior) e predominância de células elevadas de FucciR (Painel inferior) em fucciot-I. b) FucciOT-i dividido Total em enxertos frescos e cultivados. Média+s. d., n=5, valores P calculados por uma razão de duas caudas emparelhada em t-test. c) % De Fucig+ FDA-I em enxertos renais frescos não drenantes e Enxertos drenantes, bem como em enxertos frescos e cultivados. Média+s. d., n = 5, com excepção do LN não drenante, para o qual n=4 devido à perda de um LN durante o processamento. Os valores de P foram calculados por um ensaio T não emparelhado de duas caudas com a correcção de Welch. Os dados são agrupados a partir de duas experiências independentes.
Cognato em interação com células parenquimatosas de unidades de proliferação
próxima aproveitou a FucciOT-eu modelo para avaliar o papel do outro potencial local do driver de T-proliferação de células no enxerto, host-derivada da APC, tais como inflamatório DC. A fim de eliminar qualquer contribuição da APC host nós primeiro derivamos um fundo KbKO. Como ratos kbko rejeitaram células OT-I, nós criamos KbKO BM Em B6 chimaeras para usar como hospedeiros; assim, as células hematopoiéticas careciam de H-2Kb, mas eram permissivas das células OT-I. Estas chimaeras receberam células T FucciOT-I e Enxertos bipolares de KbKO.ilhéus ßOVA (sem expressão H-2Kb e, por conseguinte, com capacidade para apresentar o antigénio OVA) e KbKO.ßOVA.ilhéus ßKb (tanto o antigénio H-2Kb como o antigénio dos óvulos eram limitados às células β). Uma vez que a chimaera não tinha uma APC positiva para H-2Kb, foi necessário administrar células revestidas com peptídeo de OVA257-264 para iniciar a resposta OT-I. O sucesso deste priming foi mostrado pela CTV-diluição em FucciOT-eu células renais LN, embora no momento da colheita, estas foram FucciG− e não parece ser ativamente de divisão (0.1±0.0% FucciG+, Fig. 6a, d). Poucos OT-i infiltraram-se na KbKO.enxertos de ßOVA, mas foram claramente expandidos dentro de KbKO.ßOVA.enxertos de ßKb (RRR de 61,4±26,6 para KbKO.ßOVA.kbko.ßOVA, Fig. 6b, P=0, 0008, relação de duas caudas emparelhada no teste t). Assim, mesmo na ausência do antigénio cognato na APC Hospedeira, o antigénio cognato nas células β parenquimais foi suficiente para conduzir a expansão das células T CD8 no local do enxerto. As poucas células FucciOT – I t presentes em KbKO.os enxertos de ßOVA assemelhavam-se aos do LN tanto em termos da sua progressão ineficiente para a fracção altamente dividida (Fig. 6a, C, 7, 5±0, 9% divididos em LN e 19, 3±3, 3% divididos em KbKO.enxertos de ßOVA) e falta de expressão Fúcida (Fig. 6a, d, 0, 1±0, 0% em LN e 0, 1±0, 1% em KbKO.enxertos de ßOVA) sugerindo que pouca proliferação de OT-I ocorreu no local do enxerto na ausência de antigénio cognato. Em contraste, o OT-I dentro do KbKO.ßOVA.os enxertos ßKb foram predominantemente divididos em grande parte (92, 3±1, 0%, Fig. 6a, c) e alguns deles foram Fucig+ e, portanto, proliferando ativamente (Fig. 6a, d, 5, 0±1, 2% Fucig+). Assim, a apresentação do antigénio cognato pelas células β parenquimais de ilhéu foi capaz de conduzir a proliferação de novo de FucciOT-I in situ.

FucciOT-I response to Grafs in KbKO BM into B6 host mice in which host hematopoietic cells lack H-2Kb expression. Os ratinhos enxertados receberam células do baço revestidas com peptídeo no dia da enxertia, a fim de iniciar a preparação do OT-I. a) parcelas de citometria de fluxo representativas (fixadas em linfócitos CD45.1+CD8+Va2+ viáveis). O painel superior mostra falta de divisão e expressão Fucig em câmara lenta de um rato que não foi enxertado nem preparado. Três painéis inferiores mostram reponses num rato bipolar enxertado e preparado: drenando o LN renal, KbKO.ßOVA e KbKO.ßOVA.enxertos de ßKb. Células divididas em ratos enxertados foram divididas em dois setores com as células altamente divididas caindo no setor em que CTV foi diluído além do limite de detecção. b) FucciOT-I total dividido em KbKO.ßOVA e KbKO.ßOVA.Enxertos bipolares ßKb, valores de P calculados pela razão de duas caudas emparelhados t-test. c) % fortemente divididos e d) % Fucig+ OT-i na drenagem de LN renal e enxertos de ratinhos enxertados bipolares. Os valores de P foram calculados por um teste t emparelhado de duas caudas. Os resultados para ratos individuais são ligados por linhas tracejadas, n = 6 ratos receptores agrupados a partir de dois experimentos independentes.
a IL-2 é mais importante, no local da inflamação
Vamos mostrar que a IL-2Ra expressão era mais importante para CD8+ células T proliferação e acúmulo de dentro periférica do parênquima (ilhéu enxertos), em comparação com o site de desobstrução de drenagem LN (Fig. 7a). Além disso, analisamos a resposta em um segundo local distante do local de preparação, ou seja, in não drenante. As células CD8+ T marcadas com CTV a partir de ratos OT-I. IL-2RAKO (IL-2Ra−CD45.2+) e OT-i/Ly5.1 (IL-2Ra+, CD45.1+CD45.2+) foram co-transferidas para ratos hospedeiros B6.CD45.1 (CD45.1+) Antes de receber um único enxerto de B6.ilhotas ßOVA. As assinaturas alélicas CD45 distintas de cada uma das populações de células T transferidas (em combinação com coloração para CD8 e Va2) permitiram quantificar e comparar a razão de WT dividida:IL-2RAKO OT-I (fig. 7a, Suplemento Fig. 3). IL-2Ra WT superou claramente o IL-2Ra KO OT-I no local do enxerto em comparação com drenagem (P=0, 025, teste t emparelhado de duas caudas) ou não drenagem (P=0, 044, teste t emparelhado de duas caudas) LN. Isto é consistente com o aumento da dependência das células T CD8+ em IL-2 no momento do encontro secundário com antigénio no local da inflamação, em comparação com a preparação inicial na LN drenante.
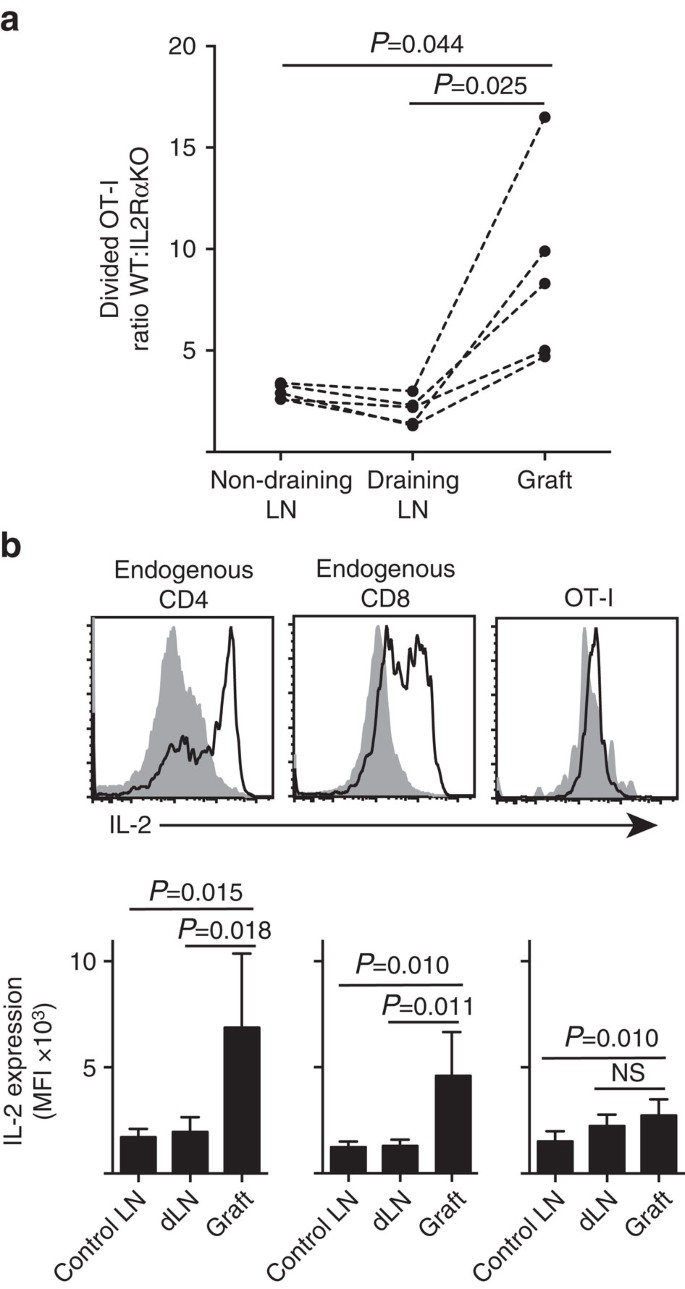
(a) rácio de células il-2Ra WT divididas:il-2RA KO ot-I recuperadas de B6.enxerto de ßOVA, drenando LN renal e LN inguinal não drenante após Co-transferência (106 de cada) para ratos hospedeiros B6.CD45.1. Foram calculadas relações para órgãos individuais com resultados para ratos individuais ligados por linhas tracejadas e comparadas por um teste t emparelhado de duas caudas. Resultados apresentados para n = 5 ratos receptores e representativos de três experiências independentes. b) expressão IL-2 nas células endógenas CD4+ e CD8+ e nas células OT-i transferidas nos receptores B6 de B6.enxertos de ilhéus de ßOVA. Os painéis superiores mostram parcelas de citometria de fluxo representativas para Enxertos drenantes de LN (cinzento sólido) e Enxertos (linha negra). Os painéis inferiores resumem a intensidade fluorescente média (MFI) da expressão IL-2 para LNs renais retirados de ratos enxertados (Control LN), bem como LN renal enxertado e drenante (dLN) de ratos enxertados. Resultados apresentados como média+s. d., n = 6 obtidos a partir de duas experiências independentes e comparados por um teste T de duas caudas não emparelhado com a correcção de Welch.
a elevada dependência da IL – 2 para a proliferação de células T CD8+ no local da inflamação inferiu um requisito para a produção local da IL-2. Assim, examinamos o potencial de várias células T (endógenas derivadas do hospedeiro CD4+ e CD8+, bem como transferidas de células ot-i CD8+ T) para a capacidade de produzir IL-2 (Fig. 7b). As suspensões celulares preparadas a partir de enxertos ou LN foram brevemente (4 h) restimuladas com PMA e ionomicina antes de coloração para a expressão da IL-2 intracelular. A análise das células CD4+ e T CD8+ derivadas do hospedeiro endógeno forneceu provas convincentes da produção IL-2 no local da inflamação do enxerto com um aumento claro da coloração IL-2 na IFM, em comparação com a LN drenante ou não drenante. Os níveis IL-2 nas células T CD8+ ot-i no local da inflamação aumentaram moderadamente em relação aos níveis na LN não drenante, mas não diferiram significativamente dos níveis na LN drenante. Uma interpretação destes dados é que a interacção cognata do OT-i com as células parenquimais induz uma proliferação rápida, mas uma produção pobre do IL-2, Tal que o OT-i é dependente da paracrina IL-2 derivada das células endógenas CD4+ e CD8+ T no ambiente local do enxerto. No entanto, um experimento adicional indicou que exógeno IL-2 na ausência de antígeno parênquimal não poderia conduzir a expansão da célula OT-i CD8+. IL-2 (hil-2 recombinante, 25.000 UI) foi administrado por via intraperitoneal a ratinhos B6 que receberam Enxertos bipolares de B6.ßOVA e B6 ilhotas. A comparação da recuperação do OT-i em órgãos recuperados em ratos tratados com IL-2 ou em veículos no dia 6 após a enxertia não mostrou um aumento significativo na acumulação de células OT-i divididas em dois locais que não possuem antigénio parenquimático, nomeadamente B6 enxertos de Ilhéus (3±3 no veículo tratado em comparação com 49±64 em ratinhos tratados com IL-2, P=0.342) e LN inguinal não drenante (1648+633 no veículo tratado em comparação com 1660+1 023 em ratinhos tratados com IL-2, P=0, 987, média±s. d., n=3, teste t de duas caudas não emparelhado com correcção de Welch).