Säuren, Basen und pH-Wert
|
|||||||||
SÄUREN UND IHRE KONJUGIERTEN BASEN
Denken Sie an die Bronsted–Lowry-Definition einer Säure: Eine Säure ist ein Protonendonor. Offensichtlich spendet Essigsäure in unserem vorherigen Beispiel sein Proton an H2O in der Vorwärtsreaktion, was zur Bildung des Acetationen führt. Bei der umgekehrten Reaktion akzeptiert das Acetationen jedoch ein Proton von H3O +, um zu CH3COOH zurückzukehren. Aus der Bronsted-Lowry-Definition ist eine Base ein Protonenakzeptor.
|
Somit wirkt das Acetat-Ion als Base in der Rückreaktion und ist genannt die konjugierte Base von Essigsäure. Essigsäure und das Acetat–Ion sind als Säure-Base-Konjugat-Paar bekannt. Interessanterweise gibt es in der obigen Reaktion ein zweites Säure–Base-Konjugatpaar. Beachten Sie, wie in der umgekehrten Reaktion H3O + ein Proton spendet (was es zu einer Säure macht), während in der Vorwärtsreaktion H2O ein Proton akzeptiert (was es zu einer Base macht). H2O und H3O + sind ein konjugiertes Säure-Base-Paar, wobei H3O + die konjugierte Säure und H2O die konjugierte Base ist.
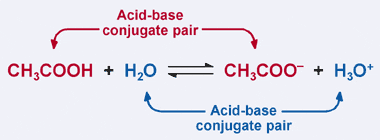
In einem konjugierten Säure-Base-Paar hat die konjugierte Säure ein Proton mehr als ihre entsprechende konjugierte Base.