12.4: avdunstning och kondensation
avdunstning
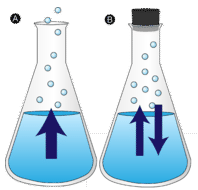
en vattenpöl som lämnas ostörd försvinner så småningom. De flytande molekylerna flyr in i gasfasen och blir vattenånga. Förångning är processen där en vätska omvandlas till en gas. Avdunstning är omvandlingen av en vätska till dess ånga under vätskans koktemperatur. Om vattnet istället hålls i en sluten behållare har vattenångmolekylerna ingen chans att fly ut i omgivningen och så förändras inte vattennivån. När vissa vattenmolekyler blir ånga kondenserar ett lika stort antal vattenångmolekyler tillbaka till flytande tillstånd. Kondensation är tillståndsförändringen från en gas till en vätska.
för att en flytande molekyl ska kunna fly in i gastillståndet måste molekylen ha tillräckligt med kinetisk energi för att övervinna de intermolekylära attraktiva krafterna i vätskan. Kom ihåg att ett givet vätskeprov kommer att ha molekyler med ett brett spektrum av kinetiska energier. Flytande molekyler som har denna specifika tröskelkinetiska energi flyr ytan och blir ånga. Som ett resultat har de flytande molekylerna som återstår nu lägre kinetisk energi. När avdunstning sker minskar temperaturen hos den återstående vätskan. Du har observerat effekterna av evaporativ kylning. På en varm dag absorberar vattenmolekylerna i din svett kroppsvärmen och avdunstar från hudens yta. Förångningsprocessen lämnar den återstående svettkylaren, som i sin tur absorberar mer värme från kroppen.
en viss vätska avdunstar snabbare när den värms upp. Detta beror på att uppvärmningsprocessen resulterar i en större del av vätskans molekyler som har den nödvändiga kinetiska energin för att undkomma vätskans yta. Figuren nedan visar den kinetiska energifördelningen av flytande molekyler vid två temperaturer. Antalet molekyler som har den nödvändiga kinetiska energin att avdunsta visas i det skuggade området under kurvan till höger. Vätskan med högre temperatur \(\left (t_2 \ right)\) har fler molekyler som kan komma ut i ångfasen än vätskan med lägre temperatur \(\left( t_1 \right)\).
vid 29 029 fot \(\vänster( 8848 \: \text{m} \höger)\), Mount Everest i Himalaya range på gränsen mellan Kina och Nepal är den högsta punkten på jorden. Dess höjd ger många praktiska problem för klättrare. Luftens syreinnehåll är mycket lägre än vid havsnivån, vilket gör det nödvändigt att ta med syretankar (även om några klättrare har nått toppen utan syre). Ett annat problem är att koka vatten för att laga mat. Även om vatten kokar vid \(100^\text{o} \text{C}\) vid havsnivå, är kokpunkten ovanpå Mount Everest bara om \(70^\text{o} \text{C}\). Denna skillnad gör det mycket svårt att få en anständig kopp te (vilket definitivt frustrerade några av de brittiska klättrarna).