17.3: bildandet av komplexa joner
effekten av bildandet av komplexa joner på löslighet
vad händer med lösligheten hos ett sparsamt lösligt salt om en ligand som bildar en stabil komplex Jon läggs till lösningen? Ett sådant exempel förekommer i konventionell svartvitt fotografering. Minns att svartvitt fotografisk film innehåller ljuskänsliga mikrokristaller av AgBr eller blandningar av AgBr och andra silverhalogenider. AgBr är ett sparsamt lösligt salt, med en Ksp på 5,35 10-13 15 vid 25 C. När kamerans slutare öppnas träffar ljuset från objektet som fotograferas några av kristallerna på filmen och initierar en fotokemisk reaktion som omvandlar AgBr till svart Ag-metall. Välformade, stabila negativa bilder visas i gråtoner, vilket motsvarar antalet omvandlade korn av AgBr, där de områden som utsätts för det mest ljusa är mörkaste. För att fixera bilden och förhindra att fler AgBr-kristaller omvandlas till Ag-metall under bearbetning av filmen avlägsnas den oreagerade AgBr på filmen med användning av en komplexningsreaktion för att lösa upp det sparsamt lösliga saltet.
reaktionen för upplösning av silverbromid är som följer:
\
med
\
jämvikten ligger långt till vänster, och jämviktskoncentrationerna av Ag+ och Br− joner är mycket låga (7,31 kcal 10-7 m). Som ett resultat skulle borttagning av oreagerad AgBr från till och med en enda filmrulle med rent vatten kräva tiotusentals liter vatten och mycket tid. Le Chateliers princip berättar dock att vi kan driva reaktionen till höger genom att ta bort en av produkterna, vilket kommer att få mer AgBr att lösa upp. Bromidjon är svår att avlägsna kemiskt, men silverjon bildar en mängd stabila tvåkoordinatkomplex med neutrala ligander, såsom ammoniak, eller med anjoniska ligander, såsom cyanid eller tiosulfat (S2O32−). Vid fotografisk bearbetning löses överskott av AgBr med användning av en koncentrerad lösning av natriumtiosulfat.
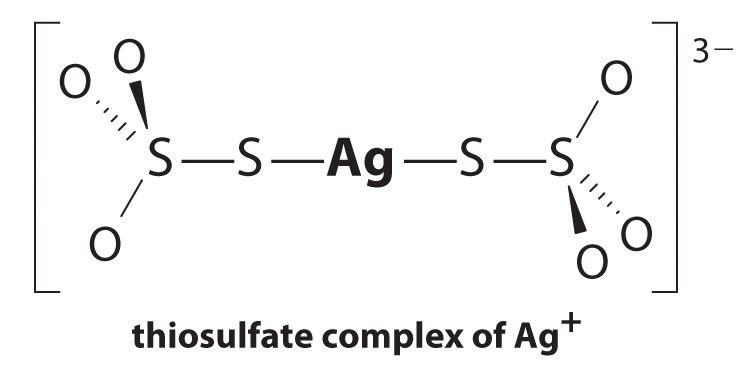
reaktionen av Ag + med tiosulfat är som följer:
\^{3−}_{(aq)} \ etikett{17.3.5a}\]
med
\
storleken på jämviktskonstanten indikerar att nästan alla Ag+−joner i lösning omedelbart kommer att komplexas av tiosulfat för att bilda 3 -. Vi kan se effekten av tiosulfat på lösligheten hos AgBr genom att skriva lämpliga reaktioner och lägga till dem tillsammans:
\\ \mathrm{Ag^+(aq)} + \mathrm{2S_2O_3^{2 -} (aq)}\rightleftharpuner\mathrm{^{3 -} (aq)}\hspace{3mm}K_\textrm f&=2.9 \ gånger10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm F} = 15 \ end{align} \ label{17.3.6}\)
jämförelse av K med Ksp visar att bildandet av den komplexa Jonen ökar lösligheten av AgBr med ungefär 3 1013-oc. Den dramatiska ökningen av löslighet i kombination med låg kostnad och låg toxicitet förklarar varför natriumtiosulfat används nästan universellt för att utveckla svartvit film. Om så önskas kan silveret återvinnas från tiosulfatlösningen med någon av flera metoder och återvinnas.
om en komplex Jon har en stor Kf kan bildandet av en komplex Jon dramatiskt öka lösligheten hos sparsamt lösliga salter.
exempel \(\PageIndex{2}\)
på grund av den gemensamma joneffekten kan vi förvänta oss att ett salt som AgCl är mycket mindre lösligt i en koncentrerad lösning av KCl än i vatten. Ett sådant antagande skulle dock vara felaktigt eftersom det ignorerar det faktum att silverjon tenderar att bilda ett tvåkoordinatkomplex med kloridjoner (AgCl2 -). Beräkna lösligheten av AgCl i varje situation:
- i rent vatten
- i 1,0 M KCl-lösning, ignorerar bildandet av några komplexa joner
- samma lösning som i del (b) förutom att ta hänsyn till bildandet av komplexa joner, förutsatt att AgCl2− är det enda Ag+ – komplexet som bildas i signifikanta koncentrationer
vid 25 CCL, ksp = 1,77 10-10 för AgCl och Kf = 1.1 msk 105 för AgCl2−.
givet: KSP av AgCl, Kf av AgCl2 – och KCl-koncentration
bad om: löslighet av AgCl i vatten och i KCl-lösning med och utan bildning av komplexa joner
strategi:
- skriv löslighetsproduktuttrycket för AgCl och beräkna koncentrationen av Ag + och Cl− i vatten.
- beräkna koncentrationen av Ag+ i KCl-lösningen.
- skriv balanserade kemiska ekvationer för upplösning av AgCl och för bildandet av AgCl2− komplexet. Lägg till de två ekvationerna och beräkna jämviktskonstanten för den totala jämvikten.
- skriv jämviktskonstantuttrycket för den totala reaktionen. Lös för koncentrationen av den komplexa Jonen.
lösning
- A om vi låter x lika med lösligheten av AgCl, då vid jämvikt = = x M. ersätta detta värde i löslighetsproduktuttrycket,
således är lösligheten av AgCl i rent vatten vid 25 C 1,33 10-5 m.
- B om x är lika med lösligheten av AgCl i KCl-lösningen, då vid jämvikt = X M och = (1,0 + x) M. ersätta dessa värden i löslighetsproduktuttrycket och antar att x << 1.0,
om den gemensamma joneffekten var den enda viktiga faktorn, skulle vi förutsäga att AgCl är ungefär fem storleksordningar mindre lösliga i en 1,0 M KCl-lösning än i vatten.
- C för att redogöra för effekterna av bildandet av komplexa joner måste vi först skriva jämviktsekvationerna för både upplösningen och bildandet av komplexa joner. Att lägga till ekvationerna som motsvarar Ksp och Kf ger oss en ekvation som beskriver upplösningen av AgCl i en KCl-lösning. Jämviktskonstanten för reaktionen är därför produkten av Ksp och Kf:
\\ \mathrm{Ag^+(aq)} + \mathrm{2Cl^{ – }}\rightleftharpuner\mathrm {^{ – }}\hspace{3mm}K_ \ textrm f& =1,1 \ times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1,9 \ times10^{-5} \ end{align}\)
D om vi låter x lika med lösligheten av AgCl i KCl-lösningen , då vid jämvikt = x och = 1,0-x. ersätta dessa kvantiteter i jämviktskonstantuttrycket för nätreaktionen och antar att x << 1.0,
det vill säga AgCl löses upp i 1,0 M KCl för att producera en 1,9 10-5 m lösning av agcl2− komplexjonen. Således förutspår vi att AgCl har ungefär samma löslighet i en 1,0 M KCl-lösning som den gör i rent vatten, vilket är 105 gånger större än det som förutses baserat på den vanliga joneffekten. (I själva verket är den uppmätta lösligheten av AgCl i 1,0 M KCl nästan en faktor på 10 större än den i rent vatten, till stor del på grund av bildandet av andra kloridinnehållande komplex.)
övning \(\PageIndex{2}\)
beräkna lösligheten av kvicksilver (II) jodid (HgI2) i varje situation:
- rent vatten
- en 3,0 m-lösning av NaI, förutsatt att 2-är den enda Hg−innehållande arten närvarande i signifikanta mängder
Ksp = 2,9 10-29 för hgi2 och Kf = 6,8 1029 för 2 -.
Svar
- 1.9 × 10-10 M
- 1.4 M
komplexbildare, molekyler eller joner som ökar lösligheten av metallsalter genom att bilda lösliga metallkomplex är vanliga komponenter i tvättmedel. Långkedjiga karboxylsyror, huvudkomponenterna i tvålar, bildar olösliga salter med Ca2 + och Mg2+, som är närvarande i höga koncentrationer i “hårt” vatten. Utfällningen av dessa salter ger en badring och ger en grå tinge till kläder. Att tillsätta ett komplexbildande medel såsom pyrofosfat (O3POPO34-eller P2O74 -) eller trifosfat (P3O105−) till tvättmedel förhindrar att magnesium – och kalciumsalterna utfälls eftersom jämviktskonstanten för komplexjonbildning är stor:
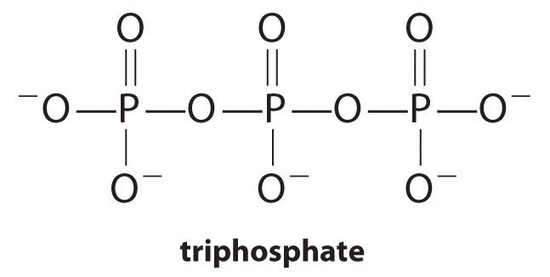
med
fosfater kan emellertid orsaka miljöskador genom att främja eutrofiering, tillväxten av alltför stora mängder alger i en vattenkälla, vilket så småningom kan leda till stora minskningar av nivåer av upplöst syre som dödar fisk och andra vattenlevande organismer. Följaktligen har många stater i USA förbjudit användningen av fosfatinnehållande tvättmedel, och Frankrike har förbjudit användningen från och med 2007. “Fosfatfria” tvättmedel innehåller olika typer av komplexbildare, såsom derivat av ättiksyra eller andra karboxylsyror. Utvecklingen av fosfatsubstitut är ett område med intensiv forskning.
kommersiella vattenmjukgörare använder också ett komplexbildande medel för att behandla hårt vatten genom att passera vattnet över jonbytarhartser, som är komplexa natriumsalter. När vatten strömmar över hartset löses natriumjon och olösliga salter fälls ut på hartsytan. Vatten som behandlas på detta sätt har en saltare smak på grund av närvaron av Na+, men den innehåller färre upplösta mineraler.
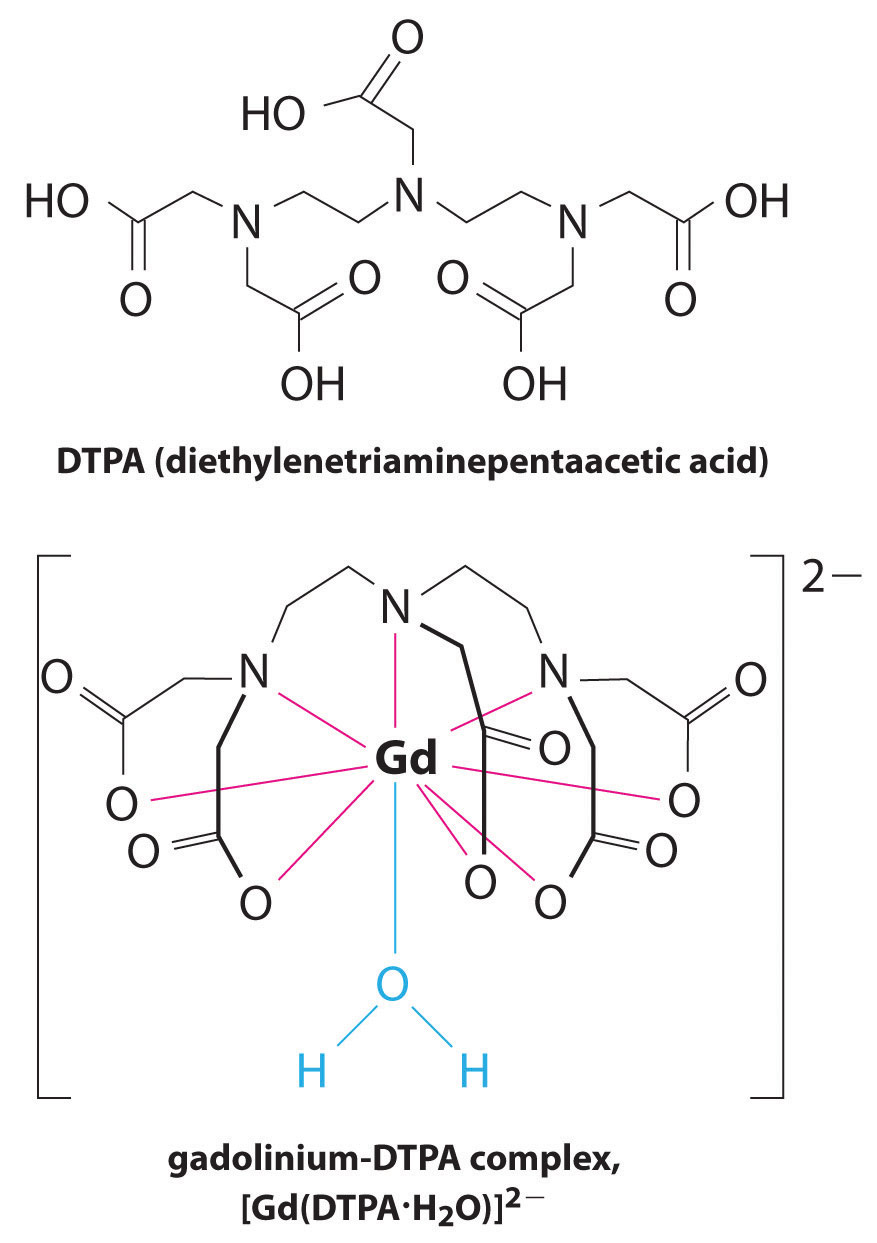
en annan applikation av komplexbildare finns i medicin. Till skillnad från röntgenstrålar kan magnetisk resonansavbildning (MRI) ge relativt bra bilder av mjuka vävnader som inre organ. MR är baserad på de magnetiska egenskaperna hos 1H-kärnan av väteatomer i vatten, vilket är en huvudkomponent i mjuka vävnader. Eftersom vattnets egenskaper inte beror mycket på om det är inne i en cell eller i blodet är det svårt att få detaljerade bilder av dessa vävnader som har god kontrast. För att lösa detta problem har forskare utvecklat en klass av metallkomplex som kallas “Mr-kontrastmedel.”Injektion av ett Mr-kontrastmedel i en patient påverkar selektivt de magnetiska egenskaperna hos vatten i celler i normala vävnader, i tumörer eller i blodkärl och tillåter läkare att “se” var och en av dessa separat (figur \(\PageIndex{2}\)). En av de viktigaste metalljonerna för denna applikation är Gd3+, som med sju oparade elektroner är mycket paramagnetisk. Eftersom Gd3+(aq) är ganska giftigt måste det administreras som ett mycket stabilt komplex som inte dissocierar i kroppen och kan utsöndras intakt av njurarna. Komplexbildningsmedlen som används för gadolinium är ligander såsom DTPA5 – (dietylentriaminpentaättiksyra), vars fullständigt protonerade form visas här.
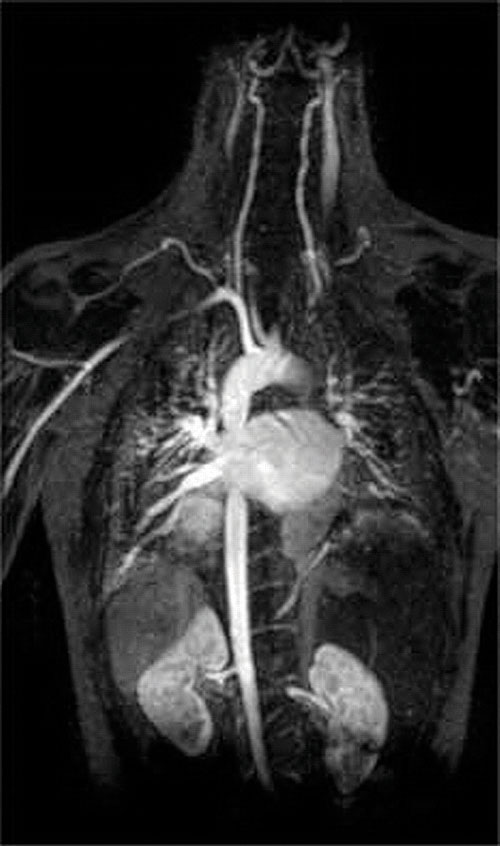
figur \(\PageIndex{2}\): en MR-bild av hjärtat, artärerna och venerna. När en patient injiceras med en paramagnetisk metallkatjon i form av ett stabilt komplex som kallas ett Mr-kontrastmedel, förändras de magnetiska egenskaperna hos vatten i celler. Eftersom de olika miljöerna i olika typer av celler svarar annorlunda kan en läkare få detaljerade bilder av mjuka vävnader.