2.3: kolmonoxid och backbonding
Allmänna egenskaper
CO är en dativ, l-typ ligand som inte påverkar oxidationstillståndet hos metallcentret vid bindning, men ökar det totala elektronantalet med två enheter. Vi har nyligen sett att det verkligen finns två bindningsinteraktioner på spel i karbonylliganden: en ligand-till-metall nknubbi dknubbi-interaktion och en metall-till-ligand dnubbi-interaktion*. Den senare interaktionen kallas backbonding, eftersom metallen donerar elektrondensiteten tillbaka till liganden. För att påminna mig om förekomsten av backbonding gillar jag att använda den högra resonansstrukturen när det är möjligt; det är dock viktigt att komma ihåg att behandla CO som en l-typ ligand oavsett vilken resonansform som dras.

Orbitalinteraktioner I M = C = O.
CO är en stark hCG-donator (eller en bra CX-bas) och en bra CX-acceptor (eller CX-syra). Egenskaperna hos ligerad CO beror djupt på metallcentrets identitet. Mer specifikt dikterar metallcentrets elektroniska egenskaper vikten av backbonding i metallkarbonylkomplex. Mest rakt på sak, mer elektronrika metallcentra är bättre på backbonding till CO. Varför är det viktigt att fastställa styrkan i backbonding?
infraröd spektroskopi har famously använts för att empiriskt stödja tanken på backbonding. Tabellen nedan ordnar några metallkarbonylkomplex i” periodisk ” ordning och ger frekvensen som motsvarar C=O-sträckningsläget. Lägg märke till att utan undantag har varje komplex CO en sträckfrekvens som är lägre än den för gratis CO. Backbonding är att skylla! C – O-bindningsordningen i komplexbildad kolmonoxid är (nästan alltid) lägre än den för fri CO.

c = o sträckfrekvenser i metall-karbonylkomplex. Verkar något här borta?
figuren ovan visar en tydlig ökning av frekvensen (en ökning av C–O-bindningsordningen) när vi flyttar vänster till höger över det periodiska systemet. Detta resultat kan verka konstigt om vi anser att antalet d-elektroner i den neutrala metallen ökar när vi flyttar från vänster till höger. Borde inte metallcentra med fler d-elektroner vara bättre på backbonding (och mer “elektronrika”)? Vad händer här? Minns den periodiska trenden i orbital energi. När vi rör oss från vänster till höger minskar d-orbitalenergierna och energierna i DN-och GHz* – orbitalerna separeras. Som ett resultat blir backbonding orbital interaktion sämre (kom ihåg att starka orbital interaktioner kräver väl matchade orbital energier) när vi går mot de mer elektronegativa sena övergångsmetallerna! Vi kan dra en analogi med enaminer och enoletrar från organisk kemi. Den mer elektronegativa syreatomen i enoletrar är en sämre elektrondonator än enamins kväveatom.

betydelsen av backbonding beror på metallens elektronegativitet och dess elektrontäthet.
naturligtvis kan bidraget från andra ligander på metallcentret till backbonding inte heller glömmas bort. Logiskt sett tenderar elektrondonerande ligander att göra backbonden starkare (de gör metallen till en bättre elektrondonator), medan elektronuttagande ligander kommer att förvärra backbonding. Att lägga till elektronrika fosfinligander till ett metallcentrum minskar till exempel Co-sträckningsfrekvensen på grund av förbättrad backbonding.
karbonyl-ligander kan berömt överbrygga flera metallcentra. Bindning i överbryggade karbonylkomplex kan vara antingen” traditionell ” eller delokaliserad, beroende på komplexets struktur och överbryggningsläget. Mångfalden av överbryggningslägen härrör från de olika elektrondonorerna och acceptorerna som finns på CO-liganden (och möjligheten till delokaliserad bindning). Kända överbryggningslägen visas i figuren nedan.
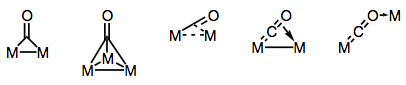
bygga broar med karbonyl ligander!