3.3 konformation av cyklohexan
konformationer av cyklohexan
en plan struktur för cyklohexan är helt klart osannolik. Bindningsvinklarna skulle nödvändigtvis vara 120 kg, 10,5 kg större än den ideala tetraedriska vinkeln. Dessutom skulle varje kol-kolbindning i en sådan struktur förmörkas. De resulterande vinkel-och förmörkelsestammarna skulle allvarligt destabilisera denna struktur. Om två kolatomer på motsatta sidor av den sexledade ringen lyfts ut ur ringens plan kan mycket av vinkelstammen elimineras.
denna båtstruktur har fortfarande två förmörkade bindningar och svår sterisk trängsel av två väteatomer på båtens “båge” och “akter”. Denna steriska trängsel kallas ofta steriskt hinder. Genom att vrida båtkonformationen kan det steriska hindret delvis lindras, men twist-boat conformer behåller fortfarande några av de stammar som kännetecknar båtkonformatorn. Slutligen, genom att lyfta ett kol över ringplanet och det andra under Planet, bildas en relativt belastningsfri ‘stol’-konformer. Detta är den dominerande strukturen som antas av molekyler av cyklohexan.
undersökningar om cyklohexans konformationer initierades av H. Sachse (1890) och E. Mohr (1918), men det var inte förrän 1950 som en fullständig behandling av de många konsekvenserna av interconverting chair conformers och de olika orienteringarna av hängande obligationer belystes av D. H. R. Barton (Nobelpriset 1969 tillsammans med O. Hassel). Följande diskussion presenterar några av de väsentliga funktionerna i denna konformationsanalys.
vid noggrann undersökning av en stolskonformation av cyklohexan finner vi att de tolv väten inte är strukturellt ekvivalenta. Sex av dem ligger runt periferin av kolringen och kallas ekvatorial. De andra sex är orienterade över och under Ringens ungefärliga plan (tre på varje plats) och kallas axiella eftersom de är inriktade parallellt med ringens symmetriaxel.
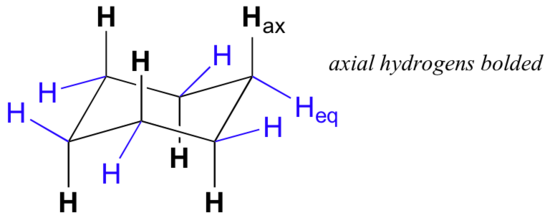
i figuren ovan är ekvatoriella väten färgade blå och axiella väten är i fetstil. Eftersom det finns två ekvivalenta stolkonformationer av cyklohexan i snabb jämvikt, har alla tolv väten 50% ekvatorial och 50% axiell karaktär. Figuren nedan illustrerar hur man konverterar en molekylär modell av cyklohexan mellan två olika stolkonformationer-det här är något du bör öva med modeller. Lägg märke till att en’ ringflip ‘ får ekvatoriella väten att bli axiella och vice versa.
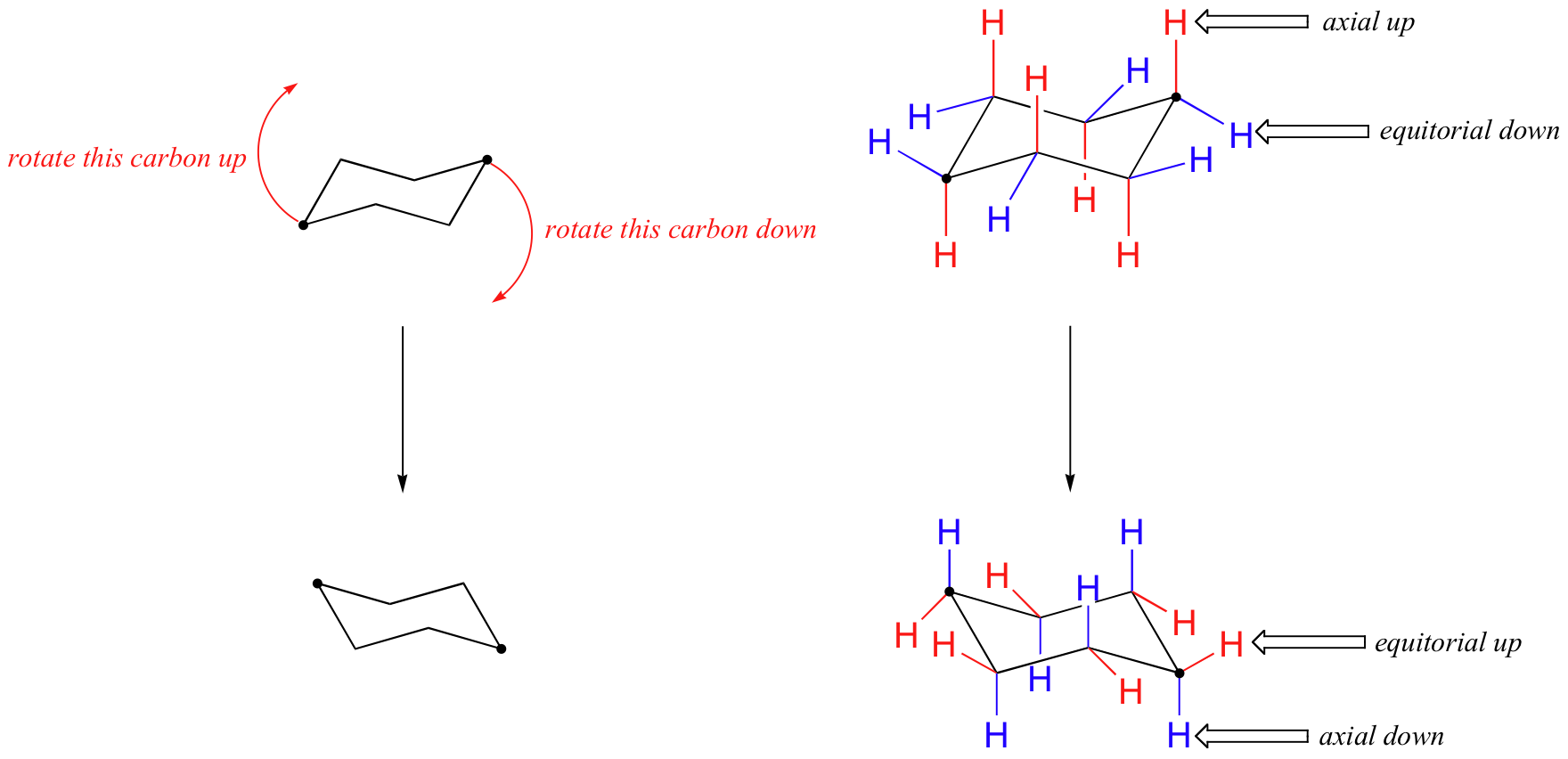
eftersom axiella bindningar är parallella med varandra lider substituenter större än väte i allmänhet större sterisk trängsel när de är orienterade axiella snarare än ekvatoriella. Följaktligen antar substituerade cyklohexaner företrädesvis konformationer där de större substituenterna antar ekvatorial orientering.
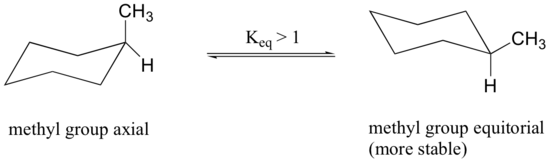
när metylgruppen i strukturen ovan upptar en axiell position lider den sterisk trängsel av de två axiella väten som ligger på samma sida av ringen.

konformationen i vilken metylgruppen är ekvatorial är stabilare, och därmed ligger jämvikten i denna riktning.
det relativa steriska hindret som upplevs av olika substituentgrupper orienterade i en axiell kontra ekvatorial plats på cyklohexan kan bestämmas av föreningens konformationsjämvikt. Den motsvarande jämviktskonstanten är relaterad till energiskillnaden mellan konformarna, och insamling av sådana data gör det möjligt för oss att utvärdera den relativa tendensen hos substituenter att existera i en ekvatorial eller axiell plats.En tabell över dessa fria energivärden (ibland kallade A-värden) kan undersökas genom att klicka här.
när man tittar på energivärdena i denna tabell är det uppenbart att den uppenbara “storleken” av en substituent (i termer av dess preferens för ekvatorial över axiell orientering) påverkas av dess bredd och bindningslängd till cyklohexan, vilket framgår av det faktum att en axiell vinylgrupp är mindre hindrad än etyl och jod något mindre än klor.
vi noterade tidigare att cykloalkaner som har två eller flera substituenter på olika ringkolatomer existerar som ett par (ibland mer) konfigurationsstereoisomerer. Nu måste vi undersöka hur gynnsamma ringkonformationer påverkar egenskaperna hos konfigurationsisomererna. Kom ihåg, konfigurations stereoisomerer är stabila och inte lätt interconvert, medan, konformations isomerer normalt interconvert snabbt. Vid undersökning av möjliga strukturer för substituerade cyklohexaner är det användbart att följa två principer:
(i) Stolkonformationer är i allmänhet mer stabila än andra möjligheter.
(ii) substituenter på stolkonformatorer föredrar att ockupera ekvatoriella positioner på grund av det ökade steriska hindret för axiella platser.
följande ekvationer och formler illustrerar hur närvaron av två eller flera substituenter på en cyklohexanring stör interkonverteringen av de två stolkonformatorerna på sätt som kan förutsägas.
när det gäller 1,1-disubstituerade cyklohexaner måste en av substituenterna nödvändigtvis vara axiell och den andra ekvatorial, oavsett vilken stolkonformator som beaktas. Eftersom substituenterna är desamma i 1,1-dimetylcyklohexan är de två konformerna identiska och närvarande i lika koncentration. I 1-t-butyl-1-metylcyklohexan är t-butylgruppen mycket större än metylen, och den stolkonformer där den större gruppen är ekvatorial kommer att gynnas i jämvikten( > 99%). Följaktligen är metylgruppen i denna förening nästan uteslutande axiell i sin orientering.
i fallen med 1,2-, 1,3 – och 1,4-disubstituerade föreningar är analysen lite mer komplex. Det är alltid möjligt att ha båda grupperna ekvatoriella, men om detta kräver ett cis-förhållande eller ett trans-förhållande beror på substituenternas relativa placering. När vi räknar runt ringen från kol # 1 till #6, ändrar den översta bindningen på varje kol sin orientering från ekvatorial (eller axiell) till axiell (eller ekvatorial) och tillbaka. Det är viktigt att komma ihåg att bindningarna på en given sida av en stolringskonformation alltid växlar på detta sätt. Därför bör det vara klart att för cis-1,2-disubstitution måste en av substituenterna vara ekvatorial och den andra axiell; i trans-isomeren kan båda vara ekvatoriella. På grund av den växlande naturen hos ekvatoriella och axiella bindningar är det motsatta förhållandet sant för 1,3-disubstitution (cis är alla ekvatoriella, trans är ekvatorial/axiell).
slutligen återgår 1,4-disubstitution till 1,2-mönstret:
ovanstående analys är inte något du bör försöka memorera: snarare, bli bekväm med att dra cyklohexan i stolskonformationen, med bindningar som pekar i rätt riktning för axiella och ekvatoriella substituenter. Om du kan rita en struktur korrekt i stolskonformationen bör du alltid kunna bestämma vilka positioner som är axiella och vilka som är ekvatoriella.