7.4: komplex III
komplex III accepterar elektroner från både komplex i och komplex II. elektronerna anländer i form av ubiquinol, UQH2, som levererar två elektroner och två protoner och omvandlas tillbaka till ubiquinon, UQ. Ubiquinonen skyttar sedan tillbaka till komplex i eller komplex II för att samla in fler elektroner.
- komplex III är destinationen för elektroner som kommer från både komplex i och komplex II.
- komplex III använder energi som frigörs vid nedförsbacke elektronöverföringar för att pumpa fler protoner över det inre mitokondriella membranet.
- protongradienten över membranet används för att driva ATP-bildning vid komplex V.
- komplex III skickar sedan sina elektroner vidare till komplex IV.
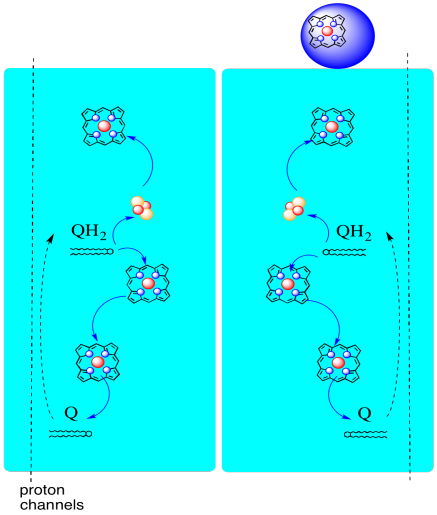
vägen för elektroner genom komplex III visas nedan. Observera att komplexet är en dimerisk struktur, med två ekvivalenta vägar: en som visas till vänster och den andra till höger. Elektroner levereras från UQH2, ubiquinol, i mitten av bilden, som reser uppåt till mobil cytokrom c på toppen. En andra elektronväg tillåter rörelse nedåt i bilden, mot en annan molekyl av ubikinon, som återvinner elektronerna i en slinga.
- komplex III har en ovanlig, divergerande elektronväg.
- en elektron färdas vidare mot cytokrom c.
- den andra elektronen återvinns så småningom till en annan ubiquinol.
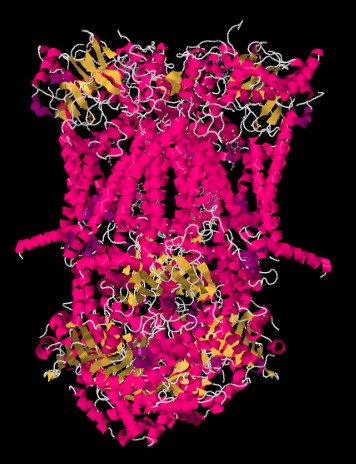
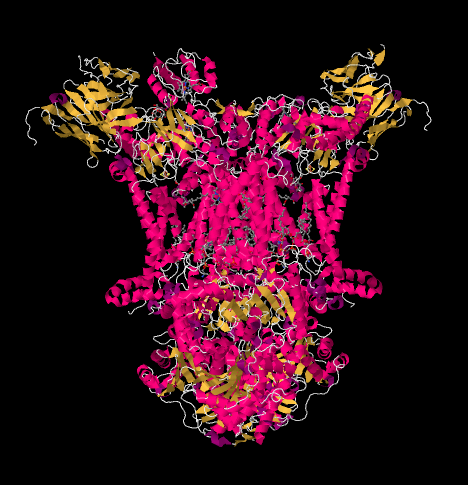
Röntgenstrukturen för komplex III visas i tecknad form nedan. Det inre mitokondriella membranet skulle korsa komplexets övre mittdel. Majoriteten av de komplexa projekten nedan, in i matrisen (botten av bilden, i denna orientering), även om en betydande mängd också sticker ut i intermembranutrymmet.
komplex III fortsätter elektrontransportkedjan och skickar elektroner till högre reduktionspotential (och lägre fri energi) och mot ett möte med molekylärt syre i komplex IV. Protoner pumpas också från mitokondriell matris, över det inre mitokondriella membranet och in i intermembranutrymmet. Samtidigt resulterar en andra elektronväg i en effektiv återvinning av hälften av elektronerna som kommer in i komplexet, vilket ökar antalet protoner pumpade per elektron som anländer till komplex III.
- det har föreslagits att elektronåtervinningsslingan ger en mekanism för att dra fler protoner upp från matrisen.
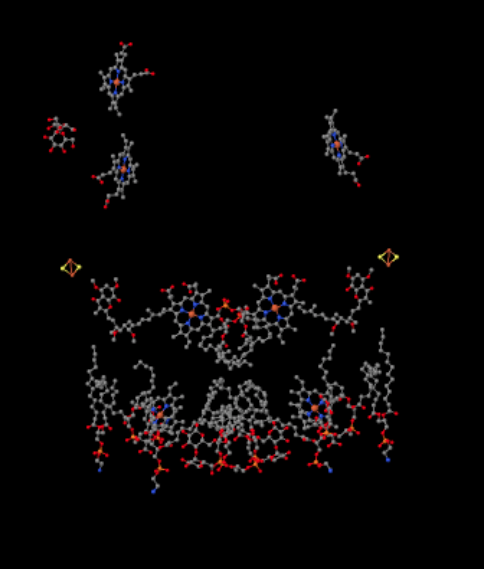
vi kan se detta ovanliga arrangemang om vi ignorerar proteinerna för att avslöja liganderna nedan. Komplexet kan tydligare ses som en dimer; den vänstra halvan av bilden är exakt densamma som höger, även om den återspeglas motsatt sätt. Elektroner kommer in i komplexet via mobiloperatören, ubiquinol, synlig på höger och vänster sida av bilden ungefär halvvägs ner; Du kan se ringenoch en kedja som hänger från den.
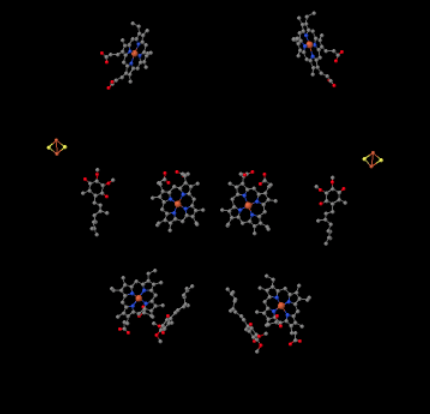
när UQH2 binder till komplex III skickas en elektron vidare till ett Fes-kluster, medan den andra skickas till ett järnheme-centrum, kallat heme BL. FeS-klustret är synligt strax ovanför ubiquinol och till kanten av bilden. Heme BL är mot mitten av bilden.
även om det inte är uppenbart i röntgenbilden som visas, är detta Fes-kluster annorlunda än de som du såg tidigare. Den här hålls på plats med olika aminosyrasidokedjor. Du kan inte se det på bilden eftersom hela proteinet har utelämnats, tillsammans med de aminosyror som binder till klustret. Medan de flesta Fes-kluster hålls på plats uteslutande av cysteiner, hålls detta kluster på plats av två cysteier på ena sidan men av två histidiner på den andra. Detta märkliga Fes-kluster kallas ett Rieske-kluster.
Rieske-kluster är viktiga eftersom de är “högpotentiella Fes-kluster”. Det innebär att de har exceptionellt positiva reduktionspotentialer jämfört med andra Fes-kluster. Reduktionspotentialen för någon ligand i ett protein är mycket beroende av dess miljö, och så finns det ett brett spektrum av värden i de flesta fall. Det är sant för järnsvavelkluster; normala har reduktionspotentialer som sträcker sig från -1,0 V till cirka +0,05 V. Rieske-kluster har potentialer som sträcker sig från cirka 0V till cirka 0,4 V.
från Fes-klustret skickas elektronen vidare till ett annat järnheme-centrum i en membranbunden enhet som kallas cytokrom c1. Cytokrom c1 kan ses högst upp på bilden. Eftersom denna bild är orienterad på samma sätt som de andra Röntgenstrukturerna i andningskomplexet, kan vi se att denna elektron transporteras upp mot intermembranutrymmet. Slutligen överförs denna elektron till en annan hem, men denna hem är bunden i ett litet mobilt protein, kallat cytokrom c. cytokrom c är en annan mobil elektronbärare. Den bär elektronen vidare till komplex IV. vi kommer tillbaka till cytokrom c lite senare.
innan vi kommer till det, var går den andra elektronen? Från heme BL överförs den andra elektronen till ett annat järnporfyrinkomplex, heme BH. Det är mot botten av bilden, så den här elektronen skickas faktiskt tillbaka mot matrisen. Väntar vid heme BL finns det dock en annan ubiquinon, UQ. Det väntar på elektronen. Det kommer faktiskt att vänta på två, sedan lämna sin brygga och gå tillbaka till ubiquinol (UQH2) bindningsstället för att leverera elektronerna igen.
varför bry sig? Varför inte bara skicka elektronerna på väg ordentligt första gången? Det verkar som om de återvinns av någon anledning. Man tror att denna avledning möjliggör att ytterligare protoner pumpas över mitokondriemembranet. När den andra ubiquinonen reduceras till ubiquinol via acceptansen av två elektroner, plockar den också upp ytterligare två protoner från matrisen nedan. Dessa protoner kommer så småningom att gå vidare mot intermembranutrymmet när ubiquinol oxideras igen. Denna återvinning, och klämma ut ett par extra protoner för att öka protongradienten, kallas Q-slingan.
fördelen med Q-slingan förklaras i följande diagram. I diagrammet visas ingångar till komplex III i rött, utgångar visas i blått och återvunna element är i grönt. Om en ubiquinol helt enkelt levererade sina elektroner och protoner och gjordes, skulle det finnas två protoner levererade per ubiquinol. Det är en protonutgång per elektron som var inmatad.
en andra ubiquinol skulle göra exakt samma sak. Det skulle finnas fyra protoner utgång för fyra elektroner initialt ingång. Det är fortfarande en protonutgång per elektron som var inmatad.
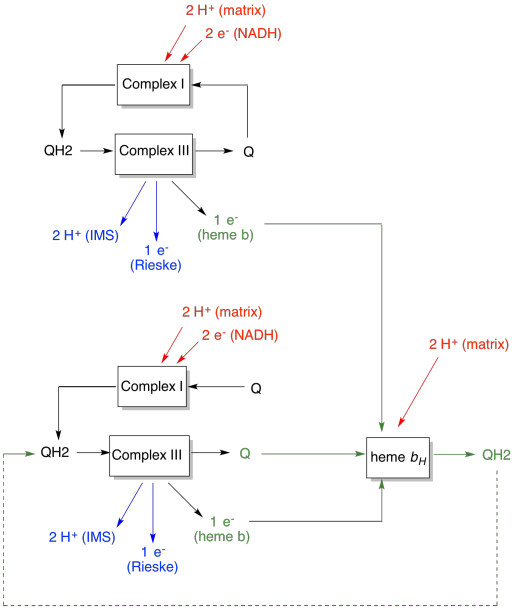
om istället en elektron återvinns varje gång, leder varje sekund ubiquinol till leverans av ett extra par protoner. Det beror på att vid upptagning av de återvunna elektronerna har en ubiquinon varit tvungen att resa tillbaka till membranets matrissida och plocka upp ytterligare två protoner. Sammantaget betyder det att sex protoner levereras för fyra elektroner ingång, eller 1,5 protoner utgång per elektroningång. Eftersom protongradienten är det som genererar ATP, ökar effektiviteten genom att öka antalet protoner som pumpas per elektron som kommer in.
- Q-slingan ökar antalet protoner som pumpas per elektroningång i systemet.
låt oss nu komma tillbaka till den utgående elektronbäraren, cytokrom c, som kommer att färja elektronerna till komplex IV. På bilden nedan, från en annan Röntgenkristallstruktur, har komplexet hittats med en cyktokrom C-dockning vid bindningsstället. Cytokrom c är ett rosa globulärt protein fäst längst upp på bilden, på den vänstra halvan av dimeren när vi tittar på den här. Det sitter vid kanten av intermembranutrymmet, vilket är vattenhaltiga medier. Till skillnad från ubikinon, som glider längs genom lipid dubbelskiktet av membranet, cytokrom C rullar eller glider eller simmar över toppen till sin destination.
samma vy visas nedan utan proteinet. Den nedre delen av bilden är ganska rörig med lipider, och det finns ett socker som hänger runt uppe till vänster, men högst upp kan du se järnporfyrin som ligger inbäddat inuti cytokrom c.
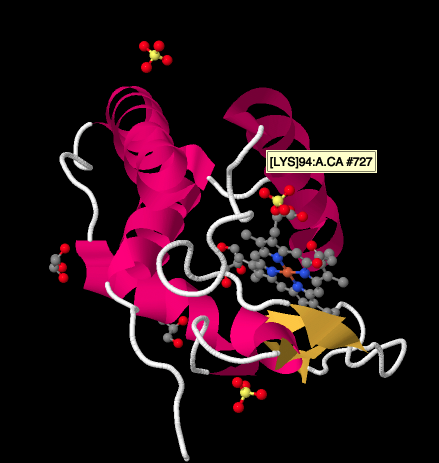
en närmare titt på en Röntgenstruktur av en cyktokrom c, nedan, visar en relativt enkel bild jämfört med de komplex vi har tittat på. Det finns ett par spiraler, ett par lakan, några öglor och det järnporfyrin eller hem igen. Några sulfatjoner flyter runt i närheten, liksom ett par glycerolmolekyler, som förmodligen införs under rening eller kristallisering av proteinet. Observera att hemmet finns vid kanten av proteinet. Den platsen kan göra det lättare för elektronöverföring från komplex III eller till komplex IV.
- cytokrom c är slutdestinationen för elektroner som rör sig genom komplex III.
- cytokrom c är en mobil, enelektronbärare.
- cytokrom c är faktiskt ett litet hydrofilt protein.
- cytokrom c finns ovanför mitokondriemembranet, vid kanten av intermembranutrymmet.
Vad hindrar cyctochrome c från att vandra ut i intermembranutrymmet? Om det gjorde det skulle det avbryta det effektiva flödet av elektroner. Det är möjligt att cytokrom c rör sig fram och tillbaka mellan komplex III och komplex IV via en mekanism som kallas “styrning”. Vid styrning styrs bäraren längs en väg via kompletterande laddningar. Till exempel, om membranet är negativt laddat på grund av polära grupper på membranytan, kan positiva laddningar på ytan av cytokrom c begränsa dess rörelse till membranytan. Det ensamma skulle minska dess rörlighet från tre dimensioner (var som helst i intermembranutrymmet) till två dimensioner (var som helst på membranytan). Det är möjligt att ytterligare interaktioner minskar dess rörlighet ytterligare till ett endimensionellt spår mellan de två komplexen.
- styrning, baserad på kompletterande laddningar, hindrar cytokrom c från att gå vilse i intermembranutrymmet.
övning \(\PageIndex{1}\)
föreslå möjliga aminosyrarester vid ytan av cytokrom c som kan hjälpa den att stanna på en negativt laddad membranyta.
svar
arginin och lysin är positivt laddade vid neutralt pH.
övning \(\PageIndex{2}\)
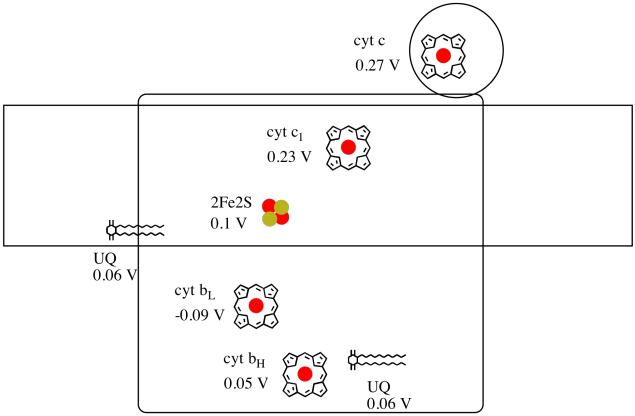
det är svårt att mäta reduktionspotentialen hos en enskild plats i ett protein. Forskare har dock kunnat uppskatta dessa värden genom att mäta EPR-spektra under olika förhållanden. Förutsatt reduktionspotentialerna nedan, rita ett reaktionsförloppsschema för transport av en elektron hela vägen från den initiala ubikinondonatorn hela vägen till cytokrom c.
 svar
svar
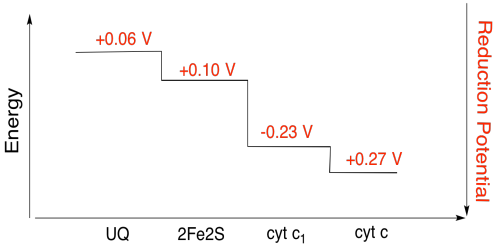
övning \(\PageIndex{3}\)
beräkna energiförändringen med hjälp av värdena i figuren ovan när en elektron överförs från 2fe2s-klustret till cytokrom c1.
Svar
Förutsatt att minskningen potential är:
2Fe2S(ox) + e- → 2Fe2S(red) Eored = 0.10 V
cyt c1(ox) + e- → cyt c1(red) Eored = 0.230 V
Sedan den potentiella skillnaden för reaktionen, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faradays förhållande ΔG = – n F ΔEo ger
ΔG = – 1 x 96,485 J-V-1 mol-1 x 0.13 V = 12,543 J mol-1 = 12.5 kJ mol-1
övning \(\PageIndex{4}\)
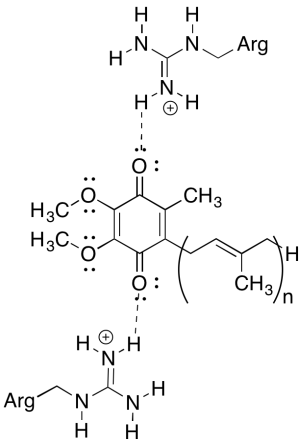
en av de förvirrande sakerna om detta komplex är att elektronåtervinningsslingan verkar elektronöverföring gå från en initial ubiquinon till en slutlig ubiquinon, utan någon övergripande drivkraft. Reduktionspotentialer är dock mycket känsliga för miljön. Visa hur närliggande argininrester kan göra reduktionspotentialen för en ubiquinon mer positiv.
svar
de positiva argininresterna skulle ge partiell positiv laddning på ubikinon via vätebindning; ubiquinonen skulle ha en mer positiv reduktionspotential som ett resultat.
se fokussidan på strukturen för komplex III på Biochemistry Online.
röntgenkristallstruktur av komplex III från: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. strukturell grund för kinonreduktionen i BC1-komplexet: en jämförande analys av kristallstrukturer av mitokondriell cytokrom bc1 med bundet substrat och hämmare vid Qi-platsen. Biokemi 2003, 4, 9067-9080. (1ntz)
RÖNTGENKRISTALLSTRUKTUR av komplex III med bunden cytokrom c från: Solmaz, Sr, Hunte, C. struktur av komplex III med bunden cytokrom c i reducerat tillstånd och definition av ett minimalt kärngränssnitt för elektronöverföring. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
RÖNTGENKRISTALLSTRUKTUR av cytokrom c från: Enguita, fj, Pohl, E., Turner, dl, Santos, H., Carrondo, ma strukturella bevis för en protonöverföringsväg i kombination med hemreduktion av cytokrom c” från Methylophilus metylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
erkännande
Chris p Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)