7.5: komplex IV
komplex IV är slutdestinationen i elektrontransportkedjan. Här levereras elektronerna som har färdats genom de andra medlemmarna i respiratorisk superkomplex slutligen till O2, vilket reducerar det till vatten. Det är en imponerande prestation, eftersom ett antal reaktiva syrearter måste bildas mellan den initiala tillsatsen av en elektron och den slutliga frisättningen av vatten, men reaktionen styrs på ett sådant sätt att möjligheten till cellskada minimeras. Samtidigt pumpas fler protoner över det inre mitokondriella membranet.
- i komplex IV levereras elektroner till sin slutdestination, en molekyl av O2.
- O2 reduceras till vatten.
övning \(\PageIndex{1}\)
Skriv en balanserad redoxhalvreaktion för att visa hur många elektroner som behövs för att minska en syremolekyl till vatten.
svar
O2 oc H2o
O2 oc 2 H2o (o balanserad)
O2 + 4H+ OC 2 H2o (h balanserad)
O2 + 4e- + 4H+ OC 2 H2O (laddning balanserad)
Röntgenstrukturen för komplex IV visas nedan. Återigen är matrisen i nedre änden av bilden och intermembranutrymmet är högst upp. Det är där cytokrom c dockar, högst upp.
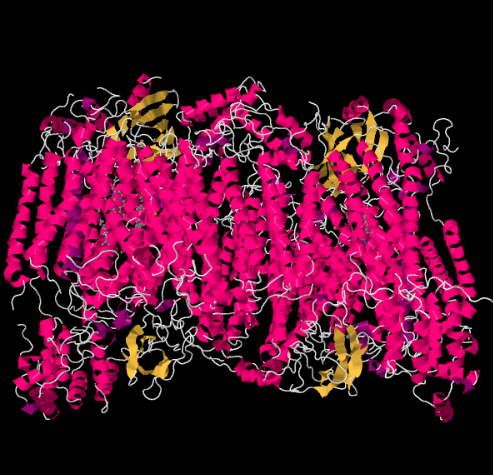
den mobila elektronbäraren, cytokrom c, binder vid komplex IV och levererar en elektron till en binukleär kopparplats som kallas CuA. Vi kan se den binukleära kopparplatsen när vi tittar inuti proteinet nedan. Det är bundet bara till proteinet och inget annat, så vi ser bara de två kopparjonerna på egen hand högst upp på bilden. Detta par kopparatomer skickar elektronen vidare till en heme, cytokrom a, som du kan se nedan och till vänster. Därifrån fortsätter elektronen till ett annat binukleärt kluster, den här gången bestående av ett hembundet järn (cytokrom a3) och en närliggande koppar (CuB). Denna binukleära plats utför reduktionen av dioxygen till vatten. I strukturen finns en kolmonoxidmolekyl bunden i det aktiva stället mellan cytokrom a3 och CuB. Kolatomerna är fästa vid järnet och syret är fäst vid koppar. Det är där syremolekylen skulle binda och vänta på att reduceras till vatten.
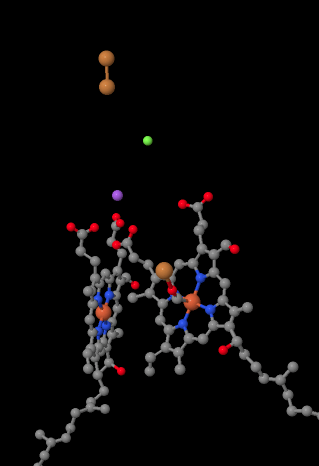
om du tänker på det betyder det att elektroner reser i motsatt riktning från vad vi såg i de tre första komplexen. I komplexen i och II levererades elektroner från mitokondriell matris och reste upp mot intermembranutrymmet och stannade vid en ubikinon i mitokondriemembranet. I komplex III fortsatte elektroner i den” uppåt ” riktningen, från mitokondriemembranet till cytokrom c i intermembranutrymmet. I komplex IV vänder elektroner kursen och reser tillbaka mot mitokondriell matris. Kom ihåg att den mitokondriella matrisen är n-dopad på grund av protonpumpning, så dessa elektroner reser från den positiva sidan av membranet till den negativa sidan. Det måste vara svårt.
- i komplex IV är elektrontransporten i motsatt riktning från de andra komplexen.
- elektroner reser från intermembranutrymmet till mitokondriell matrissida, mot laddningsgradienten.
Låt oss ta en titt på de viktiga liganderna för komplexet. En tecknad film visas nedan. I tecknad film visas O2-molekylen bindande i den positionen mellan heme a3 och ungen. Det där dinukleära metallstället är där syremolekylen reduceras till vatten.
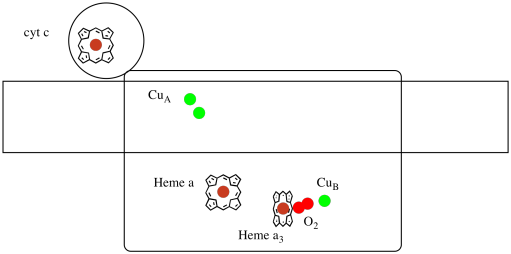
eftersom fyra elektroner behövs för att minska O2 till H2O måste fyra cytokrom C-molekyler binda vid komplex IV innan reduktionen kan fortsätta. Det är troligt att koordinationsmiljön för syremolekylen-mellan två metaller, snarare än bara bunden till en-gör att den kan reduceras snabbare hela vägen till vatten snarare än att bilda reaktiva syrearter som kvarstår i cellen, såsom peroxider.
övning \(\Sidaindex{2}\)
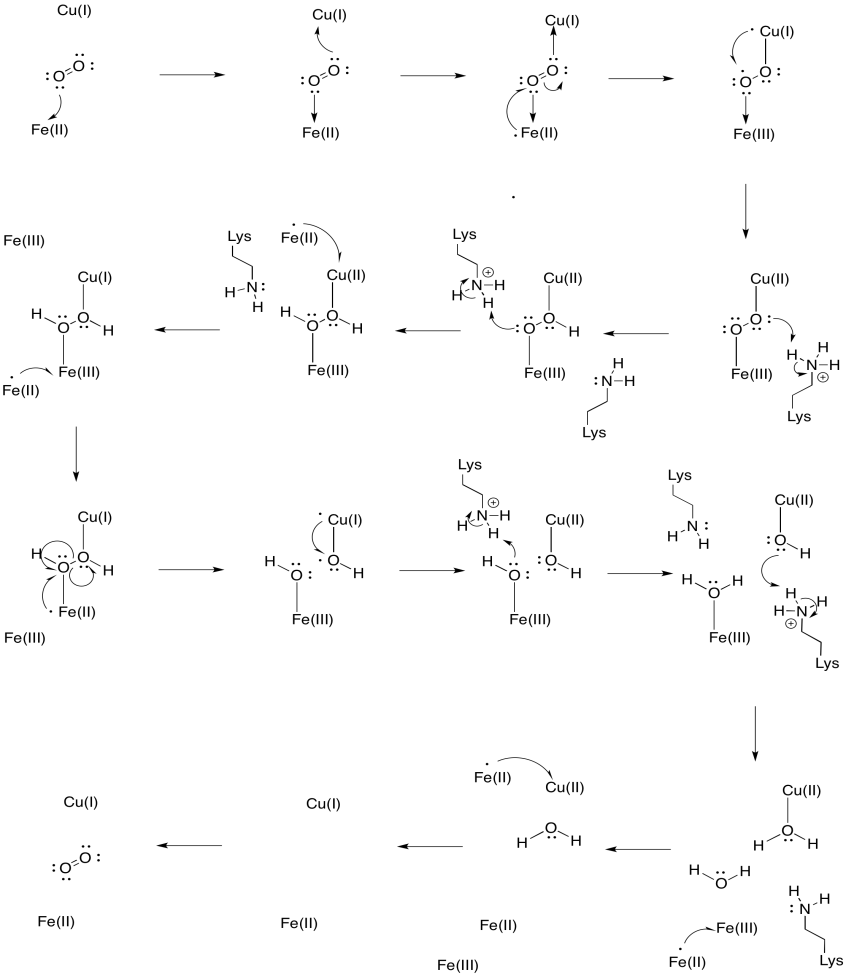
Antag att järnet i heme a3 börjar i ett reducerat Fe (II) tillstånd och ungen börjar i ett reducerat Cu(i) tillstånd. Ge en mekanism för reduktion av syre till vatten, med tillsats av fyra elektroner och fyra protoner. Använd Fe (II) som elektrondonator och lysin som protondonator.
svar
förutom dessa två metaller finns det också ett modifierat histidin-tyrosinkonjugat bundet till CuB. Det har föreslagits att denna tyrosin ger en annan källa till omedelbara elektroner som kan användas i reduktion.
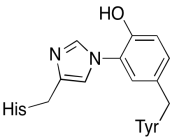
övning \(\PageIndex{3}\)
visa varför en tyrosin kan vara en källa till både en proton och en elektron i biokemiska processer.
svar
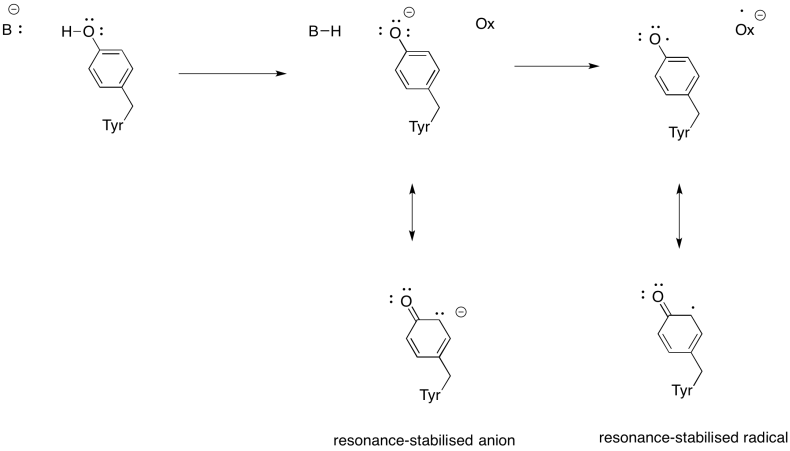
Förutom behovet av att minska syre till vatten bidrar komplex IV också till protongradienten och pumpar ytterligare protoner över mitokondriemembranet. Den uppgiften ger ytterligare utmaningar. En enkel kopplingsmekanism är inte möjlig, eftersom elektronerna rör sig i motsatt riktning. Det är dock att mekanismen involverar konformationsförändringar i proteinet som uppstår när metallerna förändrar oxidationstillstånd. Subtila förändringar i koordinationsmiljön kan leda till förskjutning av aminosyrarester i närheten. Det är lätt att föreställa sig att om en viss aminosyra skiftar uppåt mot intermembranutrymmet, kan det dra en proton med den.
- Protonpumpning och elektrontransport körs i motsatta riktningar i komplex IV och måste kopplas ur.
- Protonpumpning i komplex IV måste förlita sig på konformationsförändringar.
övning \(\PageIndex{4}\)
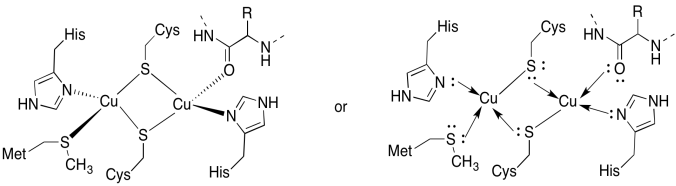
CuA-webbplatsen innehåller två koppar, Bound av två överbryggande cysteiner. Båda är bundna av terminala histidiner. Dessutom är en koppar bunden av en ytterligare metionin, medan den andra är bunden av en karbonyl från proteinryggraden.
- Rita kopparna i deras bindningsställen.
- beskriv geometrin för varje koppar.
- om varje koppar är Cu (I), vad är det samordnade elektronräkningen på varje koppar i komplexet?
- om varje koppar är Cu (I), vad är den totala laddningen på komplexet?
svar a)
a)
svar b)
b) tetraedrisk
svar c)
c) Cu(i) = d10
4 givare = 8 e –
totalt = 18E –
svar d)
d) 2 x Cu (I) = 2+
2 x Cys-S- = 2-
alla andra neutrala
totalt = 0
övning \(\PageIndex{5}\)
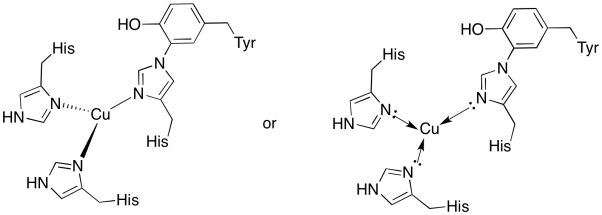
kopparet på Kubplatsen är bunden av två histidiner och histidin-tyrosinkonjugatet.
- Rita koppar i bindningsstället.
- beskriv kopparets geometri.
- om koppar är Cu (i), vad är det samordnade elektronantalet i komplexet?
- om koppar är Cu (I), vad är den totala laddningen på komplexet?
svar a)
a)
svar b)
b) trigonal plan
svar c)
c) Cu(i) = d10
3 givare = 6 e –
totalt = 16 e-
svar d)
d) Cu (I) = 1+
histidines neutral
totalt = 1+
övning \(\PageIndex{6}\)
det är svårt att mäta reduktionspotentialen hos en enskild plats i ett protein. Forskare har dock kunnat uppskatta dessa värden genom att mäta EPR-spektra under olika förhållanden. Om man antar reduktionspotentialerna nedan, rita ett reaktionsförloppsschema för transport av en elektron hela vägen från cytokrom c till molekylärt syre.
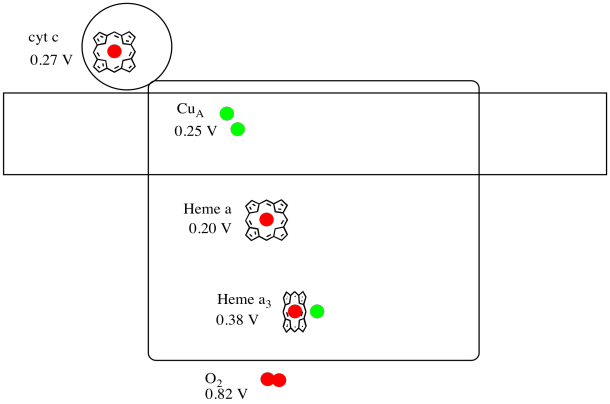 svar
svar
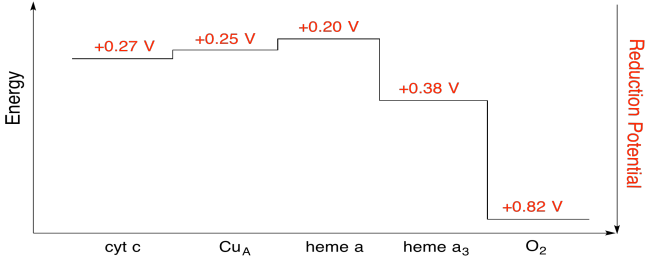
övning \(\PageIndex{7}\)
beräkna energiförändringen med hjälp av värdena i figuren ovan när en elektron överförs från heme a till heme a3.
svar
förutsatt att reduktionspotentialerna är:
heme a (Oxe) + e-Aci-heme a (röd) Eored = 0,20 V
heme a3(Oxe) + e – Aci-heme a3(röd) Eored = 0.38 V
sedan potentialskillnaden för reaktionen, Ubiseo = 0,38 – (0,20) V = 0,18 V.
Faraday-förhållandet UBISEO = – n f Ubiseo ger
UBISEO = – 1 x 96,485 J V-1 mol – 1 x 0,13 V = 17,367 J mol – 1 = 17,4 kJ mol-1
erkännande
Chris p Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)