Citrat antikoagulation under CRRT för akut njurskada
- akut njurskada
- hantering av AKI – njurersättningsterapier för AKI
- hemodialys, hemofiltrering och hemodiafiltrering
- initiering och tidpunkt för RRT för AKI – intermittent kontra kontinuerlig RRT
- antikoagulation under kontinuerlig njurersättningsterapi (CRRT)
- Citrat-mekanismen för dess antikoagulerande verkan och dess tillämpning i CRRT
- potentiella metaboliska störningar under citrat-antikoagulerad CRRT
- biokemisk övervakning av patienter som får citrat-antikoagulerad CRRT
akut njurskada
akut njurskada (AKI), ett kliniskt syndrom med många möjliga orsaker, definieras helt enkelt som en plötslig minskning av njurfunktionen under en period av timmar eller dagar, vilket framgår av den senaste tidens ökning av serumkreatininkoncentration och/eller minskning av urinproduktionen .
det skiljer sig från kronisk njursjukdom (CKD) där minskningen av njurfunktionen är långsamt men irreversibelt progressiv och uppträder under en period av månader och år. AKI kan naturligtvis förekomma hos dem med underliggande CKD, och en diagnos av AKI är förknippad med större än normal risk för en eventuell diagnos av CKD .
internationellt överenskomna riktlinjer anger att en diagnos av AKI kan ställas om:
• serumkreatinin ökar med 0, 3 mg/dL i 0, 3 mg/dL (26, 5 mg / dL) inom 48 timmar; eller
• det har skett en 50% eller större ökning av serumkreatinin under de senaste 7 dagarna; eller
• urinvolymen är
AKI omfattar hela spektrumet av svårighetsgrad från en mild minskning av njurfunktionen (steg 1 AKI) till njursvikt (steg 3 Aki). Iscensättning beror på serumkreatininmätning, med eller utan urinutgångsdata (tabell I)
|
scen |
serumkreatinin |
urinproduktion |
|
1 |
1.5-1.9 gånger utgångsvärdet |
för 6-12 timmar |
|
2 |
2.0-2.9 gånger baslinjen |
⩾ 12 timmar |
|
3 |
3.0 gånger utgångsvärdet |
för 24 timmar |
tabell i: de tre stadierna av AKI-svårighetsgrad (från ref 1)
orsakerna till AKI klassificeras konventionellt under tre rubriker: prerenal; renal (inneboende); och postrenal, betonar det faktum att AKI kan ha en specifik njuretiologi men kan också bero på primärt problem utanför njurarna.
alla tillstånd som har effekten att minska blodflödet till njurarna (renal perfusion) är en potentiell orsak till prerenal AKI; dessa tillstånd inkluderar: hypovolemi på grund av kräkningar, diarre, blödning, brännskador eller septisk chock; och minskad hjärtproduktion på grund av till exempel hjärtsvikt och leversvikt (cirros). Den främsta orsaken till inneboende AKI är renal tubulär nekros, som härrör från njurischemi eller intag av nefrotoxiska läkemedel/toxiner.
Sepsis, den vanligaste orsaken till AKI hos kritiskt sjuka, beror delvis på dåligt definierad inneboende njurskada som liknar renal tubulär nekros . Slutligen är postrenal AKI resultatet av något tillstånd som hindrar urinflödet distalt till njurarna; dessa inkluderar: njurstenar (calculi); prostata sjukdom (tumör/hypertrofi); blåsdysfunktion; och urinrörssträngning.
hantering av AKI – njurersättningsterapier för AKI
det finns ingen specifik behandling för AKI och hanteringen är till stor del stödjande med behandling riktad mot den bakomliggande orsaken. Återkallande av nefrotoxiska läkemedel, vätskeåterupplivning och korrigering av elektrolyt-och syrabasstörning är alla en del av denna allmänna stödjande hantering . Administrering av vasopressor eller inotropa läkemedel för att återställa normalt blodtryck och hjärtutgång kan vara nödvändigt.
Renal replacement therapy (RRT), fokus för denna artikel, representerar den sista utvägsbehandlingen för patienter med svår AKI som inte svarar på konservativ stödjande hantering. Cirka 23% av ICU-patienter med AKI (dvs. cirka 13% av alla ICU-patienter) får RRT .
Renal replacement therapy (RRT) är den generiska termen för alla behandlingar som försöker ersätta njurfunktionen. Transplantation av donator njure till dem med slutstadiet njursjukdom kan betraktas som den ultimata RRT, men termen är oftare reserverad för de terapier som ersätter blodfiltrering och homeostatiska funktioner i njuren genom dialys, en process som använder ett halvgenomsläppligt membran som blodfiltret. Två breda typer av dialytisk RRT är tillgängliga för behandling av AKI (och för den delen slutstadiet CKD): peritonealdialys och hemodialys.
däremot innebär hemodialys filtrering av blod i en maskin utanför kroppen (extrakorporeal). Blod pumpas till filtret/dialysatorn, där avfallsprodukter och överskott av vätska avlägsnas och sedan återförs till kroppen. Denna extrakorporeala krets (dialysmaskinen och dess anslutningsrör från och tillbaka till patienten) är en prokoagulerande miljö.
hemodialys, hemofiltrering och hemodiafiltrering
moderna dialysmaskiner har möjlighet till hemofiltrering (HF) såväl som hemodialys (HD), vilket möjliggör tre olika dialysmetoder för behandling av AKI: hemodialys (HD); hemofiltrering (HF); och hemodiafiltrering (HDF).
kärnan i alla tre modaliteterna är det halvgenomsläppliga membranet som utgör ett blodfilter. När blod som pumpas från patienten strömmar på ena sidan av detta membran passerar överskott av vatten och avfallslösningar över membranet. Filtratet eller utflödet pumpas till avfall när det filtrerade blodet återförs till patienten.
hemodialysprocessen (HD) innefattar användning av en dialysvätska som strömmar kontinuerligt och motströms till blod på andra sidan membranet. Sammansättningen och flödeshastigheten för dialysvätska säkerställer en konstant koncentrationsgradient över det halvgenomsläppliga membranet med avseende på blodlösliga ämnen. Dessa koncentrationsgradienter underlättar i sin tur kontrollerad diffusion av lösta molekyler över membranet.
för lösta ämnen som urea och kreatinin, som måste avlägsnas från blod, är koncentrationsgradienten sådan att diffusionsriktningen är från blod till dialysvätska, medan för lösta ämnen som bikarbonat, som ofta måste tillsättas blod för att korrigera acidosen i samband med svår AKI, säkerställer dialysvätska med hög bikarbonatkoncentration i förhållande till blod att diffusion är i motsatt riktning, från dialysvätska till blod. Justering av dialysvätskans sammansättning och flödeshastighet möjliggör således patientspecifik metabolisk korrigering.
Vätskeöverskott är ofta en egenskap hos AKI som korrigeras under hemodialys. Detta uppnås genom ultrafiltrering, vilket beror på den hydrostatiska tryckgradienten som finns över det halvgenomsläppliga membranet. Det relativa positiva hydrostatiska trycket på membranets blodsida “pressar” effektivt vatten från blod till dialysvätska.
denna ultrafiltrering underlättar också passage av lösta molekyler, som släpas med vatten under ultrafiltrering av en mekanism som kallas lösta konvektion (eller lösningsmedelsdrag). Den kombinerade effekten av löst diffusion, löst konvektion och ultrafiltrering under hemodialys syftar till att säkerställa att vätskevolym och sammansättning inom både extracellulärt och intracellulärt fack återställs, så nära som möjligt, till det som gäller bland dem med normalt fungerande njurar.
Hemodiafiltrering (HDF) är kombinationen av HF och HD. Det möjliggör optimal clearance av lösta ämnen med låg molekylvikt genom diffusion till dialysvätska, kombinerat med optimal clearance av lösta ämnen med hög molekylvikt genom konvektion och ultrafiltrering. Som med HF kräver HDF kontinuerlig ersättningsvätska; och som med HD kräver HDF dialysvätska.
initiering och tidpunkt för RRT för AKI – intermittent kontra kontinuerlig RRT
alla njurersättningsterapier (PD, HD, HF och HDF) kan levereras intermittent (dvs vanligtvis i 3-4 timmars sessioner) eller kontinuerligt tills njurfunktionen återställs. För patienter med njursvikt i slutstadiet, som behöver livslång (kronisk) RRT, är behandlingen uteslutande intermittent hemodialys (IHD), som nästan alltid levereras i fyra timmars sessioner, tre gånger i veckan .
patienter med AKI har endast ett tillfälligt krav på RRT för att stödja njurfunktionen under Upplösning av den kritiska/akuta sjukdomen som utfällde AKI. Den genomsnittliga varaktigheten av RRT bland patienter med AKI är cirka 13 dagar , även om det i vissa fall bara kan vara nödvändigt i några dagar eller förlängas i många veckor.
traditionella (absoluta) indikatorer för initiering av RRT i AKI inkluderar:
• hyperkalemi (plasmakalium > 6,0-6,5 mmol/L)
• svår uremi (plasmakreamid > 30 mmol/L)
• tecken på uremisk encefalopati
• acidos (pH • akut lungödem
det kan vara fördelaktigt att starta behandlingen innan dessa extrema effekter av AKI är uppenbara, men optimala timing för att initiera (och stoppa) RRT är för närvarande oklart och föremål för pågående forskning . Det finns för närvarande inga tillförlitliga data för att stödja en viss typ av RRT för AKI och följaktligen har alla typer av RRT använts.
nuvarande riktlinjer återspeglar emellertid enighet om att RRT, oavsett modalitet, ska levereras kontinuerligt snarare än intermittent till de mest kritiskt sjuka (hemodynamiskt instabila) patienterna. Nya undersökningar visar att idag används kontinuerliga njurersättningsterapier (CRRTs) mycket oftare än intermittenta terapier för AKI, och att den vanligaste CRRT är kontinuerlig venös venös hemofiltrering (CVVHF), följt av kontinuerlig venös venös hemodiafiltrering (CVVHDF).
antikoagulation under kontinuerlig njurersättningsterapi (CRRT)
CRRT, i likhet med alla andra njurersättningsterapier utom peritonealdialys, innefattar pumpning av blod genom en icke-fysiologisk, extrakorporeal krets. Den inneboende egenskapen hos blod att koagulera (koagulera) vid kontakt med icke-fysiologiska ytor bestämmer att för att upprätthålla en “koaguleringsfri” Patient extrakorporeal krets måste blod antikoaguleras.
CRRT har ett särskilt behov av antikoagulation, jämfört med intermittenta modaliteter, på grund av de långvariga behandlingssessionerna och den relativt långsamma hastigheten med vilken blod pumpas genom kretsen . Dessutom är blodet hos patienter som behöver CRRT ofta redan i ett relativt prokoagulerande tillstånd på grund av underliggande kritisk sjukdom (t .ex. sepsis) eller trauma.
under många år var heparin, antingen ofraktionerat heparin (UF) eller lågmolekylärt heparin (LMWH), det enda antikoagulant som användes vid dialytiska förfaranden, inklusive CRRT. Heparin fortsätter att användas; det är ett billigt och allmänt säkert medel för antikoagulation för majoriteten av patienter som behöver RRT.
systemisk heparinantikoagulation, som inte kan undvikas, medför emellertid oundvikligen en ökad risk för blödning, så att heparinantikoagulation under dialytiska procedurer är absolut kontraindicerad för dem som för närvarande blöder eller har högre risk för blödning än normalt.
dessutom kan heparin, i en liten minoritet (
de potentiella blödnings-och HIT-II-riskerna i samband med heparinanvändning, framhäva behovet av ett alternativt antikoagulant för vissa patienter som behöver RRT. Citrat gav ett sådant alternativ. Regional citratantikoagulation av dialyskretsen, som först användes framgångsrikt i början av 1980-talet , var ursprungligen reserverad för den lilla minoriteten av patienter för vilka heparin är kontraindicerat. Det förändrades med resultat av randomiserade kontrollerade studier som jämförde heparin-antikoagulated CRRT med citrate-antikoagulated CRRT; dessa visade att citrat är både en effektivare och säkrare antikoagulant än heparin .
citrat har följaktligen uppstått de senaste åren som det antikoagulerande valet för alla AKI-patienter som behöver CRRT . Intensivvårdsavdelningar runt om i världen rapporterar nu att de byter från heparin till regional citratantikoagulation för CRRT . Vissa myndigheter rekommenderar till och med användning av citrat snarare än heparinantikoagulation för intermittent (kronisk) hemodialys (IHD).
Citrat-mekanismen för dess antikoagulerande verkan och dess tillämpning i CRRT
citrat, som har använts för att antikoagulera/bevara donerat blod för transfusion i över ett sekel , förhindrar blod från att koagulera genom sin förmåga att binda (kelat) joniserat kalcium (Ica) som cirkulerar i blodplasma. Denna iCa är en nödvändig kofaktor för både trombocytaggregation och flera viktiga steg i de inneboende och yttre koagulationsvägarna som är ansvariga för fibrinproduktion och därmed fibrinkoagulationsbildning.
blodkoagulation förhindras genom minskning av ICA-plasmakoncentrationen till cirka 0,35 mmol/L (normalt ref-intervall 1,15-1,30 mmol/L). Detta icke-fysiologiska, allvarligt hypokalcemiska tillstånd uppnås genom att höja plasmacitratkoncentrationen till cirka 3 mmol/L (normal plasmacitratkoncentration ~0,1 mmol/L ).
även om det finns skillnader i detalj som beskrivs av Morabito et al, involverar alla protokoll för citratantikoagulation under CRRT kontinuerlig infusion av citratinnehållande lösning (vanligtvis antingen trinatriumcitrat eller syra-citrat-dextros (ACD) lösning) till förfiltret/dialyslinjen, nära där den lämnar patienten, antingen som en separat lösning eller i kombination med predilution ersättningsvätska. Flödeshastigheten för denna infusion justeras för att uppnå en blodcitratkoncentration på ~3 mmol/L och därmed en plasma-iCa på cirka 0,35 mmol/L.
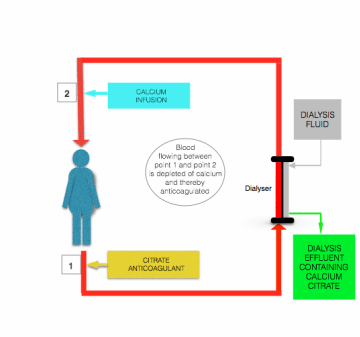
hypokalcemi som induceras av citratinfusion korrigeras innan blodet återgår till patienten genom infusion av kalciuminnehållande lösning (kalciumklorid eller kalciumglukonat) till postfilterlinjen nära där den kommer in i patienten (se figuren ovan).
den största säkerhetsfördelen med citratantikoagulation jämfört med heparinantikoagulation är att antikoagulation är begränsad till den extrakorporeala kretsen. Denna så kallade “regional antikoagulation” uppnås eftersom det mesta av det infunderade citratet avlägsnas (som antingen citratanjoner eller kalciumcitratkelat) från blod under passage genom filtret/dialysatorn .
eventuellt kvarvarande citrat i postfilterblod späds ut i systemisk cirkulation och metaboliseras snabbt till koldioxid och vatten genom den syreberoende Krebs-cykeln i mitokondrion i vävnadsceller (främst leverceller ).
Metabolism av citrat är associerad med produktion av bikarbonat: för varje 1 mmol citrat metaboliserad genereras 3 mmol bikarbonat. Den snabba clearance av citrat (halveringstiden för citrat i blod är normalt cirka 5 minuter ) via denna huvudsakligen leverväg säkerställer normalt frånvaron av systemisk antikoagulation under CRRT och därmed ingen ytterligare risk för blödning.
potentiella metaboliska störningar under citrat-antikoagulerad CRRT
den uppenbara motviljan att helt omfamna citrat-antikoagulerad CRRT för alla AKI-patienter tills nyligen har tillskrivits oro för syrabas-och elektrolytstörningar som kan uppstå hos patienter som får behandlingen .
följande elektrolyt-och syrabasstörningar har rapporterats hos patienter som får citrat-antikoagulation CRRT : • metabolisk alkalos
• metabolisk acidos
dessa störningar kan uppstå av ett antal skäl men ackumulering av citrat i perifer cirkulation (citrattoxicitet) kan vara central för de flesta av dessa störningar. Orsaker till att citrat kan ackumuleras under CRRT inkluderar:
• nedsatt metabolism av citrat på grund av leversjukdom och/eller minskad tillförsel av syre på grund av otillräcklig perfusion (t. ex. 9795>
• progressiv minskning av membranpatensen under dialys med följd minskad filtrering av citrat och samtidig ökning av citratleverans till systemisk cirkulation
oavsett av orsaken, ackumulering av citrat i perifer cirkulation kan resultera i citratkelation av cirkulerande joniserat kalcium, med därmed minskad plasmajoniserad kalciumkoncentration (hypokalcemi). Om tillräckligt allvarlig hypokalcemi kan orsaka hjärtarytmi och i slutändan hjärtstillestånd .
även om plasmajoniserat kalcium reduceras under citratackumulering (toxicitet), ökas totalt kalcium (vilket indikerar hyperkalcemi) eftersom kalcium bundet till citrat ingår i uppmätt totalt kalcium. En ökning av förhållandet mellan totalt och joniserat kalcium (normalt 2,0) till > 2.1 har visat sig vara den mest tillförlitliga signalen för citrattoxicitet i frånvaro av rutinmässigt tillgänglig plasmacitratberäkning .
risken för ökat plasmanatrium (hypernatremi) associerat med citratantikoagulation beror på den höga natriumhalten (hypertonicitet) hos vissa citratlösningar som används i CRRT. Till exempel innehåller 4% – lösningen av trinatriumcitrat som används i vissa protokoll natrium i en koncentration av 420 mmol/L. i praktiken kan användningen av hypotonisk dialys/ersättningsvätskor mildra denna risk och hypernatremi är för alla konton en sällsynt komplikation av citratkoagulation .
risken för hypomagnesi (reducerat serummagnesium) under citratantikoagulation återspeglar det faktum att magnesium, i likhet med kalcium, är en tvåvärd jon som också kan binda till (kelat) citrat. Om magnesiumförluster på grund av citratets keleringsverkan inte kompenseras fullt ut av magnesium i dialys/ersättningsvätskor kan hypomagnesi uppstå .
biokemisk övervakning av patienter som får citrat-antikoagulerad CRRT
Point-of-care-testning med hjälp av en blodgasanalysator placerad inom intensivvården möjliggör snabb och bekväm mätning av de flesta parametrar (joniserat kalcium, pH, bikarbonat, basöverskott, natrium och laktat) men serum total kalcium-och magnesiumuppskattning är vanligtvis inte tillgängliga på dessa plattformar och prover måste skickas till laboratoriet för dessa mätningar.
två nya studier ger bevis för att vissa blodgasanalysatorer kanske inte är tillförlitliga vid mätning av joniserat kalcium vid extremt låga, icke-fysiologiska koncentrationer (~0.3 mmol / L) närvarande i postfilterblod, även om deras förmåga att noggrant mäta plasmajoniserat kalcium i systemisk cirkulation (där koncentrationen är mycket högre) inte är i tvivel.
|
Parameter uppmätt |
övervakningsintervall |
målvärden eller ca. referensområden |
syftet med mätningen |
korrigerande åtgärder om utanför målet |
|
postfilter joniserad kalcium (iCa) koncentration, dvs blod samplas från postfilter port. |
inom 1 timme efter start och efter någon citratdosändring, sedan var 4-6 timmar |
0.25-0.35 mmol / L |
|
justering av citratdosen: öka om ICA > 0,35, minska om ICA |
|
systemiskt joniserat kalcium (Ica), dvs blodprov från patienten |
baslinje (före start), sedan 1 timme efter start, sedan minst var 4-6 timmar |
1.15-1.30 mmol / L |
|
justering av kalciuminfusionshastigheten; öka om iCa 1.30 |
|
systemisk Total kalcium (TotCa), dvs. blodprov från patienten (TotCa = ICA + kalcium bundet till albumin + kalcium bundet till citrat) |
minst var 12-24 timmar (måste vara samtidigt med systemisk joniserad kalciumuppskattning) |
krävs endast för bestämning av totCa:ICA-förhållande (se nedan) |
||
|
förhållande totalt till joniserat kalcium (TotCa:iCa) |
minst var 12-24 timmar |
att upptäcka citratackumulering / toxicitet som ibland kallas “citratlås” |
alternativen inkluderar:
|
|
|
arteriell blodgasanalys
|
baslinje (före start). inom 1 timme efter start, sedan minst var 4-6 timmar. |
pH 7,35-7,45 bikarb 23-28 mmol / l BE–2-+3 mmol / L |
för att upptäcka syrabasstörningar: metabolisk alkalos metabolisk acidos |
alternativ Vid metabolisk alkalos inkluderar:
|
|
Serumnatrium |
en gång dagligen |
135-145 mmol / L |
att upptäcka hypernatremi / hyponatremi |
sällsynt förekomst-verifiera korrekt dialys / ersättningsvätska |
|
Serumlaktat |
baslinje (före start), sedan enligt kliniska behov |
för att hjälpa till att identifiera de som riskerar citrattoxicitet |
Tänk på, tillsammans med TotCa:ICA-förhållande, risk för citrattoxicitet |
|
|
Serummagnesium |
minst en gång dagligen |
för att upptäcka hypomagnesi |
korrigering med magnesiuminfusion |
tabell II: biokemisk övervakning under citrat-antikoagulation CRRT (Ref 24)