Clostridium acetobutylicum
A Microbial Biorealm page on the genus Clostridium acetobutylicum
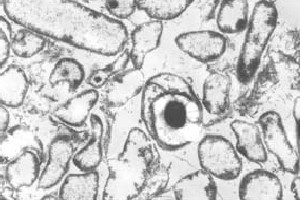
Classification
Higher order taxa
Bacteria (Domain); Firmicutes (Phylum); Clostridia (Class); Clostridiales (Order); Clostridiaceae (Family); Clostridium (Genus)
arter
Clostridium acetobutylicum
Clostridium acetobutylicum ATCC 824 anses vara typstammen.
NCBI: taxonomi
beskrivning och betydelse
Clostridium acetobutylicum är en Gram-positiv bacillus (1). C. acetobutylicum är oftast jordbostad, även om det har hittats i ett antal olika miljöer. Det är mesofilt med optimala temperaturer på 10-65 kcal C. Dessutom är organismen sackarolytisk (kan bryta ner socker) (1) och kan producera ett antal olika kommersiellt användbara produkter; framför allt aceton, etanol och butanol (2).
C. acetobutylicum kräver anaeroba förhållanden för att växa i sitt vegetativa tillstånd. I sina vegetativa tillstånd är det rörligt via flagella över hela ytan. Det kan bara överleva upp till flera timmar under aeroba förhållanden, där det kommer att bilda endosporer som kan pågå i flera år även under aeroba förhållanden. Först när dessa sporer är i gynnsamma anaeroba förhållanden kommer vegetativ tillväxt att fortsätta (1).
det isolerades först mellan 1912 och 1914 (2). Chaim Weizmann odlade bakterierna för att producera aceton, etanol och butanol i en process som kallas ABE-metoden. Således är det passande att C. acetobutylicum ofta kallas ” Weizmann-organismen.”Produkterna användes sedan vid produktion av TNT och krut under första världskriget (3). Efter WWI användes ABE-processen i stor utsträckning fram till 1950-talet då petrokemiska processer blev mer kostnadseffektiva på grund av kostnaden och tillgängligheten av petroleumbränslekällor. Den senaste fossila bränslekrisen har stimulerat mer forskning om C. acetobutylicum och utnyttjandet av ABE-processen (2).
förutom att vara en viktig bakterie för industriellt bruk studeras C. acetobutylicum som modell för endosporbildning i bakterier. Det har jämförts med de mest studerade endospore-bakterierna, Bacillus subtilis (2). Att förstå vägarna för endosporbildning är viktigt eftersom många endosporbildande bakterier är mänskliga patogener, i både Bacillus-och Clostridium-släkten.
den vanligaste studerade stammen är typstammen, ATCC 824. Denna stam upptäcktes och isolerades i jord från en Connecticut-Trädgård 1924. Forskning har visat att den allmänt studerade ATCC 824 är nära relaterad till Weizmann-stammen som används i den tidiga industriella produktionen av aceton (2).
Genomstruktur
genomet av Clostridium acetobutylicum ATCC 824 har sekvenserats med hjälp av hagelgevärsmetoden. Detta är modellstammen för lösningsmedelsproducerande bakterier. Genomet består av en cirkulär kromosom och en cirkulär plasmid. Kromosomen innehåller 3 940 880 baspar. Det finns liten strängförspänning med cirka 51,5% av generna transkriberas från framåtsträngen och 49,5% från den komplementära strängen (2).
noterade gener som är gemensamma för bakterier inkluderar de 11 operonerna som kodar för ribosomer. Det är intressant att var och en av dessa operoner är nära oriC (replikeringens ursprung) och orienterad i riktning mot den främre strängen av replikeringsgaffeln. (2). Detta är en egenskap som vanligen observeras känd som gendosering, i vilken mycket transkriberade gener placeras nära oriC. På grund av orienteringen av dessa gener kommer de att transkriberas i större antal medan DNA håller på att replikeras och det finns ytterligare kopior av genen närvarande i cellen.
dessutom innehåller genomet en stor plasmid (kallad megaplasmid). Denna plasmid verkar innehålla nästan alla gener som är involverade i lösningsmedelsproduktion och heter lämpligt psol1. pSOL1 innehåller 192 000 baspar och koder för 178 polypeptider. Undersökning av plasmid indikerar ingen förspänning i vilken sträng är den kodande strängen (2).
när Clostridium acetobutylicum odlas i kontinuerlig odling eller genomgår många överföringar, degenererar stammen långsamt genom att den förlorar sin förmåga att producera lösningsmedel. Experiment för att bestämma vad som orsakar degeneration har visat att pSOL1 innehåller fyra gener som är avgörande för alkohol-och acetonproduktion. Under många överföringar eller fortsatt vegetativ tillväxt förloras denna plasmid. Ytterligare bevis för förlusten av denna plasmid som leder till stamdegeneration är att mutanter som saknar dessa gener och inte kan producera lösningsmedel återupptar aceton och alkoholproduktion vid komplementering av generna via plasmider (4).
andra, mindre studerade stammar av C. acetobutylicum såsom ATCC 4259 har visat liknande degeneration. Plasmid i denna stam heter pWEIZ. Återigen tros degeneration på grund av seriell odling av denna stam uppstå på grund av eventuell förlust pWEIZ. Denna stam är värt att notera eftersom, intressant, dessa degenererade stammar inte sporulerar. Detta har sporrat tanken att gener som är involverade i sporulation också existerar på plasmid i både ATCC 4259 såväl som typstammen, ATCC 824 (4, 2).
energimetabolism och biprodukter
Clostridium acetobutylicum är en kemoorganotrof. Det erhåller energi via substratfosforylering genom jäsning. Som med all jäsning är substratet organiska molekyler som fungerar som elektrondonator och acceptor. Det följer att det är heterotrofiskt med sin kolkälla som kommer från organiska molekyler. I synnerhet kräver C. acetobutylicum en kolhydratkälla som kan genomgå jäsning för att överleva (1).
dessutom är C. acetobutylicum en obligatorisk anaerob. Det kan bara överleva timmar i en aerob miljö innan den genomgår sporulation som ett sätt att överleva under mycket längre perioder i den aeroba miljön. Det visar ingen aktivitet av katalas, ett enzym som är viktigt för aeroba organismer för att omvandla en giftig biprodukt av syremetabolism, väteperoxid, till vatten och syre (5). Det innehåller emellertid många enzymer som gör det möjligt att överleva i mikrooxiska miljöer, såsom superoxiddismutas. Dessa enzymer uppregleras i närvaro av syre och bidrar till kortvarig cellöverlevnad i mikrooxiska miljöer (6).
C. acetobutylicum kan använda ett antal olika fermenterbara kolhydrater som en energi, såväl som kol, källa. Genomet kodar för proteiner som hjälper till vid nedbrytning av xylan, levan, pektin, stärkelse och andra polysackarider (2). Intressant, medan gener som vanligtvis kodar för cellusomer, proteinkomplex som bryter ner kristallin cellulosa, är närvarande, kan organismen inte växa enbart på cellulosasubstrat (7).
betydande forskning har investerats i metaboliska vägar av Clostridium acetobutylicum för att förbättra industriell jäsning. De metaboliska vägar som producerar industriella användbara lösningsmedel är mest anmärkningsvärda i C. acetobutylicum. Lösningsmedlen aceton, acetat, butanol, butyrat och etanol härrör alla från den vanliga föregångaren, acetyl-CoA (2). Utöver dessa produkter produceras CO2 och H2 (1).
en annan anmärkningsvärd metabolisk väg är att vissa clostridier (inklusive C. acetobutylicum) kan “fixera” atmosfäriskt kväve. Processen med kvävefixering reducerar atmosfärisk N2 till ammoniak som sedan införlivas i molekyler via biosyntes. Detta bestämdes med användning av en märkt form av kväve, 15N2. Efter sekvensering, C. acetobutylicum ATCC 824, en serie gener som mycket liknar kvävefixeringsgenerna i C. pasteurianum hittades, vilket ytterligare bekräftade bakteriens förmåga att utnyttja atmosfäriskt kväve (8).
cellstruktur och utveckling
under tidig cellutveckling fläckar C. acetobutylicum Gram-positivt, men det kan fläcka Gram-negativt när kulturen åldras. Under vegetativ tillväxt har cellen peritrich flagella (flagella som täcker hela ytan av cellen) (1). Ökad rörlighet hos bakterierna har varit inblandad i ökad lösningsmedelsproduktion på grund av kemotaxi. Attraktiva medel inkluderar smörsyra och socker. Anmärkningsvärda repellenter inkluderar aceton, butanol och etanol. Denna mekanism är logisk för att låta cellen hitta näringsämnen och flytta sig bort från biprodukter som produceras av sin egen metabolism (9).
dessutom produceras olika biprodukter vid olika tillväxtfaser i C. acetobutylicum. Under exponentiell tillväxtfas är primära produkter acetat och butyrat. Under denna tid sker även kvävefixering (8). Någon gång efter att cellen går in i stationär fas (18 timmar), produktionen av butanol och aceton topp (1). Denna temporära separation av kvävefixering och produktion av lösningsmedel är fördelaktig för att undvika konkurrens om reduktionsmedel genom de två processerna (8).
huvudstadiet av cellutveckling kännetecknas av bildandet av en endospore. En endospore är den mest resistenta celltypen som är känd. Vid vissa Miljösignaler producerar den vegetativa cellen en subterminal septum (1), en händelse som kan ses med elektronmikroskopi . Denna septum blir så småningom en annan cell, kallad fore, uppslukad av den ursprungliga cellen, benämnd modercellen. Foresporen består av ett lager av cortex (främst peptidoglykan) och pälsproteiner. Dessa två mycket resistenta skikt omger kärnan, som är en mycket dehydrerad cytoplasma. Kärnan definieras av absolut ingen metabolism som förekommer i cellen. Modercellen lyses släppa den mogna Sports. Denna mogna spore är resistent mot hög temperatur, kemikalier och många typer av strålning som gör det möjligt att överleva i extraordinärt antal år. Vid andra Miljösignaler, såsom en anoxisk miljö, gror cellen och börjar den vegetativa cykeln igen (10).
sporbildning börjar när cellen utsätts för ogynnsamma förhållanden. Aeroba förhållanden, bildning av organiska biprodukter och spridning av protongradienten utanför det cytoplasmatiska membranet leder alla till sporulering. Detta står i kontrast till modellorganismen för endosporbildning, Bacillus subtilis, som bildar endosporer främst på grund av begränsning av näringsämnen (10).
ekologi
medan typstammen av C. acetobutylicum isolerades från jord, C. acetobutylicum är allestädes närvarande. Det har hittats i” sjösediment, brunnsvatten och mussla ” (1). Dessutom har det registrerats i ett antal olika avföringsprover, inklusive avföring från människa, nötkreatur och hund (1). En sökning i litteraturen avslöjar att patogena eller symbiotiska förhållanden inte dokumenteras.
patologi
C. acetobutylicum är helt godartad för både växter och djur, men många andra arter i Clostridium-släktet är kända patogener, inklusive: Clostridium difficile, Clostridium botulinum, Clostridium tetani och Clostridium perfringen. I synnerhet C. botulinum och C. tetani producerar några av de mest dödliga neurotoxinerna som är kända (11).
C. acetobutylicum har hittats i humant kolon, men det är inte känt att vara en del av normal mänsklig flora (3). Dessutom, eftersom organismen inte verkar vara giftig för däggdjur genom produktion av intracellulära eller extracellulära ämnen, måste organismen vara närvarande i enorma mängder för att producera något hot (12).
den enda frågan om patologi med C. acetobutylicum förvärvar gener från patogen Clostridium såsom C. tetani eller C. botulinum. Även om det inte finns några rapporterade fall av C. acetobutylicum som förvärvar dessa gener, har det förekommit incidenter i litteraturen där andra Clostridiumarter har orsakat spädbarns botulism med toxiner som mycket liknar de som finns i C. botulinum. Likheten av toxinerna tyder på att den normalt icke-toxigena Clostridium-stammen förvärvade toxinkodande gener från C. botulinum, som sannolikt är närvarande på en plasmid (13).
ansökan till bioteknik
Clostridium acetobutylicum har spelat en viktig roll i bioteknik under hela 20-talet. Ursprungligen behövdes aceton vid framställning av syntetiskt gummi. Chaim Weizmann anställdes för att arbeta med problemet vid Manchester University och jäsning blev en attraktiv väg för att förvärva den aceton som var nödvändig för processen. Mellan 1912 och 1914 isolerade Weizmann ett antal stammar. Den bästa produktionen skulle senare bli känd som Clostridium acetobutylicum. ABE-metoden som utarbetats av Weizmann erbjöd fördelen med ökad effektivitet jämfört med andra jäsningsprocesser. Dessutom skulle majsstärkelse kunna användas som substrat, medan andra processer krävde användning av potatis (3).
utbrottet av första världskriget 1914 resulterade i en enorm ökning av behovet av aceton. Det skulle visa sig vara en central punkt i utvecklingen av ABE-processen med Weizmanns organism. Acetonen skulle användas vid framställning av rökfritt krut, känt som cordit. Under de närmaste åren skulle Weizmanns process utnyttjas i ett antal stora industrifabriker genom Storbritannien. När Storbritannien avbröts från tillgång till spannmål under kriget flyttades processen till fabriker i Kanada. När USA gick in i kriget 1917 öppnade det också ett antal fabriker med Weizmann-metoden. Efter kriget slutade behovet av aceton plötsligt. Fabriker användes dock fortfarande för att producera butanol, ett användbart lösningsmedel vid tillverkning av lacker för den expanderande bilindustrin. Tidigare hade butanol varit en avfallsprodukt av processen när fokus låg på produktion av aceton. Under slutet av 1920-talet fortsatte efterfrågan på butanol att eskalera på grund av den växande bilindustrin och ett antal nya anläggningar öppnade med enorm produktionskapacitet. Två sådana växter lägger ut 100 ton aceton varje dag. Förutom butanol producerades industriell etanol för olika ändamål. Vätgasen som avges av processen användes för att hydrera oljor som används för mat. Vid ungefär denna tid blev melass det ledande substratet för Abe-jäsning. Det var billigare och effektivare än majsstärkelse. När patentet på weizmann-stammen löpte ut 1937 öppnades fler nya anläggningar över hela landet såväl som internationellt (3).
men i slutet av 1950-talet och 1960-talet började oljeindustrin klättra i en otrolig takt. Dessutom började priset på melass som användes vid jäsning klättra brant. Medan effektivare jäsningsmetoder utvecklades kunde de i slutändan inte konkurrera med petrokemisk produktion av industriella lösningsmedel och de flesta anläggningar stängdes av 1957(3). Men med den fortsatta ökningen av oljepriserna har det varit sedan studier för att ompröva jäsning som en källa till industriella lösningsmedel. Några av dessa processer har försökt öka effektiviteten i processen med hjälp av genetisk manipulation (14). Andra har undersökt användning av avfallsprodukter som vassle eller träspån som substrat (15).
aktuell forskning
C. acetobutylicum har varit fokus för forskning som en specifik mekanism för leverans av terapeutiska läkemedel till cancerregioner i kroppen. C. acetobutylicum är nödvändigtvis anaerob och därför kommer intravenös injektion av sporer att resultera i spiring endast i hypoxiska områden av fasta tumörer i kroppen. Genetisk manipulation av C. acetobutylicum för att producera enzymer som aktiverar pro-läkemedel inom tumörregionen ger en extremt specifik leveransmekanism till dessa tumörställen (16).
några av de senaste forskningen har undersökt alternativa metoder för att producera de industriella lösningsmedel som C. acetobutylicum har använts under det senaste århundradet för att producera. I synnerhet har butanol fått särskild uppmärksamhet som en möjlig alternativ bränslekälla för bilar. Butanol och etanol, båda produkterna av jäsning av C. acetobutylicum, har studerats intensivt. Av de två har butanol fördelar jämfört med etanol som bränslekälla, liksom många möjliga fördelar jämfört med nuvarande bränslekällor, eftersom det kan erbjuda lägre utsläpp och ökad effektivitet. Den viktigaste faktorn i kostnaden för butanolproduktion är förknippad med substratets kostnad och tillgänglighet. Studier har därför inriktats mot nya metoder för att använda billiga substrat. I en studie från 2006 föreslogs butanolfermentering via en ny patenterad process som ersättning för ABE-processen. Det innebär användning av majsfiber (specifikt xylem), som ett substrat för C. acetobutylicum, för att producera billig butanol. Den stora fördelen med denna teknik är att majsfiber är en biprodukt i många jordbruksprocesser och ger en riklig substratkälla (17).
en annan intensiv studiekälla för C. acetobutylicum är vätgasproduktion som en alternativ energikälla. Vätgas innehåller en stor mängd energi, vilket kan vara en extremt fördelaktig alternativ bensin. I synnerhet producerar användning av vätgas ingen koldioxid eller växthusgaser. De flesta vätgas produceras för närvarande med icke förnybara källor; ett alternativt produktionsmedel via jäsning skulle vara extremt värdefullt om avkastningen kunde ökas enormt. Således undersöks ett antal olika fermenteringsmetoder som kan användas för att förbättra avkastningen i den senaste forskningen som involverar C. acetobutylicum. I synnerhet har en tricklebädd reaktor som använder glukos som substrat presenterats som en möjlighet, även om avkastningen är för låg för att användas industriellt. Någon form av tillämpning av en sippra säng ses emellertid som ett möjligt produktionsmedel i framtiden (18).
taxonomi:NCBI
(1) Cato, EP, WL George och SM Finegold. 1986. Genus Clostridium, s. 1141-1200. I: P. H. A. Sneath et al. (EDS.), Bergeys Manual för systematisk bakteriologi, Vol. 2. Williams och Wilkins, Baltimore, MD.
(2) Nolling J et al., “Genomsekvens och jämförande analys av den lösningsmedelsproducerande bakterien Clostridium acetobutylicum.”, J Bakteriol, 2001 Aug;183 (16): 4823-38.
(3) Jones, D. T. och D. R. Woods. 1986. Aceton-butanol jäsning revisited. Mikrobiol. Upp 50: 484-524.
(4) Cornillot, E., R. V. Nair, E. T. Papoutsakis och P. Soucaille. 1997. Generna för butanol-och acetonbildning i Clostridium acetobutylicum ATCC 824 ligger på en stor plasmid vars förlust leder till degenerering av stammen. J. Bakteriol. 179:5442-5447.
(5) Zhang H, Bruns MA, Logan vara.(5) Keis, S., Shaheen, R., and Jones, D.T. “Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii, and descriptions of Clostridium saccharoperbutylacetonicum sp. nov. and Clostridium saccharobutylicum sp. nov.” Int. J. Syst. Evol. Microbiol. (2001) 51:2095-2103.
(6) Kawasaki, S., Y. Watamura, M. Ono, T. Watanabe, K. Takeda, and Y. Niimura. 2005. Adaptive responses to oxygen stress in obligatory anaerobes Clostridium acetobutylicum and Clostridium aminovalericum. Appl. Environ. Microbiol. 71:8442-8450.
(7) Fabrice Sabathe, Anne Belaıch, Philippe Soucaille (2002) Characterization of the cellulolytic complex (cellulosome) of Clostridium acetobutylicum FEMS Microbiology Letters 217 (1), 15–22.
(8) Chen, J.S., Toth, J., and Kasap, M. (2001) Nitrogen-fixation genes and nitrogenase activity in Clostridium acetobutylicum and Clostridium beijerinckii. J Ind Microbiol Biotechnol 27: 281–286.
(9) Gutierrez, Noemi A., Maddox, Ian S. Role of Chemotaxis in Solvent Production by Clostridium acetobutylicum Appl. Environ. Microbiol. 1987 53: 1924-1927.
(10) P. Durre och C. Hollergschwandner, initiering av endosporbildning i Clostridium acetobutylicum, anaerob 10 (2004), s.69-74.
(11) Kulle, E. O. 1981. Släktet Clostridium (medicinska aspekter), s.1756-1766. I: M. P. Starr et al. (EDS.), Prokaryoterna, Volym II. Springer-Verlag, New York.
(12) Gill, D. M. 1982. Bakteriella toxiner: en tabell med dödliga mängder. Mikrobiol. Upp 46: 86-94.
(13) Gimenez, J. A. och H. Sugiyama. 1988. Jämförelse av toxiner av Clostridium butyricum och Clostridium botulinum typ E. infektion och immunitet 56:926-929.
(14) Harris, L. M., R. P. Desai, N. E. Welker och E. T. Papoutsakis. 2000. Karakterisering av rekombinanta stammar av Clostridium acetobutylicum butyratkinas inaktiveringsmutant: behov av nya fenomenologiska modeller för solventogenes och butanolhämning? Bioteknol. Bioeng. 67:1-11.
(15) McNeil, B. Och B. Kristiansen. 1986. Aceton butanol jäsning. Adv.Appl. Mikrobiol. 31:61-92.
(16) nuyts S, Van Mellaert L, Theys J, Landuyt W, Lambin P och Anne J. Clostridium sporer för tumörspecifik läkemedelsleverans. Läkemedel Mot Cancer. 2002 Februari;13 (2):115-25.
(17) Nasib Qureshi, Xin-Liang Li, Stephen Hughes, Badal C. Saha och Michael A. Cotta Butanolproduktion från majsfiber Xylan med Clostridium acetobutylicum Biotechnol. Prog.; 2006; 22(3) s.673-680.
(18) Zhang H, Bruns MA, Logan vara. Biologisk väteproduktion av Clostridium acetobutylicum i en omättad flödesreaktor. Vatten Res. 2006 Februari; 40 (4):728-34.
redigerad av Mark Hower, student av Rachel Larsen och Kit Pogliano