cytomegalovirus (CMV) – infektion hos HIV/AIDS-patienter och diagnostiska värden för CMV-DNA-detektion över olika Provtyper
- introduktion
- metoder
- ämnen
- inkludering och exkludering
- reagenser och utrustning
- HIV-RNA-kvantifiering
- CD4+ T-lymfocyträkning
- CMV-DNA-kvantifiering
- CMV-antikroppstest
- studiemetoder
- Nukleinsyradetektering
- detektion av T-lymfocytundergrupper
- detektion av immunantikroppar
- statistisk analys
- resultat
- allmänna data
- positiva frekvenser av CMV-DNA, CMV-IgG och CMV-IgM
- korrelation mellan CMV-infektion ochcd4+ t-lymfocytantal
- detektion av CMV-DNA i olika prover
- diskussion
- slutsatser
- bekräftelser
- fotnot
introduktion
Cytomegalovirus (CMV) är ett vanligt herpesvirus som är utbrett över mänskliga populationer. CMV-infektion orsakar vanligtvis inte symtom och påverkar främst spottkörtlarna, njurarna och andra organ. Viral replikation kan emellertid förekomma hos immunkomprometterade patienter och kan bidra till skador på organ och deras funktioner. Opportunistiska infektioner är vanligare och allvarliga hos HIV/AIDS-patienter. CMV-virusinfektion är vanligt hos dessa patienter och kan påverka flera organ/system inklusive ögon, lungor, nervsystem och matsmältningssystem. Många studier har undersökt de virologiska och immunologiska egenskaperna hos enkel CMV-infektion (1), särskilt de som finns hos kvinnor och barn. De immunologiska egenskaperna hos CMV-infektion är dock ganska unika hos redan immunkomprometterade HIV/AIDS-patienter. Det finns skillnader i kliniska egenskaper, behandlingsåtgärder, prognostiska faktorer mellan HIV-patienter med CMV-infektion och de med CMV-infektion ensam (2). Kinas riktlinje rekommenderade att omedelbart antiviral terapi av CMV och ART behövs hos de HIV/AIDS-patienter med komplikationer (retinit, lunginflammation, CMV-encefalit, enterit etc.) när CMV-infektion identifieras. På grund av icke-specificiteten av kliniska symtom orsakade av CMV-infektion är laboratorieundersökning den huvudsakliga grunden för diagnosen CMV-infektion. De två mest använda kliniska metoderna är CMV-virusreplikation och serumimmunologiska metoder inklusive detektering av CMV IGG, CMV IgM och CMV-antigen PP65 (2) hos patienter med nedsatt immunfunktion försvagas eller fördröjs produktionen av CMV-antikropp, vilket kan leda till falskt negativt och öka graden av missad diagnos, därför har PCR-detektion av CMV-DNA till stor del blivit standardmetoden för diagnos av CMV-infektion och övervakning av behandling (3). Daisuke Mizushima et al. rapporterade att plasma CMV-DNA PCR har viktigt värde i diagnosen för både CMV-retinit och all CMV-EOD hos patienter med avancerad HIV-1-infektion (4). CMV-DNA PCR kan detekteras i en mängd olika Provtyper såsom plasma, urin, cerebrospinalvätska, vattenhaltig humor, avföring etc. (5). Men få artiklar har analyserat och diskuterat betydelsen och värdet av CMV-DNA PCR-detektion i andra prover än plasma. I den aktuella studien analyserade vi retroaktivt laboratorietesterna (inklusive CMV-DNA, CMV-antikropp, CD4+ T-lymfocytantal, HIV-virusbelastning etc.) i 808 HIV / AIDS-patienter som behandlades i vårt centrum från 2017 till 2019 för att förstå CMV-coinfektionen och styrkorna och svagheterna i flera detekteringsmetoder. Vi presenterar följande artikel / fall i enlighet med mdar-rapporteringschecklistan (tillgänglig på http://dx.doi.org/10.21037/apm-20-1352).
metoder
ämnen
totalt 808 HIV/AIDS-patienter som antogs till vårt centrum mellan januari 2017 och oktober 2019 registrerades. HIV-RNA, CD4 + T-lymfocytantal, CMV-DNA och relaterade antikroppar mättes hos varje patient. Diagnosen av HIV-infektion baserades på HIV / AIDS diagnos och behandlingsriktlinjer (tredje upplagan) (6), och alla patienter bekräftades som HIV-infektion av Fuzhou Municipal Centers for Disease Control (CDC) eller den lokala CDC som behandlade patienten. Diagnos av CMV-infektion baserades på följande kriterier: (i) CMV-DNA-positivt i plasma, alveolär spolvätska, urin, cerebrospinalvätska (CSF) och/eller andra kroppsvätskor; (II) serum CMV-immunoglobulin M (IgM) positivt; (III) en oftalmologisk diagnos av CMV-retinit; (IV) CMV-lunginflammation som huvudsakligen manifesterar sig som feber, hosta, slem och täthet i bröstet; CMV-DNA-positivt i alveolär sköljvätska; (V) CMV-enterit eller esofagit som huvudsakligen manifesterar sig som dysfagi/sväljningssmärta, diarre eller buksmärta och effektiv diagnostisk anti-CMV-behandling; (VI) CMV-encefalit som manifesterar sig som nervsystemet symtom och CMV-DNA-positivt i CSF eller hjärnvävnad; (VII) CMV-hepatit som manifesterar sig som feber, onormal leverfunktion och obehag i leverområdet och CMV-DNA-positivt i biopsi. En diagnos av CMV-infektion ställdes om något av ovanstående kriterier utom Punkt (II) uppfylldes eller om punkt (II) plus något annat kriterium uppfylldes (7).
alla procedurer som utfördes i denna studie med mänskliga deltagare var i enlighet med Helsingforsdeklarationen (reviderad 2013). Studien godkändes av medical ethics committee of our center (godkännande nr. KS2019-070-01). Uppgifterna är anonyma och kravet på informerat samtycke upphävdes därför.
inkludering och exkludering
inklusionskriterier: patienter med HIV / AIDS som först besökte Mengchao Hepatobiliary Hospital i Fujian Medical University och slutförde upptäckten av HIV-RNA, CMV-DNA, CMV-IgG-antikropp, CMV-IgM-antikropp och CD4+ T-lymfocyter inom 14 dagar. Uteslut HIV / AIDS-fall som inte kan slutföra ovanstående testobjekt på grund av otillräcklig provstorlek.
reagenser och utrustning
HIV-RNA-kvantifiering
fluorescerande kvantitativ realtidspolymeraskedjereaktion (PCR) (FQ-PCR) utfördes på MX3000P QPCR-systemet (Agilent, USA) med hjälp av HIV-RNA-kvantifieringssatsen producerad av QiaGen (Shenzhen, Kina).
CD4+ T-lymfocyträkning
instrumentet som användes var FACSCalibur-flödescytometern (BD Biosciences, USA) och reagenssatsen som användes var BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, USA).
CMV-DNA-kvantifiering
FQ-PCR utfördes på MX3000P QPCR-systemet (Agilent, USA) för att detektera CMV-DNA-nivåerna i plasma, urin och CSF. Satsen som användes producerades av Sansure Biotech (Hunan, Kina).
CMV-antikroppstest
Kemiluminescensimmunanalys utfördes för att detektera anti-CMV-IgG-och IgM-antikroppar på Cobas E601-analysatorn (Roche Diagnostics, Tyskland) med stödsatser (Roche Diagnostics, Tyskland).
studiemetoder
Nukleinsyradetektering
efter att HIV/AIDS-patienterna togs in på vårt sjukhus samlades 3 mL fastande etylendiamintetraättiksyra (EDTA)-antikoagulaerat helblodsprov och centrifugerades sedan vid 3000 r/min i 5 minuter för att skörda 200 kg plasma för HIV-RNA och CMV-DNA-detektion. Hos alla patienter samlades 5 mL urinprov på morgonen och blandades noggrant, och sedan skördades 200 CMV-DNA-detektion. För patienter med neurologiska symtom erhölls 1 mL CSF för CMV-DNA-detektion. Enligt detektionsgränsen och den positiva bedömningsstandarden för CMV-DNA-kit och HIV-RNA-kit. Proverna ansågs positiva om CMV-DNA-värdet var över 400 kopior/mL, eller om HIV-RNA-nivån var över 500 kopior/mL.
detektion av T-lymfocytundergrupper
hos HIV/AIDS-patienter samlades 3 mL EDTA-antikoagulativt fastande helblodprov vid antagning och blandades sedan noggrant för t-lymfocytundergrupp detektion på en BD FACSCalibur flödescytometer med hjälp av hjälpreagens.
detektion av immunantikroppar
hos HIV/AIDS-patienterna samlades 3 mL fastande blodprov vid antagning, centrifugerades vid 3000 r/min i 5 minuter i ett serumrör med gelseparator och testades sedan på maskinen.
alla ovanstående tester utfördes strikt i enlighet med reagensinstruktionerna i tillverkarens manual och instrumentets standardrutiner.
statistisk analys
statistisk analys utfördes med hjälp av SPSS 21.0 programvara. De normalfördelade mätdata presenteras med hjälp av genomsnittlig standardavvikelse i enlighet med standarden för normalfördelad mätning ( x SD ), och icke-normalfördelade data uttrycks som median (25-75 percentiler). Räkningsdata uttrycks i procent och priser. Jämförelsen av de icke-normalt distribuerade mätdata mellan två grupper utfördes med användning av ett icke-parametriskt rangsummatest, medan räkningsdata jämfördes med Chi-kvadrattestet. Ett P-värde på <0,05 ansågs statistiskt signifikant.
resultat
allmänna data
de allmänna data för 808 HIV/AIDS-patienter sammanfattas i Tabell 1. Kön och ålder visade ingen signifikant skillnad mellan CMV-gruppen och icke-CMV-gruppen. Det absoluta antalet CD4 i den CMV-infekterade gruppen var signifikant lägre än i den CMV-oinfekterade gruppen (Z=-8, 87, P<0, 001) och HIV-RNA-nivån var signifikant högre i den CMV-infekterade gruppen än i den icke-CMV-infekterade gruppen (Z=-3, 207, P<0, 05) (Tabell 1).
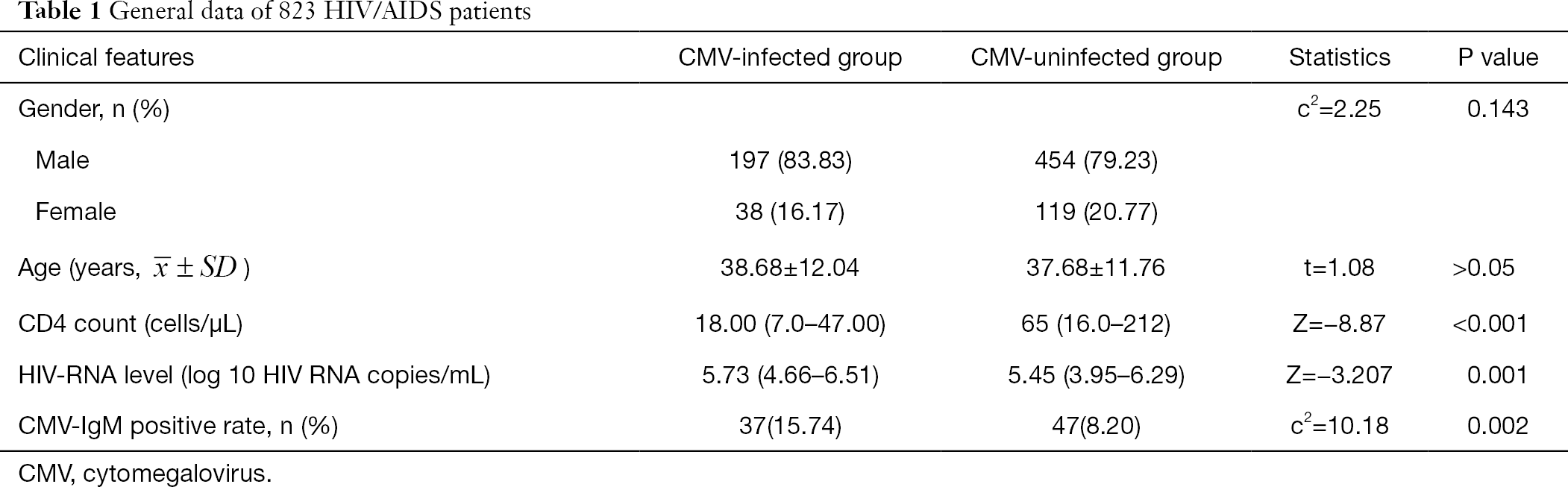
fullständig tabell
positiva frekvenser av CMV-DNA, CMV-IgG och CMV-IgM
den totala positiva frekvensen av CMV-DNA var 29,08% (235/808); specifikt var det 5,70% (13/228) i CSF 26,01% (77/296) i plasma och 25,75% (180/699) i urin. Den positiva frekvensen av CMV-IGG var 99,8% (806/808) och den positiva frekvensen av CMV-IgM var 10,40% (84/808).
korrelation mellan CMV-infektion ochcd4+ t-lymfocytantal
efter gruppering av CD4+ T-lymfocytantalet fann vi att andelen patienter infekterade med cytomegalovirus vid låg frekvens av CD4+ T-lymfocyt var större än hos icke-CMV-infekterade patienter. Förekomsten av CMV-infektion ökade med minskningen av CD4-antalet (Tabell 2).
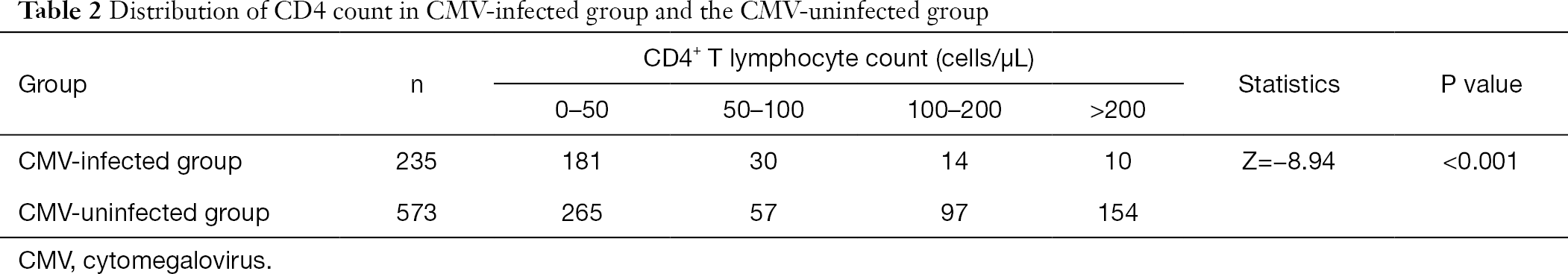
fullständig tabell
detektion av CMV-DNA i olika prover
av dessa 808 patienter fick 198 patienter också test för plasma och urin CMV-DNA och plasma anti-DNA-CMV-IgG-och CMV-IgM-antikroppar. Genom att använda Chi-square-analysen för parade data utförde vi parvisa jämförelser av urin CMV-DNA och plasma CMV-DNA med plasma CMV-IgM-antikropprespektive. Det visade sig att resultaten av urin-och plasma-CMV-DNA-detektion skilde sig signifikant från den för plasma-CMV-IGG-antikroppsanalys (P<0,001), medan resultatet av plasma-CMV-DNA-detektion inte skilde sig signifikant från det för urin-CMV-DNA-detektion (P>0,05) (tabeller 3,4).

fullständig tabell
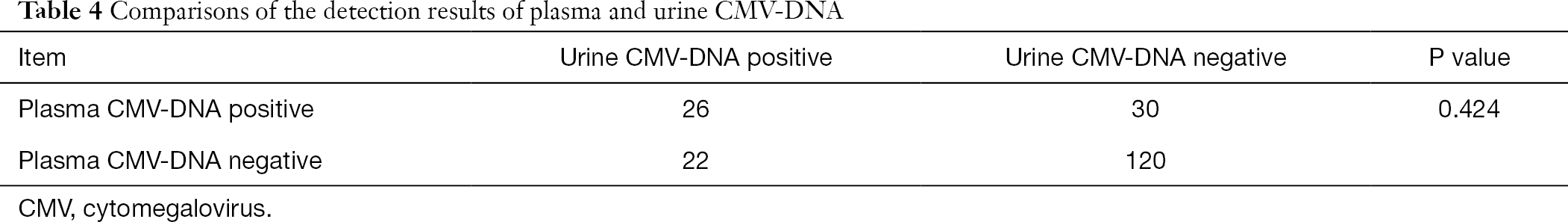
fullständig tabell
diskussion
CMV är medlem i gruppen av herpesvirus och kännetecknas av dess strikta artspecificitet och utbredd förekomst i humana populationer. CMV-seroprevalens är cirka 85% hos barn och upp till 95% hos vuxna. I vår nuvarande studie nådde den positiva graden av CMV-IGG 99,8%. CMV är latent i de flesta fall, men hos immunkompromitterade individer replikerar viruset exponentiellt och sprider sig i hela kroppen med blodet, vilket orsakar CMV-viremi och till och med organisk CMV-sjukdom (8). CMV-infektion är en av de vanligaste opportunistiska infektionerna hos HIV/AIDS-patienter. CD4 + T-lymfocyter är målcellerna för HIV-virus, och deras antal kan ofta återspegla AIDS-kursen och kan också användas som en indikator för att utvärdera immunstatus hos AIDS-patienter. Denna studie analyserade CMV-infektion, CD4-antal och HIV-RNA-nivå hos 808 patienter med HIV/AIDS. Vi fann att den positiva graden av CMV hos AIDS-patienter ökade med minskningen av CD4-antalet och med ökningen av HIV-virusbelastning. Även i vår nuvarande studie hade upp till 77,02% av CMV-positiva patienter ett CD4-tal på <50 celler/ubicl, vilket tyder på att CD4 <50 celler/ubicl är en riskfaktor för HIV-CMV-coinfektion, vilket överensstämmer med upptäckten av Deng et al. (9). Den kvantitativa nivån av HIV-RNA i CMV-infekterad grupp var högre än den i CMV-oinfekterad grupp, vilket indirekt antydde att höga nivåer av HIV-RNA-virusbelastning var en annan riskfaktor för CMV-infektion hos HIV/AIDS-patienter .Därför rekommenderas att patienter med HIV / AIDS bör initiera ART-behandling så snart som möjligt för att främja immunrekonstituering för att förhindra opportunistiska infektioner och screening för HCMV är avgörande för HIV/AIDS-patienter med ett CD4-tal på <50 celler/aisl (2).
vi utvärderade också värdena för virala nukleinsyraanalyser och immunologiska metoder vid klinisk detektering av CMV-infektion. Studier i Kina och internationellt har visat att CMV-DNA förekommer tidigare än de kliniska symtomen och serologiska reaktionerna av CMV-infektioner. FQ-PCR är för närvarande den mest exakta och snabba mikrobiella kvantifieringsmetoden och kan övervinna vissa problem med traditionell PCR (t.ex. amplifieringsproduktförorening och icke-kvantifiering) (10). I vår nuvarande studie var den positiva frekvensen av CMV-DNA 5.70% (13/228) i CSF-proverna av 228 patienter med neurologiska symtom, vilket var mycket lägre än i plasma-och urinprover, vilket kan förklaras av blod-hjärnbarriären och organkänsligheten. Anti-CMV-IgM-antikroppen används ofta som en markör för aktiv virusinfektion; den positiva frekvensen av anti-CMV-IgM-antikroppen var emellertid endast 10,40% (84/808) hos våra HIV/AIDS-patienter, vilket var lägre än den positiva frekvensen av CMV-infektion som rapporterades i icke-HIV/AIDS-populationerna (11). Dessutom hade dess positiva hastighet dålig överensstämmelse med resultaten av nukleinsyradetektering, vilket kan bero på det försvagade immunsystemet eller på grund av den fördröjda generationen av IgM-antikroppar hos HIV/AIDS-patienter. Därför har detektion av CMV-IgM-antikropp en begränsad roll vid HCMV-screening hos HIV/AIDS-patienter. Dessutom var den positiva frekvensen av CMV-infektion hos 808 patienter 29,05% (235/808) i vår nuvarande studie, vilket är något högre än de 21,85% som rapporterats av Li et al., och kan bero på den större variationen av prover (inklusive plasma, urin och CSF) som samlats in i denna studie (12). Den positiva frekvensen av CMV-DNA var 25,57% i urin och 26,01% i plasma, skillnaden var inte statistiskt signifikant. Därför rekommenderar vi att CMV-DNA-screening i plasma och urin ska utföras när CD4+ T-lymfocytantalet är mindre än 200 celler/aucl, särskilt när <50 celler/aucl; dessutom krävs detektion av CMV-DNA i CSF om uppenbara neurologiska symtom är närvarande.
slutsatser
Sammanfattningsvis är lågt CD4 + T-lymfocytantal och hög HIV-1-virusbelastning riskfaktorer för CMV-infektion hos HIV/AIDS-patienter. Detektion av urin eller plasma CMV-DNA med FQ-PCR är mycket värdefullt vid screening av CMV-infektion hos HIV / AIDS-patienter, medan detektion av blod CMV IgG och CMV IgM-nivåer har begränsat kliniskt värde. Blod eller urin CMV-DNA-screening rekommenderas för AIDS-patienter för att förebygga och diagnostisera CMV-infektion tidigt och förbättra deras livskvalitet.
bekräftelser
finansiering: sponsrad av Key Clinical Specialty Discipline Construction Program av Fujian, PRC
fotnot
Rapporteringschecklista: författarna har slutfört mdar-rapporteringschecklistan. Tillgänglig på http://dx.doi.org/10.21037/apm-20-1352
Data Sharing Statement: tillgänglig på http://dx.doi.org/10.21037/apm-20-1352
intressekonflikter: alla författare har fyllt i ICMJE uniform disclosure form (tillgänglig på http://dx.doi.org/10.21037/apm-20-1352). Författarna har inga intressekonflikter att förklara.
etiskt uttalande: författarna är ansvariga för alla aspekter av arbetet för att säkerställa att frågor relaterade till riktigheten eller integriteten i någon del av arbetet undersöks och löses på lämpligt sätt. Alla förfaranden som utfördes i denna studie med mänskliga deltagare var i enlighet med Helsingforsdeklarationen (reviderad 2013). Studien godkändes av medical ethics committee of our center (godkännande nr. KS2019-070-01). Uppgifterna är anonyma och kravet på informerat samtycke upphävdes därför.
Open Access Statement: detta är en Open Access-artikel som distribueras i enlighet med Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), som tillåter icke-kommersiell replikering och distribution av artikeln med strikt förbehåll att inga ändringar eller ändringar görs och det ursprungliga arbetet Citeras korrekt (inklusive länkar till både den formella publikationen genom relevant DOI och licensen). Se: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, han G. effekter av cytomegalovirusinfektion på regulatoriska immunceller hos gravida kvinnor kinesiska. Journal of Nosokomiologi. 2017;27:2103-6.
- National Science and Technology Major Project hjälper opportunistisk infektionsforskningsgrupp under den 13: e femårsplanen. Expertkonsensus om klinisk diagnos och behandling av AIDS komplicerat med cytomegalovirussjukdom . Journal of Southwest University( naturvetenskap Edition): 1-17 .
- Hodowanec AC, Pikis A, Komatsu TE, et al. Behandling och förebyggande av CMV-sjukdom hos transplantatmottagare: aktuell kunskap och framtida perspektiv. J Clin Pharmacol 2019; 59: 784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Diagnostisk nytta av kvantitativ plasma cytomegalovirus DNA PCR för cytomegalovirus endorgan sjukdomar hos patienter med HIV-1-infektion. J Förvärva Immundefic Syndr 2015; 68:140-6.
- Michaelides A, Liolios L, bländning EM, et al. Ökad human cytomegalovirus (HCMV) DNA-belastning i perifera blodleukocyter efter lungtransplantation korrelerar med HCMV-pneumonit. Transplantation 2001; 72: 141-7.
- infektionen av neurologi, AIDS-grupp av kinesisk medicinsk förening. HIV / AIDS diagnos och behandlingsriktlinjer (tredje upplagan). Kinesisk tidskrift för infektionssjukdomar 2015; (10): 577-93.
- Corrales I, Gim Askorbnez E, Solano C, et al. Förekomst och dynamik av aktiv cytomegalovirusinfektion hos allogena stamcellstransplantationspatienter enligt enstaka nukleotidpolymorfismer i givare och mottagare CCR5 -, MCP-1 -, IL-10-och TLR9-gener. J Med Virol 2015; 87: 248-55.
- Tagarro A, Del Valle R, Dominguez-Rodr Kazakguez S, et al. Tillväxtmönster hos barn med medfödd cytomegalovirusinfektion. Pediatr Infektera Dis J 2019; 38: 1230-5.
- Deng X, Liu J, Zhang M, et al. Analys av virologiska och immunologiska egenskaper hos HIV / AIDS i kombination med cytomegalovirusinfektion. Kinesisk tidskrift för sjukhusinfektion 2019; 29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analys av cirkulerande humana och virala mikroRNA sin-patienter med medfödd cytomegalovirusinfektion. J Perinatol 2016; 36: 1101-5.
- Li L, Gao S, Zhang T, et al. Jämförelse av DNA-detektion och IgM-detektion av humant cytomegalovirusinfektion och diskussion om deras kombinerade applikationsvärde. Kinesisk tidskrift för experimentell diagnostik 2015; (1): 78-80.
- Li x, Cao L, Yu C, et al. Studie om infektion av cytomegalovirus hos AIDS-patienter. Modern Förebyggande Medicin 2012;39:2278-9.
(engelska Språkredigerare: J. Gray)