gränser i medicin
- introduktion
- patienter och metoder
- patientval i databasen för övervakning, epidemiologi och slutresultat
- statistisk analys
- resultat
- patientegenskaper
- förbättrad Risk för T1-steg jämfört med andra T-steg i samband med Serumcea-höjning
- effekt av preoperativ Serum CEA-höjning i T-steg
- diskussion
- datatillgänglighet uttalande
- Etikuttalande
- Författarbidrag
- intressekonflikt
- bekräftelser
introduktion
rektalcancer är en av de vanligaste maligniteterna över hela världen (1). Enligt American Joint Committee on Cancer (AJCC) staging system är den anatomiska omfattningen av primär tumör (t-scenen) en av de viktigaste prognostiska prediktorerna. Patienter med samma T-Stadium av rektalcancer kan dock visa betydligt olika kliniska resultat.
första rapporterade i 1965, carcinoembryonic antigen (CEA) är en 180-200 kDa glykoprotein och en medlem av immunoglobulin superfamiljen (2). CEA utsöndras av en mängd fasta tumörer, inklusive 90% av kolorektal cancer (3). Som den enskilt viktigaste och pålitliga serumprognostiska biomarkören i kolorektal cancer, förhöjda preoperativa CEA-nivåer befinns vara associerade med sämre prognos för kolorektal cancer (4-9).
tidigare studier har visat att CEA var associerat med vidhäftning av cancerceller och medfödd immunitet vid kolorektal cancer. Dessutom rapporterades CEA också för att underlätta bindning av kolorektala cancerceller till metastasställen och stödja Tumörprogression (10-12).
traditionellt har den avlägsna spridningen av tumörceller betraktats som en sen händelse, men fynd från flera tidigare studier visade att förvärv av metastatisk potential kan inträffa i det mycket tidiga stadiet av tumörprogression (13-16). Wo et al. (17) rapporterade att en mycket liten tumörstorlek involverad i lymfkörtelpositivitet kan vara en surrogat för aggressiv biologi. Vi misstänker då att mycket tidigt stadium rektalcancer med serum CEA-höjning kan föreslå tidigt förvärv av metastatisk potential och förutsäga en mycket dålig överlevnad av rektalcancer.
men så vitt vi vet rapporterades få studier för att undersöka sambandet mellan T-Stadium och serum CEA-nivåer (C0 och C1) vid bestämning av prognos för rektalcancer. Därför genomför vi denna stora befolkningsbaserade studie för att undersöka om mycket tidigt T-Stadium i samband med serum CEA-höjning kan vara ett surrogat för biologiskt aggressiv sjukdom och förutsäga för dålig orsaksspecifik överlevnad (CSS) av rektalcancer. För att ta bort effekten av lymfkörtelpositivitet på vår forskning utesluter vi sedan nodpositiva patienter och fokuserade analysen på Steg I-II–patienter.
patienter och metoder
patientval i databasen för övervakning, epidemiologi och slutresultat
som en auktoritativ källa till information om cancerincidens och överlevnad i USA och en omfattande källa till befolkningsbaserad information inklusive alla nyligen diagnostiserade cancerfall som förekommer i områden med övervakning, epidemiologi och slutresultat (SEER) omfattar Seer-databasen ~28% av den amerikanska befolkningen. SEER-databasen innehöll inga identifierare och var offentligt tillgänglig för forskare. SEER * Stat är en programvara som tillhandahålls av SEER-programmet för att få patientinformation med hjälp av onlineåtkomst. Först användes falllistningssessionen för Seer * Stat-programvaran (SEER*Stat 8.3.5) för att lista All patientrelaterad information och patienter som diagnostiserats med steg i-II (nodnegativ) rektalcancer mellan 1 januari 2004 och 31 December 2015 identifierades från Seer–databasen (Figur 1). Rektala cancerpatienter identifierades av ICD-O – 3-platskoderna C199 och C209 och beteendekod 3 (Naaccr-artiklarna 522 och 523) (9). Vi valde att inkludera dessa år eftersom informationen om preoperativt serum CEA registrerades från och med 2004 och SEER-uppföljningen slutade 2015.

Figur 1. Flödesschema över patientkohortdefinitioner.
sedan fick de neoadjuvant strålbehandling, brist på positiv histologisk bekräftelse, med okänd ras, icke-adenokarcinomhistologier eller inte aktiv uppföljning uteslöts från vår studie. Patienter med preoperativ serum CEA-nivå tillgänglig inkluderades i vår studie, och vi grupperade “positiv / förhöjd” och ” negativ / normal; inom normala gränser ” som C1 och C0 (C-stegsinformation). Gränsvärdena för CEA var 2,5 ng/ml för icke-rökare respektive 5 ng / ml för rökare. För övrigt, följande patientklinikopatologiska variabler hämtades också från SEER-databasen: T-Stadium, ras, kön, tumörplats, ålder vid diagnos, diagnosår, betyg, och histologi.
statistisk analys
i den aktuella studien användes Pearsons chi-squared-test för att jämföra alla patienters clinicopathological variabler hämtade från Seer-databasen mellan de normala och förhöjda preoperativa serumnivåerna CEA. Vissa multivariabla Cox proportionella riskmodeller byggdes för att identifiera oberoende prognostiska variabler av rektal cancer i våra analyser. Överlevnadskurvor genererades med Kaplan-Meier-metoden, och skillnader mellan kurvorna analyserades med log-rank-test. De primära resultaten av intresse för den aktuella studien var CSS och total överlevnad (OS). CSS beräknades från diagnosdagen till datumet för cancerspecifik död. Dödsfall som tillskrivs rektalcancer behandlades som händelser, och dödsfall från andra orsaker behandlades som censurerade observationer vid dödsdatumet. För att avgöra om det fanns en signifikant interaktion mellan preoperativ serum CEA-nivå och T-steg för att förutsäga CSS, definierade vi också en interaktionsvariabel (T-steg och serum CEA-nivå). Dubbelsidig P < 0,05 ansågs statistiskt signifikant. Statistiska analyser utfördes huvudsakligen med hjälp av SPSS version 22 (IBM Corporation, Armonk, NY, USA).
resultat
patientegenskaper
sammantaget identifierades 19 184 patienter som diagnostiserats med stadium I–II rektala cancerpatienter från Seer-databasen mellan 1 januari 2004 och 31 December 2015 (Figur 1). Av dessa patienter tilldelades 13 007 (67,8%) patienter till C0-scenen och 6 177 (32,2%) patienter till C1-scenen. AJCC staging system föreslog att 6 077 patienter var i T1-scenen, 4 783 patienter i T2-scenen, 7 021 i T3-scenen och 1 303 var i T4-scenen. Totalt dog 2 560 (13,3%) patienter av rektalcancer i slutet av uppföljningstiden. Medianuppföljningstiden för hela kohorten var 44 månader (0-143 månader). Patientens baslinjekarakteristika sammanfattas i Tabell 1.
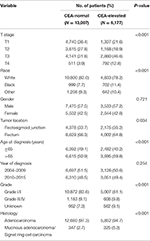
Tabell 1. Jämförelse av baslinjekarakteristika för steg I-II rektal cancer med serumkarcinoembryoniskt antigen (CEA) – nivå.
förbättrad Risk för T1-steg jämfört med andra T-steg i samband med Serumcea-höjning
det visade sig att C1-scenen var mer sannolikt att korrelera med högre T-steg, svart, rektosigmoidkorsning, äldre ålder, högre grad och mucinöst adenokarcinom/Signetringcellkarcinom (Tabell 1, P < 0, 05). Som visas i Tabell 2 inkluderades ras, kön, tumörplats, ålder vid diagnos, diagnosår, grad, histologi, T-Stadium och serum CEA-nivå i den multivariata Cox-analysen. När multivariat Cox-analys utfördes övertygade vi följande kliniska patologiska egenskaper som oberoende prognostiska faktorer i steg I–II rektalcancer; dessa inkluderade ras, kön, tumörplats, ålder vid diagnos, tumörkvalitet, t-steg och serum CEA-nivå, medan risken mellan T2, C0 och T1,C0 inte var statistisk skillnad (P = 0,925). Det visades att T1-scenen i samband med serum CEA-höjning presenterade oväntad högre risk för rektal-cancerspecifik dödlighet jämfört med steg T2 och T3. I stadium T1-sjukdom var förhöjd nivå av serum CEA associerad med 227, 6% ökad risk för dödlighet jämfört med normal nivå av serum CEA.

Tabell 2. Multivariat Cox regressionsanalyser av orsaksspecifik överlevnad (CSS) i steg I–II rektalcancer.
Kaplan-Meier överlevnadskurvor är ritade i figurerna 2, 3. Den 5-åriga CSS-frekvensen var 92,2% i T1C0, 75,2% i T1C1, 93,1% i T2C0, 86,7% i T2C1, 84,6% i T3C0, 76,3% i t3c1, 62,9% i T4C0 och 43,6% i t4c1 (Figur 2, P < 0,001). Därför presenterade T1C1 en liknande 5-årig CSS-hastighet jämfört med T3C1 (75,2 mot 76,3%, P = 0,238). Dessutom var upptäckten ännu mer uttalad i OS. Den 5-åriga OS-frekvensen var 78,6% i T1C0, 48,3% i T1C1, 77,1% i T2C0, 62,3% i T2C1, 68,5% i T3C0, 54,5% i t3c1, 45,3% i T4C0 och 30,0% i t4c1 (Figur 3, P < 0,001). T1C1 presenterade signifikant lägre 5-årig CSS-hastighet jämfört med T3C1 (48,3 mot 54,5%, P < 0,001).
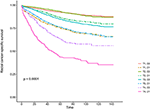
Figur 2. Kaplan-Meier cause-specific survival (CSS) kurvor av T-scenen i kombination med serum carcinoembryonic antigen (CEA) nivå.
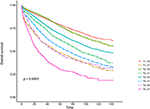
Figur 3. Kaplan-Meier total överlevnad (OS) kurvor av T-scenen i kombination med serum carcinoembryonic antigen (CEA) nivå.
effekt av preoperativ Serum CEA-höjning i T-steg
skogsplotten ritades för att visa hazard ratios (HRs) för att jämföra CSS mellan normala och förhöjda CEA – grupper i respektive T-steg (Figur 4). Jämfört med normal nivå av serum CEA, i steg T2, var förhöjd nivå av serum CEA associerad med 69,0% ökad risk för rektal-cancerspecifik dödlighet ; i steg T3 var förhöjd nivå av serum CEA associerad med 67,2% ökad risk för rektal-cancerspecifik dödlighet (HR = 1,672, 95% CI = 1,486-1,882, P < 0,001); i steg T4 var förhöjd nivå av serum CEA associerad med 81,3% ökad risk för rektal-cancerspecifik dödlighet (HR = 1,813, 95% CI = 1,485–2,213, p < 0,001); däremot, i steg T1, förhöjda nivåer av serum cea presenteras även upp till 211.6% ökad risk för rektal-cancerspecifik dödlighet (HR = 3,116, 95% ki = 2,639–3,679, P < 0,001).
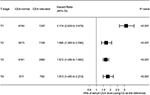
Figur 4. Riskförhållanden (HRs) för orsaksspecifik överlevnad (CSS) mellan normal och förhöjd nivå av serumkarcinoembryoniskt antigen (CEA) enligt t-scenen.
diskussion
vi syftade till att undersöka sambandet mellan T-Stadium och serum CEA-nivåer vid bestämning av CSS för rektal cancer. Vi antog att rektalcancer med mycket tidigt T-Stadium (steg T1) och serum CEA-höjning kan vara ett biologiskt surrogat för aggressiv sjukdom, vilket förutsäger ett dåligt onkologiskt resultat. Med ~20 000 patienter diagnostiserade med stadium I–II rektal cancer ingår i vår studie.
i denna studie fann man att serumcea-höjning var mer sannolikt att korrelera med högre T-steg, svart, rektosigmoidkorsning, äldre ålder och högre grad och mucinöst adenokarcinom/Signetringcellkarcinom. Kaplan-Meier överlevnadsanalyser visade att i samband med serum CEA-höjning var 5-årig CSS-hastighet för steg T1 75,2%, vilket inte uppnådde statistisk skillnad från steg T3 (76,3%). När det gäller total överlevnad var 5-årig OS-hastighet för steg T1 med preoperativ serum CEA-höjning (48, 3%) ännu lägre än steg T3 involverad i CEA-höjning (54, 5%) och uppnådde inte statistisk skillnad från steg T4 (45.3%), vilket innebär förhöjd preoperativ serumnivå av CEA kunde identifiera en undergrupp av stadium T1 rektalcancer med liknande CSS jämfört med vissa Stadium T3-sjukdomar och med liknande OS jämfört med vissa Stadium T4-sjukdomar.
efter justering för kända prognostiska faktorer för rektalcancer (ras, kön, tumörplats, ålder vid diagnos, diagnosår, grad och histologi), interaktionsvariabeln (t-steg och serum CEA-nivå) vi definierade visade sig vara en oberoende prognostisk faktor för rektal cancer. Multivariat Cox-analys visade att T1-scenen i samband med serum CEA-höjning presenterade oväntad högre risk för rektal-cancerspecifik dödlighet jämfört med steg T2 och T3. I stadium T1-sjukdom var förhöjd nivå av serum CEA associerad med 227, 6% ökad risk för dödlighet jämfört med normal nivå av serum CEA. Dessutom identifierades ras, kön, tumörplats, ålder vid diagnos och tumörkvalitet som oberoende prognostiska faktorer för stadium I–II rektalcancer. Bortsett från T1 fann man att preoperativ serum CEA-höjning presenterade ~75% högre risker för rektal-cancerspecifik dödlighet i respektive T-Stadium, men antalet ökade kraftigt till 211,6% i T1-scenen.
år 2000 föreslog AJCC: s kolorektala arbetsgrupp införandet av serumnivå av CEA (C-Stadium) i det konventionella AJCC TNM-staging-systemet för kolorektal cancer (18). Dessutom har American Society of Clinical Oncology och European Group on tumörmarkörer båda stött införandet av preoperativ serum CEA-nivå som ett prognostiskt verktyg i kolorektal cancer (19-21).
flera tidigare undersökningar rapporterade serumcea-nivån som en stark prognostisk roll i koloncancer (4-7, 22-26). I 2011, Thirunavukarasu et al. (25) rapporterade att preoperativ serum CEA-nivå var en oberoende prognostisk biomarkör för koloncancer, och prognosen var sämre hos höga CEA-patienter med ett lägre Stadium jämfört med låga CEA-patienter med ett högre stadium. I den studien ansågs hög CEA till och med vara lika stark som nodpositivitet för att förutsäga dåliga onkologiska resultat av koloncancer.
ändå fokuserar få studier på att belysa den prognostiska rollen för serum CEA-nivå i rektalcancer. I 2016, även med hjälp av Seer-databasen, Tarantino et al. (9, 27) genomförde de två stora befolkningsbaserade undersökningarna, vilket gav övertygande bevis för att förhöjd nivå av preoperativt serum CEA var en stark prediktor för sämre övergripande och cancerspecifik överlevnad i rektalcancer. I 2018, Liu et al. (8) visade att preoperativt serum CEA var en oberoende prognostisk faktor för rektalcancer, och förhöjd serum CEA–nivå presenterade uppenbarligen sämre överlevnad jämfört med normal serum CEA-nivå i steg I-IV. de enda två tidigare studierna fokuserade emellertid på att undersöka den prognostiska rollen för preoperativ serum CEA-nivå undersökte inte sambandet mellan CEA-nivå och T-steg för att förutsäga tumörresultaten av rektal cancer.
även om den konventionella visar att cancer förvärvar metastatisk potential steg för steg när de växer till en stor storlek (28), visade dock vissa tidigare studier att förvärv av metastatisk potential kan inträffa mycket tidigt i Tumörprogression. En tidigare forskning visade den extremt dåliga överlevnaden av mycket liten tumörstorlek när den var involverad i lymfkörtelpositivitet (17). Dessutom visar resultaten av vår forskning att höjning av preoperativ serum CEA-nivå i mycket tidigt stadium (Stadium T1) rektal cancer är associerad med mycket dåligt OS och CSS och kan vara ett surrogat av aggressiv biologi. Vi tror att både lymfkörtel involvering och serum CEA-höjning anses vara förvärv av metastatisk förmåga. Vår studie, kombinerat med Wo et al. konsekvent stödja den ovannämnda tanken att förvärv av metastatisk potential kan inträffa mycket tidigt i Tumörprogression, vilket är förknippat med dåliga onkologiska resultat, och den initiala biologiska egenskapen är mer benägna att bestämma potentialen för avlägsen metastas under cancerprogression, snarare än den ackumulerade metastatiska förmågan (29).
dessutom är resultaten av vår studie av klinisk betydelse. För närvarande behandlas Stadium i rektal cancer med radikal kirurgisk resektion ensam på grund av relativt gynnsamma onkologiska resultat. Emellertid kommer cirka 10-15% av patienterna att utveckla tumöråterfall efter radikal resektion (30, 31). I föreliggande studie, vi råkar identifiera en undergrupp av steg T1 rektal cancer med mycket dålig prognos jämfört med resten av steg i rektal cancer, vilket innebär att de steg T1 rektal cancer med inblandning av preoperativ serum CEA höjd bör fånga mer uppmärksamhet av onkologer.
det finns dock två begränsningar i vår studie. Å ena sidan inkluderade denna studie inte några kända prognostiska faktorer för rektalcancer i våra analyser, inklusive mikrosatellitinstabilitetsstatus och postoperativa komplikationer, som inte var tillgängliga från Seer-databasen och kan införa fördomar i viss utsträckning. Vi kan inte tillhandahålla intervall och medelvärden för CEA i båda grupperna. Å andra sidan var den aktuella studien retrospektiv snarare än baserad på prospektiva data. Därför måste våra resultat fortfarande valideras i andra kohorter, särskilt i stora prospektiva kliniska studier.
Sammanfattningsvis visar vår studie att stadium T1 rektal cancer, när den är involverad i preoperativ serum CEA-höjning, kan vara ett surrogat av biologiskt aggressiv sjukdom och korrelera med ogynnsamt OS och CSS. Dessutom förtjänar denna undergrupp av rektalcancer mer klinisk uppmärksamhet hos onkologer. Våra resultat, om de valideras i framtida databasstudier, skulle ge en ny terapiide för rektalcancer i tidigt stadium.
datatillgänglighet uttalande
datauppsättningarna som genereras för denna studie är tillgängliga på begäran till motsvarande författare.
Etikuttalande
patienter i denna studie identifierades från Seer-databasen och godkännandet för användning av data erhölls genom en begäran som lämnades in till SEER-programmet. Godkännandet av institutional review board behövdes inte eftersom Seer-databasen är tillgänglig för allmänheten.
Författarbidrag
SW och WG har gjort ett väsentligt och direkt bidrag till denna studie och godkänt det för inlämning.
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
detta arbete stöddes delvis av medicinsk vetenskap och Teknikutvecklingsplan projekt av Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram i, Siegel RL, Torre LA, Jemal A. Global cancerstatistik 2018: GLOBOCAN uppskattningar av incidens och dödlighet över hela världen för 36 cancerformer i 185 länder. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
2. Guld P, Freedman så. Demonstration av tumörspecifika antigener i humana kolonkarcinomata genom immunologisk tolerans och absorptionstekniker. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
3. Goldstein MJ, Mitchell EP. Karcinoembryoniskt antigen vid iscensättning och uppföljning av patienter med kolorektal cancer. Cancer Investera. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstrakt / CrossRef fulltext / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, Gonz Jacoblez MG, Hensley BJ, et al. Utvärdera den prognostiska rollen för förhöjda preoperativa karcinoembryoniska antigennivåer hos koloncancerpatienter: resultat från national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstrakt / CrossRef fulltext / Google Scholar
5. Han är en av de mest kända och mest kända i världen. Förhöjd preoperativ serumkarcinoembrionisk antigennivå kan vara en effektiv indikator för att behöva adjuvant kemoterapi efter potentiellt botande resektion av stadium II koloncancer. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
6. J. J., J. J., Gonen M., Shia J., Schrag D., Landmann R. G., et al. Identifiering av patienter med högriskstadium II koloncancer för adjuvansbehandling. Dis Kolon Ändtarmen. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed Abstrakt / CrossRef fulltext / Google Scholar
7. Han är en av de mest kända och mest kända i världen. Införlivandet av CEA förbättrar riskstratifiering i stadium II koloncancer. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstrakt / CrossRef fulltext / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Kombination av karcinoembryoniskt antigen med American Joint Committee on Cancer TNM staging system i rektal cancer: en verklig och stor befolkningsbaserad studie. Onco Mål Ther. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, g Ubbler U, Mieth M, Cerny T, et al. Prediktivt värde av CEA för överlevnad i steg i rektal cancer: en populationsbaserad benägenhetspoäng-matchad analys. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. doi: 10.1038/onc.2012.112
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
12. Han är en av de mest kända och mest kända. Åtkomst till ny prognostisk betydelse av preoperativt karcinoembryoniskt antigen vid kolorektal cancer som får tumörresektion: mer än positivt och negativt. Cancer Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstrakt / CrossRef fulltext / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, F. Processen för metastasering för bröstcancer. Eur J Cancer. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstrakt / CrossRef fulltext / Google Scholar
14. Han är en av de mest kända och mest kända. Systemisk spridning är ett tidigt steg i bröstcancer. Cancercell. (2008) 13:58–68. doi: 10.1016 / j. ccr.2007.12.003
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
15. Lj, Beverly LJ, Hambardzumyan D, Varmus H. Sädning och förökning av otransformerade musmorceller i lungan. Vetenskap. (2008) 321:1841–4. doi: 10.1126/vetenskap.1161621
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Från latenta disseminerade celler till öppen metastas: genetisk analys av systemisk bröstcancerprogression. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073/pnas.1331931100
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Effekt av mycket liten tumörstorlek på cancerspecifik dödlighet i nodpositiv bröstcancer. J Clin Oncol. (2012) 23:32–3. doi: 10.1016/j.breastdis.2012.01.026
CrossRef Fulltext / Google Scholar
18. Lp. American joint committee on cancer prognostic factors consensus conference: kolorektal arbetsgrupp. Cancer. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::stöd-CNCR30>3.0.CO;2-T
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumörmarkörer i kolorektal cancer: Europeiska gruppen för tumörmarkörer (EGTM) riktlinjer för klinisk användning. Eur J Cancer. (2007) 43:1348–60. doi: 10.1016/j.ejca.2007.03.021
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
20. Han är en av de mest populära och mest populära. ASCO 2006 uppdatering av rekommendationer för användning av tumörmarkörer i gastrointestinal cancer. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200/JCO.2006.08.2644
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousov CB, Holubec L, et al. Tumörmarkörer i kolorektal cancer, magcancer och gastrointestinala stromala cancer: European group on tumörmarkörer 2014 riktlinjer uppdatering. Int J Cancer. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
22. Han är en av de mest kända. Preoperativt karcinoembryoniskt antigen förutsäger resultat hos nodnegativa koloncancerpatienter: en multivariat analys av 572 patienter. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstrakt / CrossRef fulltext / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Preoperativ karcinoembryonisk antigennivå som en oberoende prognostisk faktor vid potentiellt botande koloncancer. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. Införlivande av serumkarcinoembryoniska antigennivåer i det prognostiska grupperingssystemet för koloncancer. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstrakt / CrossRef fulltext / Google Scholar
25. Han är en av de mest kända och mest kända i världen. C-steg i koloncancer: implikationer av carcinoembryonic antigen biomarkör i staging, prognos och hantering. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093 / jnci / djr078
PubMed Abstrakt / CrossRef fulltext / Google Scholar
26. Han är en av de mest kända och mest kända. Bedömning av det prognostiska värdet av karcinoembryoniska antigennivåer i stadium i och II koloncancer. Eur J Cancer. (2018) 94:1–5. doi: 10.1016/j.ejca.2018.01.112
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, K. Förhöjd preoperativ CEA är förknippad med sämre överlevnad i stadium I-III rektala cancerpatienter. Br J Cancer. (2012) 107:266. doi: 10.1038/bjc.2012.267
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
28. Norton L, Massague J. är cancer en sjukdom med självsåtande? Nat Med. (2006) 12:875–8. doi: 10.1038 | Nm0806-875
PubMed Abstrakt / CrossRef fulltext / Google Scholar
29. J. K. D., Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Effekt av stor tumörstorlek på cancerspecifik dödlighet i nodnegativ bröstcancer. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j. mayocp.2012.07.023
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
30. Vi har ett stort utbud av produkter och tjänster. Steg i rektal cancer: identifiering av högriskpatienter. J Am Coll Surg. (1998) 186: 574-9; diskussion: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstrakt / CrossRef fulltext / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic M, et al. Påverkan av T-och N-steg och behandling på överlevnad och återfall i adjuvant rektalcancer: en poolad analys. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200/JCO.2004.08.173
PubMed Abstrakt / CrossRef Fulltext / Google Scholar