Kloridjonkanaler och transportörer: från nyfikenheter i naturen och källa till mänsklig sjukdom till läkemedelsmål
publicerad: 20 augusti 2013 | |
tidigt i sin grundutbildning introduceras studenten till olika typer av integrerat membranprotein: receptorer, vidhäftningsproteiner, jonkanaler, jonpumpar och jontransportörer. När de fortskrider genom sina studier upptäcker de att diskreta genfamiljer och proteinstrukturer är ansvariga för dessa olika proteinklasser och det finns aldrig någon anledning att överväga att det kan finnas någon tvetydighet i att tilldela något särskilt protein till sin lämpliga proteinklass.
detta uppfyller praktiskt taget alla fall från klassrummet till forskningslabbet tills vi överväger kloridkanaler. Vi vet att de finns, är viktiga och kan göra bra läkemedelsmål inom flera sjukdomsområden, men fram till nyligen har de förblivit något stigmatiserade och omoderna i terapivärlden. Bristen på selektiva ligander har inte hjälpt alls. Det enda undantaget från detta har varit GABA-en receptor som är kopplad till en inneboende kloridkanal som öppnar vid bindning av den hämmande neurotransmittorn GABA. Bensodiazepiner har potentierat denna receptor ända sedan Valium blev tillgängligt på 1960-talet, vilket ger lugnande och antikonvulsiva effekter. Detta introducerar ett viktigt begrepp: det finns flera genfamiljer och olika proteintyper som kan beskrivas som kloridkanaler.
detta står i kontrast till vad vi förstår av katjon-selektiva jonkanaler där det finns liten flexibilitet i proteinstrukturen som kan bilda en pore som är selektiv för kalium, natrium eller kalcium; mångfalden av dessa jonkanaler orsakas av variationerna i proteindomänerna som skiljer sig från poren som påverkar öppnings-stängningsbeteendet. För att vara rättvis verkar det inte finnas många fysiologiska skäl till varför en anjonkanal bör uppvisa kloridselektivitet eftersom det finns liten fysiologisk roll i membrantransporten av andra halider eller små anjoner; någon anjonkanal kommer som standard att vara en kloridkanal ur fysiologisk synvinkel. Å andra sidan spelar kalium -, natrium-och kalciummembranströmmar var och en olika grundläggande roller och selektiv membranpermeabilitet för dessa katjoner är avgörande för cellfunktionen och faktiskt livet självt.
GABA-A-receptorer är medlemmar i CYS-loop pentameric ligand-gated jonkanalfamiljer, som inkluderar flera typer av excitatoriska och hämmande neurotransmitter-gated kanaler. Cystisk fibros transmembranregulator (CFTR) protein är en nukleotidreglerad kloridkanal. Det är medlem i den olika ATP-bindande kassettfamiljen (ABC) och är den enda som inte verkar transportera något substrat över ett membran utan snarare fungerar som en kloridkanal. CLC-familjen av spänningsstyrda kloridkanaler uppstår från en annan distinkt genfamilj och har en allmän struktur unik bland membranproteiner. Denna familj av proteiner har medfört många överraskningar under de senaste 30 åren och medlemmar av denna familj kommer att introduceras här och även hur de kan betraktas som läkemedelsmål.
andra spännande utvecklingar från kloridkanalfältet har uppstått efter molekylär identifiering av proteiner som ligger bakom kalciumaktiverade kloridkanaler (ClCa). Funktionellt har vi känt till deras fysiologiska roller under en tid, men nyligen molekylär identifiering av kanalproteinerna har möjliggjort utveckling av molekylära och farmakologiska verktyg för att sondera och förändra deras aktivitet. Denna översyn fokuserar på den farmakologiska potentialen att rikta ClCa-kanaler och CLC-proteiner; deras funktion och subcellulär lokalisering sammanfattas i Figur 1.
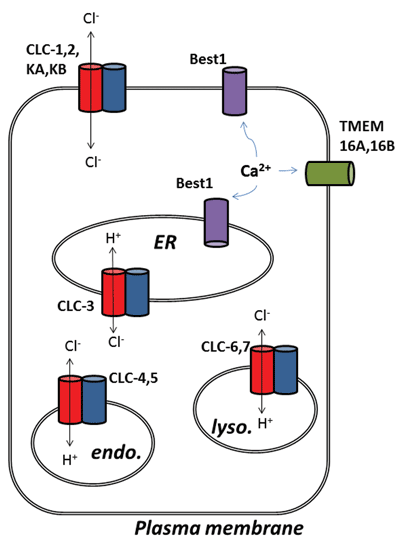
Figur 1
en introduktion till CLC-proteiner
de nio medlemmarna i denna proteinfamilj är CLC-1 till 7, CLC-KA och KB. Grundaren, CLC-1, är den spänningsstyrda kloridkanalen i skelettmuskeln och kommer att diskuteras nedan. Många funktionella studier har utförts på en homolog med hederstiteln CLC-0, isolerad från Elektroplaxelektriska organet, vilket gör det möjligt för strålen att bedöva sina vattenlevande offer. Rekonstitution av CLC – 0 i lipidbilayers och elektrofysiologisk inspelning av strömmar som strömmar genom enstaka jonkanaler avslöjade en spännande egenskap. Vanligtvis, när man registrerar ström från en liten fläck av membran som innehåller en enda jonkanal, observerar man fluktuationer mellan två strömamplituder: en som representerar den slutna kanalen och den andra som representerar strömmen som strömmar genom den öppna kanalen. Fluktuationerna återspeglar övergångar mellan öppna och slutna kinetiska tillstånd. Med CLC-0 var det emellertid uppenbart att singeljonkanalproteinet bestod av två ekvivalenta porer som kunde öppna sig självständigt1. Denna kanal beskrevs därför som dubbelpipig (Figur 2). Det kom således ingen stor överraskning att kristallstrukturerna hos homologer från enteriska bakterier avslöjade att proteinkomplexet var en dimer, med varje subenhet som hade en jonledande väg2 (Figur 2).
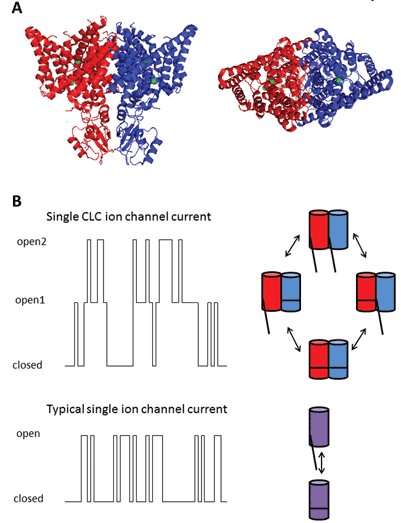
Figur 2
den andra överraskningen uppstod när detaljerade funktionella experiment utfördes på CLC-ec1 från E. coli. I stället för att fungera som en kloridkanal, som dess länge förlorade släkting i ryggradsskeletmuskel, är CLC-ec1 en 2CL-/H+ utbytestransportör, eller antiporter, med strikt 2:1 utbyte stökiometri3. Detta protein är viktigt för överlevnaden av enteriska bakterier i lågt pH4 och kommer sannolikt att utnyttja en kloridgradient för att hålla cellulärt pH på en acceptabel nivå. Prokaryota CLC kan därför vara mål för hämmare för behandling av patogen E. coli eller Salmonellainfektion4. Upptäckten av jonbytesbeteende stimulerade naturligt ytterligare ansträngningar för att avgöra om något av detta klorid-för-protonutbyte fanns i däggdjursklc, med antagandet att Cl–/H+ – utbyte kan vara den verkliga funktionen hos arketypiska CLC och de som identifieras som kloridkanaler kan bara vara undantag från regeln. Detta verkar vara fallet eftersom det finns starka bevis för att CLC-3 till CLC-7 fungerar som 2CL–/H+ utbytestransportörer, främst bosatta i intracellulära organeller, medan CLC-1, CLC-2, KA och KB är sanna plasmamembrankloridledande jonkanaler5-9. Eftersom den arketypiska CLC-egenskapen är utbytestransport, som finns över alla former av cellulärt liv, kan den senare underklassen av proteiner, de bona fide kloridkanalerna, därför betraktas som ‘trasiga’ kloridtransportörer, som har förlorat kopplingen av kloridtransport till rörelsen av en andra substratjon.
CLC-1
denna grundare av CLC-familjen är den spänningsstyrda kloridkanalen i skelettmuskeln och tjänar till att reglera membranpotentialen och repolarisera membranet efter åtgärdspotentialer för att slappna av muskeln. I de flesta vävnader förväntar vi oss att kaliumkanaler spelar denna roll, vilket de gör i hjärt-och glattmuskel, samt reglerar membranexcitabilitet i andra celltyper. Det tvärgående tubulsystemet är en förlängning till plasmamembranet (sarcolemma) och tränger in i den kontraktila vävnaden. Det är avgörande för den snabba spridningen av elektrisk aktivitet genom muskeln och orkestrerar snabb och kontrollerad sammandragning. Kaliumutflöde från muskelcellerna till det begränsade utrymmet i t-tubulen skulle höja den extracellulära kaliumkoncentrationen och kollapsa denna jongradient, vilket skulle leda till långvarig membrandepolarisering. Med kloridkanaler som spelar den dominerande repolariserande rollen förhindras detta. Förlust av funktionsmutationer i CLC-1 leder till myotoni hos människor, getter och möss (för en ny granskning SE10) och kännetecknas av nedsatt muskelavslappning, vilket överensstämmer med förlusten av en repolariserande membranström.
med uttryck begränsat till skelettmuskel kan CLC-1 vara ett attraktivt mål för läkemedel som kontrollerar muskelkontraktion genom att öka eller minska CLC-1-funktionen och därigenom minska eller öka muskel excitabilitet. Föreningar som ökar CLC-1-funktionen kan kunna behandla myotoni, särskilt i fall där de kan kompensera för partiell förlust av kloridkanalaktivitet. Hämning av CLC – 1 kan minska tröskeln för muskelkontraktion och kan vara användbar vid muskelsvaghet eller degenerativa sjukdomar såsom muskeldystrofi.
CLC-2
den inre likriktande kloridkanalen, CLC-2, har något utbredd vävnadsfördelning. Det finns i centrala neuroner där det reglerar neuronal aktivitet11-13. I astrocyter regleras dess subcellulära inriktning mot cellkorsningar genom en interaktion med GlialCAM (MLC1), mutationer i vilka stör denna inriktning och orsakar megalencefalisk leukoencefalopati14. Nya terapeutiska intressen involverar CLC-2-uttryck i tarmslemhinna och lungbronkioler där det spelar en roll i tarm-respektive lungsekretioner. Lubiprostone, ett läkemedel som användes kliniskt för att lindra förstoppning föreslogs att utöva sin effekt genom att aktivera CLC-2, men denna effekt är kontroversiell. Medan denna förening aktiverar CLC-2-kanaler i vissa studier, reglerar den i andra CLC-2-handel och ökar CFTR-funktionen via prostaglandinreceptoraktivering15,16. Det finns emellertid tillräckliga bevis för att ökande luftvägs CLC-2-funktion kan ge en alternativ kloridväg i cystisk fibros17.
CLC-KA/KB
dessa kloridkanaler uttrycks särskilt i njurepitel och bidrar till permeabiliteten hos cellmembran till passivt kloridflöde. De har en nyckelroll i nefronens stigande lem och distala tubuler, vilket ger en basolateral väg för kloridreabsorption, efter transport från den primära urinen via det apikala membranet. CLCKB-genen, som kodar för CLC-KB, är en av fem gener som ligger till grund för Bartters syndrom. Förlust av funktionsmutationer i CLC-KB resulterar i defekt kloridreabsorption och leder så till en saltförtvining, som är associerad med polyuri. En av huvuddragen hos individer som påverkas av CLC-KB-mutationer (Bartters typ III) är lågt blodtryck. En mer allvarlig form av sjukdomen orsakas av mutationer i bsnd-genen (Bartters typ IV), som kodar för Barttin, ett tillbehörsprotein som är viktigt för handel med både CLC-KA och KB till plasmamembranet18. Denna form av störningen inkluderar också sensorisk dövhet, som tros orsakas av förlusten av handel med både CLC-KA och KB till epitelmembran i innerörat. Förmodligen kan förlust av antingen CLC-KA eller KB-aktivitet, men inte båda, tolereras av hörselsystemet. Detta tyder på att hämmare selektiva för antingen CLC-KA eller CLC-KB, eller partiell hämning av båda, kan fungera som ett nytt loopdiuretikum med potential att sänka blodtrycket och med få biverkningar. Detta har lett till studier av deras farmakologi och utveckling av nya inhibitorderivat med låg mikromolär affinitet19, som hade diuretiska effekter när de administrerades till rats20. Å andra sidan kan läkemedel som aktiverar CLC-KB-kanaler förbättra restaktiviteten hos defekta kanaler hos Bartters typ III-patienter.
CLC-7
i underklassen 2CL–/H+ utbytestransportör är CLC-7 ett lovande mål för läkemedelsverkan och dess hämning kan vara fördelaktig vid osteoporos. Återigen har denna indikation sitt ursprung från observationer av mänsklig sjukdom orsakad av funktionsförlustmutationer i CLC-7, vilket orsakar osteropetros21. I denna störning är benremodellering av osteoklaster bristfällig, vilket tros orsakas av defekt syra-och enzymsekretion. Detta leder till tätt ben,vilket om det reproduceras av en CLC-7-hämmare kan minska upplösningen av ben och därmed stärka skelettet hos osteoporospatienter22, 23. I proof-of-concept-studier minskade farmakologisk hämning av försurning24 eller störning av CLC-7-funktionen genom antikroppar25 benresorption. CLC-7-hämning kan dock inte vara utan komplikationer eftersom studier på människa och mus tyder på att brist på CLC-7-funktion också kan associeras med neuronal lagring och degenerationsstörningar på grund av minskad lysosomal funktion26.
förlust av funktion mänskliga mutationer-lektioner från CFTR
det är värt en kort paus vid denna tidpunkt att överväga att några av de terapeutiska indikationerna för nya CLC-riktade läkemedel syftar till att behandla störningar distinkta och i motsatt ände av spektrumet till de som orsakas av defekt CLC-funktion. Förutom de som beskrivits ovan är Dents i-sjukdom en X-länkad njursjukdom som orsakas av förlust av CLC-5-funktion (SE27 för en ny granskning). Alla är sällsynta ärftliga störningar och en stor proteindefekt innebär antingen minskad proteinaktivitet eller handel med målmembranet. Faktum är att många enskilda mutationer orsakar er-retention och brist på proteinmognad. En parallell kunde göras med cystisk fibros, med de flesta av de drabbade individerna som har den er-behållna MACAUF508-mutationen. Nya och stratifierade metoder för behandling av cystisk fibros har varit resultatet av en dubbelkantig attack för att korrigera mutantproteinvikning (CF-korrektorer) och/eller öka aktiviteten hos plasmamembran CFTR-kloridkanaler (CF-potentiatorer). Framgång växer fram med potentiatorklassen28, som är effektiva hos patienter med mutationer som minskar CFTR-aktivitet utan förlust av proteinbiosyntes eller handel (t.ex. G551D), men effektiviteten hos vikningskorrigatorer (som krävs i de flesta fall) återstår att fastställa29. Även om de sjukdomar som är förknippade med förlust av CLC-funktion är alla sällsynta genetiska störningar, kan vi en dag kunna behandla individer med myotoni, Bartters syndrom, Dents sjukdom och osteopetros, liksom cystisk fibros med läkemedel som korrigerar den faktiska orsaken till deras sjukdom.
Kalciumaktiverade kloridkanaler
slutligen kommer det att nämnas kalciumaktiverade kloridkanaler (ClCa), som har tydligt definierade fysiologiska roller i ett antal celltyper, men deras molekylära identifiering drabbades av några falska och stammade startar. Historien handlar om fyra typer av protein: medlemmar av CLCA, Bestrophin, Tweety och tmem16 genfamiljer. I samtliga fall resulterade deras rekombinanta överuttryck i genereringen av membrankloridströmmar som stimuleras genom att höja den intracellulära kalciumkoncentrationen och, i varierande utsträckning, membrandepolarisering. Resan för CLCA kom till ett slut när det visade sig att detta var ett protein som utsöndrades, men också sannolikt uppreglerade membranuttrycket av ClCa-kanaler endogena till expressionssystemet30. Tweety-och Bestrofinproteiner uppvisar inte alla egenskaper hos ClCa-kanaler som studerats i större vävnader, även om Best1 verkar ansvarig för en komponent av ClCa i sensoriska neuroner31 och kan också vara en viktig regulator för kalciumfrisättning från endoplasmatisk retikulum32,33. Tre oberoende studier föreslog TMEM16A (även kallad Ano1) som kandidat för en huvudkomponent, om inte i sin helhet, för en kalciumaktiverad kloridkanal34-36. Många efterföljande studier, underlättade av genereringen av molekylära verktyg, har stött detta. TMEM16A är viktigt för att reglera membran excitabilitet i vaskulär glatt muskulatur, uppregleras i en djurmodell av lunghypertension och tonen kan minskas genom kanalinhibition37,38. I sensoriska neuroner kopplar tmem16a närvaron av inflammatoriska mediatorer till membranhyperexcitabilitet och tmem16a-hämning har antinociceptiva effekter39. I djurmodeller av astma ökas uttrycket av denna speciella kloridkanal och dess hämning kan ha fördelaktiga effekter40. Det finns också i interstitiella celler i tarmens Cajal och kanalfunktionen krävs för den rytmiska sammandragningen av glatt muskulatur i tarmväggen41. Vidare kan tmem16a-aktivering ge en alternativ väg för epitelkloridsekretion i cystisk fibros42. Även om det fortfarande finns en del debatt kring den exakta funktionen hos resten av tmem16-familjen, har ClCa-funktionen också tillskrivits TMEM16B (Ano2), som tros ligga till grund för ClCa-kanalen i olfaktoriska hårceller43,44. Det kan också finnas roller för denna klass av jonkanal i cancercellbiologi och dess hämning kan förhindra cellproliferation45-48.
avslutande anmärkningar
denna översyn har belyst de olika rollerna av kloridledande eller transporterande proteiner och hur deras dysfunktion är kopplad till mänsklig störning eller sjukdomsliknande symtom i djurmodeller. Det finns en allvarlig brist på farmakologiska reagenser som hämmar, aktiverar eller förbättrar membranhandel med kloridkanaler och transportörer. Framsteg görs med läkemedel som reverserar CFTR: s defekta funktion vid cystisk fibros, vilket förhoppningsvis kommer att resultera i mediciner som är specifika för de olika typerna av ärftlig mutation. Hämmare och aktivatorer av tmem16a kalciumaktiverade kloridkanaler42,49 visar sig vara användbara laboratorieverktyg och nya föreningar kan göra effektiva läkemedel, särskilt om de kan leverera vävnadsspecifika effekter. Molekyler som är specifika för vissa CLC är förmodligen de mest svårfångade. Att förstå den strukturella grunden för spänningsstyrd CLC-aktivering50 kan identifiera proteindomäner som är riktade genom rationell strukturbaserad läkemedelsdesign. Sådana verktyg kommer att göra det möjligt för oss att sätta några av de nya terapeutiska ideerna som har granskats och presenterats här på provet.
författare biografi

Dr Jon Lippiat avslutade sin doktorsexamen om kaliumkanalernas struktur, funktion och farmakologi vid University of Leicester. Han studerade pankreatisk beta-cellfunktion och diabetes vid University of Oxford innan han utnämndes till lektor i farmakologi vid University of Leeds. Hans forskning handlar om att belysa de strukturella och fysiologiska egenskaperna hos flera olika typer av jonkanaler och transportörer och deras potentiella inriktning genom nya farmakologiska reagenser.
fråga
fråga 4 2013
relaterade ämnen
kloridkanaler, läkemedelsmål, jonkanaler