Kognat antigenengagemang på parenkymala celler stimulerar CD8+ T-cellproliferation in situ
- Kognat CD8+ T-celler finns i LN och inflammerad vävnad
- CD8 + T-celler expanderar vid inflammationsstället
- Kognat interaktion med holmar främjar expansion
- Kognat interaktion med inhemska leukocyter krävs inte
- Kognat interaktion med parenkymala celler är viktigt
- T-celler prolifererar vid inflammationsstället
- Kognat interaktion med parenkymala celler Driver proliferation
- IL – 2 är viktigare på platsen för inflammation
Kognat CD8+ T-celler finns i LN och inflammerad vävnad
i initiala experiment (Fig. 1) vi etablerade en modell där CD8 T-cellsvar på ett parenkymalt antigen, ovalbumin (ägg), kunde analyseras. OT-i-möss uttrycker en transgen TCR som förmedlar CD8+ T-celligenkänning av OVA257-264-peptid presenterad på MHC-klass i-molekylen H-2kb. CD8 – T-celler berikades från OT-i / CD45.1-möss, CFSE-färgmärkta och adoptivt överförda av IV till B6 (CD45.2+) värdmöss. Adoptivt överförda T-celler kunde särskiljas från värdceller genom CD45.1-färgning (såväl som CD8 och Va2-kedjan i OT-i TCR) medan CFSE-färgämneutspädning användes för att identifiera celler som hade spridit sig (till exempel Fig. 1a, kompletterande Fig. 1). Parenkymalt antigen infördes genom ympning B6.ägg i parenkymala celler under råtta insulinpromotorn, kompletterande Tabell 1) under njurkapseln hos värdmöss som redan hade fått OT-i/CD45.1 T-celler. Alla tre källor (värd, t-cellgivare och ödonator) har en B6-bakgrund och uttrycker därmed H-2kb. Således, även om OVA-antigenuttryck var begränsat till ympade sackiosceller,antog vi att presentation av OVA-cell-härledda ägg av icke-parenkymal APC, såsom DC via korspresentation, skulle krävas för LN-priming och kanske lokala t-cellresponser17, 18.

delade ot-i-celler (livskraftig CD45.1+CD8+Va2+ grind) i dränering av njur-LN och transplantat 3 eller 6 dagar efter mottagandet av ett enda transplantat på 400 B6.oskatova holmar. (a) representativa flödescytometri tomter. Positionen för den odelade ot-i-toppen bestämdes med användning av ‘no antigen’ – kontroll av ett B6-ötransplantat. (b) Totalt antal uppdelade OT-I i njur-LN och transplantat där varje punkt representerar en enskild mus. Samlade data från sju oberoende experiment: n = 8 transplantatmottagare på dag 3 och n=14 transplantatmottagare på dag 6. En dag 6 transplantat förlorades på grund av en flödescytometerfel. Horisontella staplar är medel, P-värden beräknades genom oparat, två-tailed t-test med Welchs korrigering.
CD8 + T-celler expanderar vid inflammationsstället
som förväntat detekterades ett potent OT-I-svar först i njur-LN som dränerar transplantatstället och detta var beroende av närvaron av ägg-antigen (Fig. 1a, b). Vid 3 dagar efter transplantat kunde uppdelad OT-I detekteras i LNs som dränerar B6.ympning av öar (Fig. 1a) och var riklig (Fig. 1B, medelvärde=9,2 kcal 104). Däremot kunde 100 gånger färre uppdelade OT-i-celler detekteras inom B6.grafter av bacill (Fig. 1A, b, medelvärde=6,6 kcal 102). Antalet uppdelade ot-i-celler ökade 300 gånger på transplantatstället från dag 3 till dag 6 (Fig. 1B, medelvärde=6,6 102 102 vid Dag 3 till 2,1 105 105 vid Dag 6, P< 0,0001, oparat två-tailed t-test med Welchs korrigering) medan det inte fanns någon ökning av LN (Fig. 1b). OT – i-svaret i B6.grafter av OT-i kan förklaras av infiltration av OT-i-celler som hade spridit sig i LN. CFSE-profiler var emellertid olika mellan transplantat-och LN-platserna, eftersom OT-i-celler i transplantat var mer uppdelade än de i LN vid Dag 6 (Fig. 1a). Det finns minst två möjliga förklaringar till denna skillnad. Endast celler som hade delat många gånger infiltrerade transplantatet. Alternativt delas cellerna som når transplantatet snabbare, möjligen på grund av överflödet av tillgängligt antigen. Ökningen i absoluta celltal i transplantatet jämfört med LN vid Dag 6 ledde oss att undersöka denna senare förklaring.
Kognat interaktion med holmar främjar expansion
för att bestämma det möjliga bidraget från kognat MHC i transplantatet till lokal expansion använde vi holmar härledda från bm1.mice (kompletterande Tabell 1). I bm1.usci-möss, h–2kbm1-molekylen kan inte presentera OVA257-264-peptiden på grund av tre mutationer till H-2kb (ref. 19). En jämförelse av svar på B6.kambodjova och bm1.okt-i-transplantat visade att trots liknande ot-I-svar i den dränerande njur-ln reducerades expansionen av OT-I sexfaldigt i bm1.i jämförelse med B6.ympning (medelvärde = 4.7 104 104 jämfört med 2,6 105 105 delade ot-I; P = 0,0153 oparade två-tailed t-test med Welchs korrigering; Fig. 2a). Denna mindre effektiva expansion av OT-i-celler som infiltrerar bm1.ympade äggceller föreslog att besläktade interaktioner med ympade öceller bidrog till lokal t-cellutvidgning.

Flödescytometrianalys av OT-i-celler (livskraftig CD45.1+CD8+Va2+ Grind) 6 dagar efter transplantat. (a) totalt uppdelat OT-I i dränerande njur-LN och transplantat efter mottagande av ett enda transplantat på 400 B6.eller bm1.oskatova holmar. Data för B6.ympade möss är en delmängd av den som visas i Fig. 1b. varje punkt representerar en enskild mus. Poolade data från två oberoende experiment visas i varje panel: n=5 mottagare av B6.och n=6 mottagare av bm1.usci-transplantat. Horisontella staplar är medel, P-värden beräknades genom oparat, två-tailed t-test med Welchs korrigering. (b) schematisk av bipolär graftmodell där transplantat på 200 öar placeras vid motsatta poler i samma njure och delar en gemensam dränerande njur-LN. Totalt uppdelat OT-I i (c) B6.uruguayova och KbKO.bipolära transplantat och (d) B6.B6 bipolära transplantat (n = 5 mottagare möss poolade från två oberoende experiment i var och en av c och d) Data för samma mus är förbundna med streckade linjer: p-värden beräknades genom förhållandet parat t-test.
för att eliminera alla bidrag från H-2kbm1 alloantigen vi genererade KbKO.möss som uttrycker ÄGGANTIGEN i betaceller men saknar alloantigen eller H-2kb (kompletterande Tabell 1). Vi använde sedan en bipolär graftmodell för att jämföra svar på B6.uruguayova och KbKO.äggöstransplantat som placeras vid motsatta poler av samma njure i en B6-värdmus så att transplantatinfiltrerande T-celler härleddes från T-celler primerade i samma LN (Fig. 2b). Det fanns 10-100 gånger fler T-celler närvarande i B6.Uruguay än KbKO.grafter av bacill (Fig. 2c). Med hjälp av förhållandet uppdelat OT-i vid motsatta poler i njuren beräknat för enskilda möss härledde vi ett relativt Svarsförhållande (RRR). RRR indikerade att lokal t-cellutvidgning var 26-faldig större när kognat ingrepp med transplantatceller inträffade (RRR=26,4 14,1 i B6.oskatova: KbKO.ympning, p = 0,0025, förhållandet parat t-test, Fig. 2c).
vi jämförde också svaren på bipolär B6.B6 (inga antigen) transplantat (Fig. 2d). Mycket få OT-I kunde detekteras inom B6-transplantat (Fig. 2d) och vi anser att det är troligt att många av dessa cirkulerade OT-i härledda från blodförorening. Således leder icke-specifik inflammation associerad med transplantation av transplantat som saknar antigen inte till effektiv t-cellutvidgning i inflammerad vävnad. Däremot svaret på B6.graferna i ubicova var återigen mycket potenta och mer än 900 gånger större än graferna i B6 (RRR=950 252 252 för B6.B6-transplantat, P< 0,0001, förhållande parat t-test, Fig. 2d).
tillsammans indikerade dessa experiment att CD8-T-cellutvidgning i den inflammerade målvävnaden främjades signifikant genom lokal antigenpresentation. Detta utesluter inte nödvändigtvis andra bidrag till t-cellutvidgning, till exempel genom att korspresentera värd DC i transplantatet. Vi bara aver som kognat interaktion mellan T-celler och öceller resulterar i betydande T-cell expansion.
Kognat interaktion med inhemska leukocyter krävs inte
öar är komplexa kluster av celler som inkluderar sackarosceller, endotelceller och holmar bosatta leukocyter (IRL). Därför försökte vi sedan klargöra vilka öceller som presenterade antigen för att infiltrera T-celler för att driva t-cellutvidgning. Den mest uppenbara kandidaten skulle vara IRL. Dessa CD45 + – celler har olika definierats som DC eller makrofager, co-express CD11c och F4/80, och har visat sig bearbeta och presentera antigens20,21,22,23. Vi undersökte därför givarens IRL: s roll för att driva lokal CD8-T-cellutvidgning. B6.usci-möss korsades till CD11c. DTR.GFP möss för att erhålla CD11c. DTR.GFP.usci-möss vars usci-celler uttrycker ägg och vars CD11c + – celler kan avlägsnas genom difteritoxin (dt) injektion8. Vi testade först av FACS att öar isolerade från CD11c.DTR.GFP-möss behandlade med DT utarmades av CD11c + – celler (Fig. 3a, b). CD11c + IRL i obehandlade kontrollmöss identifierades genom färgning för CD45 och CD11c såväl som deras uttryck av GFP-reportern och var tydligt utarmade av DT-behandling (Fig. 3a, b,P = 0,0002, oparat två-tailed t-test med Welchs korrigering). Vi bekräftade också att CD11c + IRL co-uttryckt F4 / 80 och H-2 Kb MHC klass i (kompletterande Fig. 2a) och följaktligen F4/80+ celler utarmades också från öarna av DT-behandlade möss (kompletterande Fig. 2b). CD11c.DTR.GFP.öar isolerade från obehandlade och DT-behandlade möss ympades vid motsatta poler av samma njure. Delat OT-i-nummer var liknande mellan transplantaten, vilket indikerar att IRL-utarmning inte hade någon effekt på CD8+ T-cellutvidgning vid transplantatstället (Fig. 3c). För att bekräfta att IRL inte var viktigt för lokal CD8 T-cellutvidgning utförde vi en andra uppsättning experiment. KbKO.usci-möss bestrålades och rekonstituerades med antingen kbko eller B6 benmärg (BM) för att generera en källa till usci-öar där H-2kb-uttryck saknades från alla celler eller selektivt återställdes till IRL (Fig. 3d). Jämförelse av sådana öar i den bipolära transplantatmodellen visade liknande nivåer av OT-i-cellutvidgning i båda transplantaten (Fig. 3e). Därför är IRL inte viktiga drivrutiner för lokal CD8 T-cell expansion.

Flödescytometrianalys som visar utarmning av CD11c + IRL i CD11c. DTR.GFP-möss behandlade med DT: (a) representativa tomter som visar gating av CD11c+IRL i holmar från obehandlade kontrollmöss och deras utarmning dagen efter en enda DT-behandling, och (b) uppräkning av CD11c+IRL i obehandlade och DT-behandlade möss. Varje punkt representerar en individuell öberedning som innehåller poolade öar från 1 till 8 möss, n=5 obehandlade öberedningar och 6 dt-behandlade öberedningar poolade från fyra oberoende experiment. P-värde beräknat genom oparat, två-tailed t-test med Welchs korrigering. (c) totalt uppdelat OT-I vid 6 dagar efter bipolärt transplantat av öar erhållna från CD11c.DTR.GFP.usci-möss som inte behandlades eller behandlades med DT (n=6 mottagarmöss samlade från två oberoende experiment). Data för samma mus är anslutna med streckade linjer; P-värden beräknade med förhållandet parat t-test. (D) representativa tomter som visar frånvaro eller närvaro av H-2kb-uttryck på CD11c+IRL av KbKO-möss rekonstituerade med KbKO respektive B6 BM. Pregated på livskraftiga celler. (e) totalt uppdelat OT-I vid 6 dagar efter bipolärt transplantat av öar erhållna från chimaeriska möss (n=3 mottagarmöss från ett enda experiment). Data för samma mus är anslutna med streckade linjer; P-värden beräknade med förhållandet parat t-test.
Kognat interaktion med parenkymala celler är viktigt
B6.RIP-Kb-möss uttrycker transgeniskt H-2kb i cellerna i Cu-celler under kontroll av råttinsulinpromotorn24. Genom att korsa dessa möss till KbKO.vi genererade kbko.- uschikova.möss i vilka h-2kb-uttryck begränsades till celler i kategorin (Tilläggstabell 1). Expression av H – 2kb på cellerna i den bakre cellen bekräftades genom FACS-analys av holmar (Fig. 4a). Vi gated på öhematopoietiska celler (CD45+) och endotelceller (CD31+) och visade att H-2kb inte uttrycktes på dessa celler i någon av KbKO.eller kbko.- uschikova.ukkb-möss jämfört med starkt uttryck i B6-möss (Fig. 4a). De återstående CD45-CD31-cellerna är autofluorescerande positiva och berikade i endokrina celler. FACS analys av holmar från KbKO.- uschikova.ubikb-möss visade h-2kb-uttryck inom den autofluorescerande populationen i den autofluorescerande populationen i celler med samma nivåer som de som ses i B6-öar (Fig. 4a). Jämförelse i den bipolära transplantatmodellen indikerade att expansionen av OT-I var 14 gånger större när kognatantigen uttrycktes på cellerna i Cu (RRR=14,0 4,1 för kbko.- uschikova.kbko.ympning, p = 0,0008, förhållandet parat t-test, Fig. 4b).

(a) flödescytometri tomter (gated på livskraftiga celler) visar selektiv restaurering av H-2kb uttryck på parenkymala celler. Histogram representerar öar från KbKO (skuggad), B6 (streckad) eller KbKO.ukkb (fet) möss. (b) totalt uppdelat OT-I vid 6 dagar efter bipolärt transplantat av KbKO.uruguayova och KbKO. – uschikova.oskkb. holmar (n = 6 mottagarmöss samlade från tre oberoende experiment). Data för samma mus är anslutna med streckade linjer; P-värden beräknade med förhållandet parat t-test.
T-celler prolifererar vid inflammationsstället
våra ovanstående resultat indikerar att det fanns lokal proliferation vid målstället. För att upptäcka aktivt prolifererande celler korsade vi ot-i/CD45.1-möss till FucciRG-möss för att generera FucciRG/OT-i / CD45.1 möss (förkortad FucciOT-I). I sådana möss fluorescerar celler rött (FucciR) under G0/G1 och grönt (FucciG) under S/G2/M-cellcykelfaser25,26. Den gradvisa nedbrytningen och ackumuleringen av FucciR−och FucciG− reportrar under övergången mellan cykelfaser möjliggör ytterligare skillnader: mer intensivt FucciR-uttryck i vilande G0 kontra cykling G1-celler, dubbla negativa FucciR-G-celler i mycket tidigt G1 och svagt dubbla positiva FucciR+G+ – celler i G1/S (refs 26, 27). Vilande FucciOT-i-celler från oympade möss var FucciG− (Fig. 5a, övre panelen, ungrafted). För att undvika störningar i Fucci-färgämnena ersatte vi CFSE med CTV. Hos möss som hade fått B6.ovariova-transplantat, analys av CTV-utspädning indikerade att uppdelad FucciOT-I var närvarande i den dränerande njur-LN och några av dessa var FucciG+ som tyder på aktiv celldelning (Fig. 5a, övre panelen, dränering LN). På transplantatplatsen upptäckte vi FucciOT-I som hade genomgått många divisioner (CTV inte längre detekterbar) och många av dessa var FucciG+ stödjande för pågående proliferation (Fig. 5a, övre panelen, färskt transplantat). Jämförelse av andelen FucciG + – celler inom den uppdelade OT-i-populationen (Fig. 5C) indikerade att pågående proliferation inom färska transplantat (26.8 8.8% fuccig+) överskred det i antingen det dränerande njur-ln (7.3 1.6%, p=0.008, oparat två-tailed t-test med Welchs korrigering) eller icke-dränerande njur-LN (2.1 2.1%, P=0.003, oparat två-tailed t-test med Welchs korrigering). Faktum är att undersökning av både FucciG-och FucciR-uttryck indikerade att de flesta transplantatinfiltrerande OT-I aktivt delade, det vill säga mycket få celler uppvisade högt uttryck av FucciR som var ett kännetecken för vilande celler i ln av ograftade möss (Fig. 5A, nedre paneler). Även om vi antog att denna proliferation på platsen för inflammation genererades in situ, kunde vi inte helt diskontera möjligheten att detta helt enkelt återspeglade den senaste ankomsten av prolifererande celler. För att klargöra detta skördade vi bipolära transplantat av B6.det ena transplantatet analyseras omedelbart efter excision och det andra transplantatet odlas i 1 dag (Fig. 5a). Medan antalet OT-I inte ökade under kulturperioden (Fig. 5b), som förmodligen återspeglar celldöd under suboptimala ex-vivo-förhållanden, fortsatte många FucciG+ OT-i-celler att detekteras (14,2 0,2% 4,2 xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx xnumx 5c). Profilen för det odlade transplantatet, utan möjlig rekrytering för en dag, skulle indikera att det fanns hög de novo-spridning i transplantatet.

(a) schematiska och representativa flödescytometri-tomter (gated på livskraftiga CD45.1+CD8+Va2+ lymfocyter) som visar svar av FucciOT-i-celler i njur-LNs eller bipolär B6.usci-transplantat. LNs och transplantatet från en pol undersöktes omedelbart (färskt vid 6 dagar efter transplantat) medan transplantatet från motsatt Pol odlades i 1 dag före analys. LN från en oympad mus inkluderades för att visa frånvaro av uppdelning och FucciG-uttryck (övre panelen) och övervägande av FucciR-höga celler (nedre panelen) i vilande FucciOT-I. (b) totalt uppdelad FucciOT-I i färska och odlade transplantat. Medelvärde + s. d., n=5, p-värden beräknade med två-tailed förhållande parat t-test. (c) %FucciG+ uppdelad OT-i i färskt icke-dränerande och transplantat dränering renal LN samt färska och odlade transplantat. Medelvärde + s. d., n = 5 med undantag för icke-dränerande LN för vilket n=4 på grund av förlust av en LN under bearbetningen. P-värden beräknades med två-tailed unpaired t-test med Welchs korrigering. Data samlas från två oberoende experiment.
Kognat interaktion med parenkymala celler Driver proliferation
vi utnyttjade nästa FucciOT-i-modellen för att bedöma rollen för en annan potentiell lokal drivkraft för t-cellproliferation i transplantatet, värd-härledd APC såsom inflammatorisk DC. För att eliminera eventuella bidrag från värd APC härledde vi först en kbko-bakgrund. När KbKO-möss avvisade OT – i-celler skapade vi KbKO BM i B6-chimaeras för att använda som värdar; således saknade de hematopoietiska cellerna H-2kb men var tillåtna av OT-i-celler. Dessa chimaeras fick FucciOT – I T-celler och bipolära transplantat av KbKO.ubiskova-öar (saknar h-2kb-uttryck och därmed förmågan att presentera ÄGGANTIGEN) och KbKO.- uschikova.aukykb-öar (både H-2kb och OVA-antigen var begränsade till aukoriceller). Eftersom chimaera saknade H-2kb-positiv APC var det nödvändigt att administrera OVA257-264 peptidbelagda mjältceller för att initiera OT-i-svaret. Framgången för denna priming visades genom CTV-utspädning i FucciOT− i-celler i njur-LN, även om dessa vid skörden var FucciG-och inte verkade vara aktivt delande (0,1 0,0% 0,0% fuccig+, Fig. 6a, d). Mycket få OT-i infiltrerade KbKO.men var tydligt expanderat inom KbKO.- uschikova.ukkb-transplantat(RRR på 61,4 26,6 26,6 för kbko.- uschikova.kbko.tsuksivova, Fig. 6B, P=0,0008, två-tailed förhållande parat t-test). Således, även i frånvaro av kognat antigen på värd APC, var kognat antigen på parenkymala askorbinceller tillräckligt för att driva CD8 T-cellutvidgning vid transplantatstället. De få FucciOT-I T-celler som finns i KbKO.ympning av ympkvistar liknade dem i LN både när det gäller deras ineffektiva progression till den mycket uppdelade fraktionen (Fig. 6a, c, 7,5 0,9% 0,9% högdelat i LN och 19,3 3,3% högdelat i KbKO.och brist på FucciG-uttryck (Fig. 6a, d, 0,1 0,0% i ln och 0,1 0,1% i kbko.det tyder på att Liten ot-i-proliferation inträffade vid transplantatstället i frånvaro av kognat antigen. Däremot OT-I inom KbKO.- uschikova.ukkb-transplantat var övervägande mycket uppdelade (92,3 1,0% i 1,0%, Fig. 6a, c) och några av dessa var FucciG+ och därmed aktivt prolifererande (Fig. 6a, d, 5,0 1,2% (1,2% FucciG+). Därför kunde kognat antigenpresentation av Holmens parenkymala celler i cellerna driva de novo-proliferation av FucciOT-I in situ.

FucciOT – I-svar på transplantat i KbKO BM i B6-värdmöss där värdhematopoietiska celler saknar h-2kb-uttryck. Ympade möss fick peptidbelagda mjältceller på dagen för ympning för att initiera OT-i-priming. (a) representativa flödescytometri-tomter (gated på livskraftiga CD45.1+CD8+Va2+ lymfocyter). Övre panelen visar brist på uppdelning och FucciG uttryck i vilande OT-I i LN av en mus som varken ympades eller primades. Nedre tre paneler visar svar i en bipolär ympad och grundad mus: dränering av njur LN, KbKO.uruguayova och KbKO.- uschikova.ukkb-transplantat. Delade celler i ympade möss delades in i två sektorer med de högt uppdelade cellerna som faller in i den sektor där CTV späddes utöver detektionsgränsen. b) totalt uppdelat FucciOT-I i KbKO.uruguayova och KbKO.- uschikova.ubikb bipolära transplantat, p-värden beräknade med två-tailed förhållande parat t-test. (c) % högdelat och (d) % FucciG+ OT-I vid tömning av njur-LN och transplantat av bipolära ympade möss. P-värden beräknades med två-tailed parat t-test. Resultat för enskilda möss är förbundna med streckade linjer, n = 6 mottagarmöss poolade från två oberoende experiment.
IL – 2 är viktigare på platsen för inflammation
vi visar att IL-2RA-uttryck var viktigare för CD8+ T-cellproliferation och ackumulering inom perifer parenkym (ötransplantat) jämfört med inom platsen för priming vid tömning av LN (Fig. 7a). Dessutom analyserade vi svaret på en andra plats långt ifrån primingplatsen, det vill säga icke-dränerande LN. CTV-märkta CD8 + T-celler från OT-I. IL-2RAKO (IL−2RA-CD45.2+) och OT-i/Ly5.1 (IL-2RA+, CD45.1+CD45.2+) möss överfördes till B6.CD45.1 värdmöss (CD45.1+) Innan du får ett enda transplantat av B6.oskatova holmar. De distinkta CD45-alleliska signaturerna för var och en av de överförda t-cellpopulationerna (i kombination med färgning för CD8 och Va2) gjorde det möjligt för oss att kvantifiera och jämföra förhållandet mellan uppdelad WT:IL-2RAKO OT-I (Fig. 7a, kompletterande Fig. 3). IL-2RA WT överträffade klart IL-2RA KO OT-I på transplantatstället jämfört med antingen dränering (P=0,025, två-tailed parat t-test) eller icke-dränering (P=0,044, två-tailed parat t-test) LN. Detta överensstämmer med ökat beroende av CD8 + T-celler på IL-2 Vid tidpunkten för sekundärt möte med antigen vid inflammationsstället jämfört med under initial priming i dränerings LN.
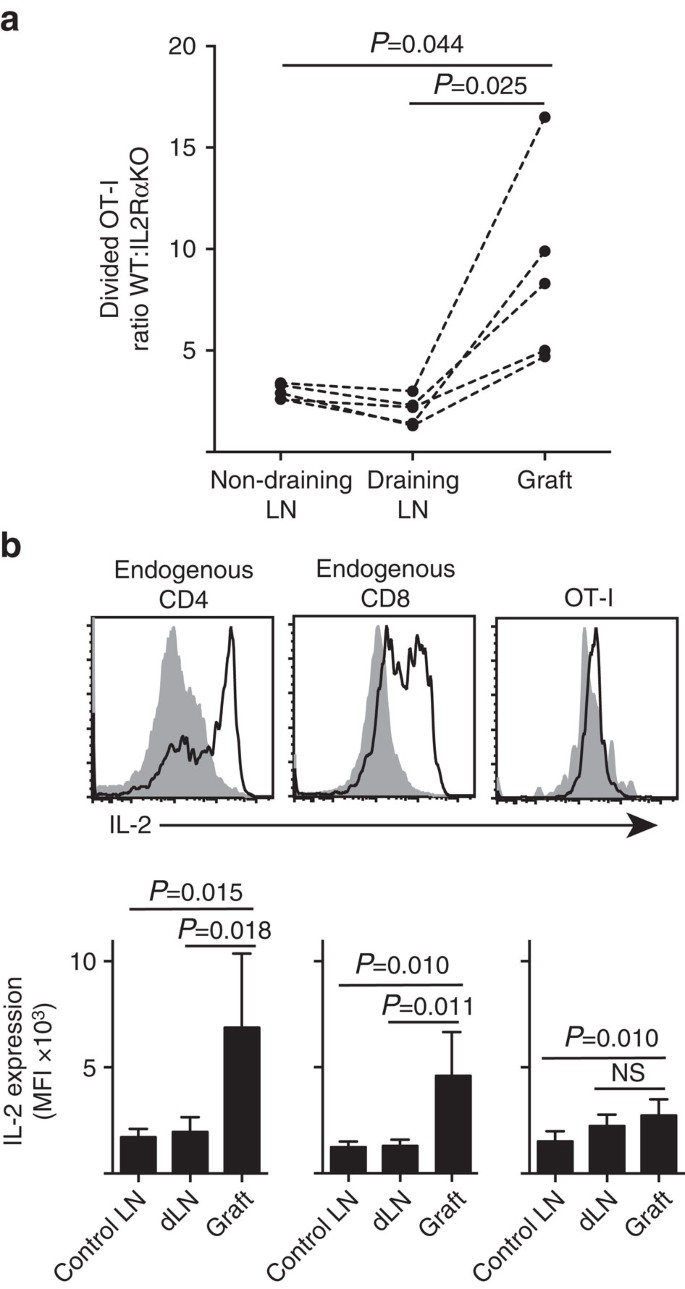
(a) förhållande av uppdelad IL-2RA WT:IL-2RA KO OT-i-celler återhämtade sig från B6.ägglektransplantat, tömning av njur-LN och icke-tömning av inguinal LN efter samöverföring (106 av vardera) till B6.CD45.1 värdmöss. Förhållandena beräknades för enskilda organ med resultat för enskilda möss förbundna med streckade linjer och jämfördes med två-tailed Parade t-test. Resultat visade för N = 5 mottagarmöss och representativ för tre oberoende experiment. (b) IL-2-uttryck i endogena CD4+ – och CD8+ – celler och överförda OT-i-celler i B6-mottagare av B6.oskatova Holme transplantat. Övre paneler visar representativa flödescytometri tomter för transplantat dränering renal ln (fast grå) och transplantat (svart linje). Nedre paneler sammanfattar Genomsnittlig fluorescerande intensitet (MFI) av IL-2-uttryck för njur-ln som tas från oympade (kontroll-LN), såväl som transplantat och dränering av njur-LN (dLN) av ympade möss. Resultat som visas som medelvärde + s. d., n=6 poolade från två oberoende experiment och jämfördes med två-tailed unpaired t-test med Welchs korrigering.
det ökade beroendet av IL-2 för CD8+ T-cellproliferation vid inflammationsstället härledde ett krav på lokal IL-2-produktion. Därför undersökte vi potentialen hos olika T-celler (endogena värd-härledda CD4+ och CD8+ samt överförda OT-i CD8+ T-celler) för förmågan att producera IL-2 (Fig. 7b). Cellsuspensioner framställda från transplantat eller LN restimulerades kort (4 h) med PMA och jonomycin före färgning för uttryck av intracellulär IL-2. Undersökning av endogena värdderiverade CD4 + -och CD8+-T-celler gav övertygande bevis på IL-2-produktion vid platsen för transplantatinflammation med en tydlig ökning av MFI av IL-2-färgning jämfört med antingen dränering eller icke-dränering LN. IL-2-nivåer i OT-i CD8+ T-celler vid inflammationsstället ökades måttligt över de i den icke-dränerande LN, men skilde sig inte signifikant från de i den dränerande LN. En tolkning av dessa data är att kognat interaktion av OT-i med parenkymala celler inducerar snabb proliferation men dålig IL-2-produktion, så att OT-I är beroende av parakrin IL-2 härledd från endogena CD4+ och CD8+ T-celler i den lokala transplantatmiljön. Ett ytterligare experiment indikerade emellertid att exogen IL-2 i frånvaro av parenkymalt antigen inte kunde driva ot-I CD8+ cellutvidgning. IL-2 (rekombinant hIL-2, 25 000 IE) administrerades intraperitonealt till B6-möss som fick bipolära transplantat av B6.och B6 öar. Jämförelse av OT-i-återhämtning i organ som återvunnits från IL – 2 eller vehikelbehandlade möss vid Dag 6 efter ympning visade ingen signifikant ökning av ackumulering av uppdelade OT-i-celler på två ställen som saknar parenkymalt antigen, nämligen B6-holmtransplantat (3 kg 3 i vehikelbehandlat jämfört med 49 kg 64 i IL-2-behandlade möss, P=0.342) och icke-dränerande inguinal LN (1 648+633 i vehikelbehandlat jämfört med 1 660+1 023 i IL-2-behandlade möss, P=0,987, medelvärde av sackaros s.d., n=3, två-tailed oparat t-test med Welchs korrigering).