prognostiskt värde av tumörstorlek i steg II och III kolorektal cancer i Tunisisk befolkning
-
tumörstorlek (TuS) rapporterades vara prognostisk vid kolorektal cancer.
-
i vår studie studerade vi tus: s prognostiska roll och identifierade ett cutoff-värde med högsta förutsägelsesprestanda.
-
en storlek på 4 cm hade en prognostisk inverkan och störde andra prognostiska faktorer.
-
vi observerade att åldern 65 år, steg III, venös invasion och pN+ större än 3 var signifikanta dåliga prognostiska faktorer hos patienter med tus 4 men endast steg III var en oberoende prognostisk faktor i multivariat analys.
-
administrering av kemoterapi var den enda faktorn med signifikant inverkan på överlevnad i univariata och multivariata analyser hos patienter med TuS mindre än 4 cm.
kolorektal cancer (CRC) är den tredje vanligaste cancer världen över och den näst vanligaste orsaken till cancerrelaterad död i västländer . I Tunisien utgör det ett folkhälsoproblem. Dess förekomst ökade under de senaste 15 åren . Trots förbättringen av diagnostiska och upparbetningsprocedurer och även på grund av bristen på screeningprogram, förblir de flesta CRC–fallen i Tunisien upptäckta i ett lokalt avancerat (pT3-T4, nodpositivt) eller metastatiskt Stadium . Prognosen har förbättrats under de senaste åren, med tvärvetenskaplig ledning; 5-års total överlevnad (OS) uppskattas till cirka 70% i steg II och 50% steg III . Många ansträngningar har gjorts för att förfina riskbedömningsfaktorerna i CRC för att identifiera patienter som mest sannolikt kommer att dra nytta av adjuvant terapi. Dessa faktorer är huvudsakligen kliniska, patologiska och nyligen molekylära (mikrosatellitinstabilitet/mikrosatellitstabilitet, cDNA), några av dem är fortfarande utom räckhåll i många länder. Tumörstorlek (TuS) är en surrogatmarkör för överlevnad i många gastrointestinala cancerformer: magcancer, gastrointestinal stromal tumör, karcinoidtumörer . Dess relevans i CRC är oklar, med motstridiga resultat i flera rapporterade serier . TuS integrerade inte internationella riktlinjer som en av markörerna att överväga vid bedömning av risk och indikering av adjuvant kemoterapi . I en nyligen genomförd studie med patologisk bedömning av 1443 nya fall av CRC i den centrala regionen Tunisien hade 67,5% av patienterna en TuS större än 5 cm, detta resultat skiljer sig helt från fall i västländer . I vår nuvarande studie syftade vi till att studera tus: s prestanda för att förutsäga överlevnad i steg II och III CRC och att undersöka förhållandet mellan TuS och kända prognostiska faktorer.
patienter & metoder
vi granskade retroaktivt en kohort av 257 patienter diagnostiserade med kolon och/eller rektal adenokarcinom, behandlade i två onkologiska centra: Abderrahmen Mami Hospital och Clinique Taoufik Hospital mellan 2003 och 2014. Vi inkluderade steg II-III fall, enligt American Joint Committee on Cancer (AJCC)/Union Internationale Contre le Cancer (UICC) 7: e upplagan, behandlad med botande avsikt. Vi betraktade endast patienter med fullständig upparbetning och tillgängliga patologidata inklusive TuS och uppföljningsdata. Under studietiden programmerades uppföljning efter avslutad botande terapi, var 3-4 månader under de första 2 åren, var 6: e månad från år 3 till 5 och årligen därefter. Vid varje besök hade patienterna fysisk undersökning och kontrollerades för symtom och terapitoxicitet. Abdominal ultraljud och röntgen i bröstet utfördes var 6: e månad, från och med 2012 thoracoabdominal CT-skanning och tumörmarkörer (carcinoembryonic antigen, CA19–9) var 6: e månad gjordes.
TuS definierades som den horisontella tumörförlängningen mätt med maximal tumördiameter. Vi använde mottagaroperationskarakteristik (ROC) för att bestämma TuS-prestanda för att förutsäga överlevnad och för att identifiera ett cutoff-värde som är korrelerat med överlevnad. Vi jämförde också egenskaperna hos de två grupperna enligt cutoff-värdet och undersökte prognostiska faktorer i univariata och multivariata analyser i varje grupp.
statistisk analys
alla analyser utfördes med hjälp av SPSS 20-programvara. Vi analyserade ROC-kurvor och analyserade området under kurvan (AUC) för att bestämma noggrannheten hos TuS för att förutsäga överlevnad. En AUC på 1, 0 var felfri förutsägelse av cancer hos patienter, medan en AUC på 0, 50 representerar en halv Sannolikhet för en exakt förutsägelse av cancerstatus. Ju högre AUC-ROC, desto större är den diskriminerande kraften hos TuS för resultatet. OS definierades som tiden från diagnosdatum till döds av någon orsak eller förlust till uppföljning eller senaste nyheter. OS utvärderades enligt Kaplan-Meier-metoden. Prognostiska faktorer bedömdes genom en univariat analys med log-rank-testet och med en multivariat analys med hjälp av en Cox proportionell riskmodell. Ett p-värde mindre än 0,05 ansågs statistiskt signifikant.
resultat
för den totala befolkningen var medelåldern 59 år gammal (intervall 25-85 år), 57.2% var män. Vi observerade en stadium III-sjukdom hos 53% av patienterna bland dem 37,5% var pN2. Adjuvant kemoterapi gavs alla patienter med stadium III-sjukdom (97, 7% innehållande oxaliplatin). I stadium II-sjukdom fick 53% av fallen kemoterapi, de var PT4-steg i 22,5%, mindre än 12 borttagna lymfkörtlar i 28% och hade akutoperation i 15% av fallen. Medelvärdet var 7 cm .
i Roc-analys visades AUC för TuS för att förutsäga överlevnad i Figur 1. TuS-prestanda för att förutsäga överlevnad jämfördes med prestanda med antalet involverade lymfkörtlar. AUC är 0.62 0,048 för tus och 0,60 0,56 för positiva lymfkörtlar.

en storlek på 4 cm identifierades som en prediktor för överlevnad med en känslighet på 88, 2% och en specificitet på 59, 2%. Vi observerade 98 patienter med tus 4 cm och 159 patienter med tus större än 4 cm. Patienter med TuS större än 4 cm var mer benägna att ha en cancer i tjocktarmen (81,1 mot 70,4%, p = 0,002) och vanligtvis pT4 (44 mot 22.4%, p = 0,0001). Vi observerade inte en signifikant skillnad beroende på kön, akutoperation, mindre än 12 borttagna lymfkörtlar, antal positiva lymfkörtlar, Stadium och oxaliplatinadministration mellan patienter tus 4 cm och patienter med TuS större än 4 cm (tabell 1).
| variabler | tumörstorlek 4 cm, % (n = 89) | tumörstorlek > 4 cm, % (n = 159) | p-värde |
|---|---|---|---|
| ålder: | |||
| – Median (medel) ålder | 56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| kön: | |||
| – man | 50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| plats: | |||
| – kolon | 70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| kirurgisk nödsituation: | |||
| – Ja – Nej |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 lymfkörtlar undersökta§: | |||
| – Ja – Nej |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR (månader) | 26 | 34 | 0.13 |
†finns endast hos 168 patienter.
‡dags att återfalla.
§i båda etapperna II och III.
*betydande p-värden.
Reproducerad med tillstånd från brasilian Oxford University Press (2017).
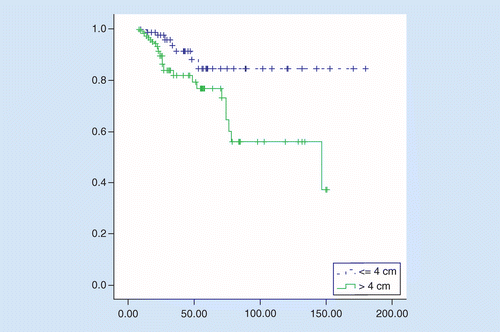
OS var signifikant bättre i tus 2 cm, jämfört med tus större än 4 cm, genomsnittlig överlevnad var 158 mot 106 månader, hazard ratio = 2.92 (95% ki: 1,27–6,75, p = 0,01). 5-års överlevnadsgrad hos patienter var 84% hos patienter med tus 2 cm och 76% hos patienter med TuS större än 4 cm (p = 0,008; se Figur 2).
prognostiska faktorer undersöktes i båda grupperna. I univariat analys observerade vi en signifikant dålig inverkan av åldern 65 år, steg III, venös invasion och pN+ större än 3 på överlevnad hos patienter med TuS större än 4 cm. Endast i multivariat analys var Steg III en oberoende prognostisk faktor. Hos patienter med tus 4 cm, var kemoterapi i adjuvansinställningen de viktigaste faktorerna med signifikant inverkan på överlevnad i univariata och multivariata analyser, det fanns ingen prognostisk effekt av de andra testade faktorerna (Tabell 2).
| variabler | tumörstorlek < 4 cm (n = 159) | tumörstorlek 4 cm (n = 89) | ||
|---|---|---|---|---|
| 5-år OS (%) | timme (95% ki) | 5-år OS (%) | timme (95% ki) | |
| ålder: | ||||
| – <65 år | 87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
*betydande HR-värden.
HR: Hazard ratio; OS: total överlevnad.
diskussion
numera, i västländer, integration av ockult-screeningprogram ledde till diagnos av CRC i tidigare stadier . I en nyligen databaserad studie mellan 2006 och 2012 diagnostiserades 38% av fall av tjocktarmscancer och 43% av fall av rektumcancer i ett tidigt skede . I länder med låg medelinkomst är ett sådant screeningprogram inte tillgängligt; och de flesta fall diagnostiseras på ett regionalt eller avancerat stadium med höga TuS . Identifiering av prognostiska faktorer är ett viktigt verktyg för att förbättra resultatet i sådana länder. Vår studie undersökte ts: s prognostiska roll i steg II och III CRC i Tunisisk befolkning. Vi observerade att TuS inte bara hade en inverkan på överlevnad utan också störde andra prognostiska faktorer. Steg III var en oberoende prognostisk faktor i tumörer med hög volym, medan många ‘klassiska’ prognostiska faktorer inte hade någon inverkan på mindre tumörer. Flera studier rapporterade det prognostiska värdet av TuS med minskad överlevnadsassocierad ökad TuS . I en studie av Kornprat et al., TuS var signifikant associerad med progressionsfri och cancerspecifik överlevnad i univariata och multivariata analyser i kolon, men inte i rektumcancer . I vår serie, högre TuS var vanligare i koloncancer plats. Faktum är att koloncancer kan vara asymptomatisk under en längre tid, vilket förklarar högre TuS vid diagnos jämfört med rektalcancer. Det fanns emellertid ingen skillnad i överlevnad mellan tumörer 6 cm i kolon och tumörer 4 cm i rektum. Det fanns inte heller någon inverkan av tumörplats i mindre tumör (<4 cm). Så baserat på denna analys hade TuS inte en roll för att förutsäga prognos baserat på tumörplats (kolon vs rektum). Saha et al. rapporterade i deras stora serie patienter att TuS är positivt korrelerat med viktiga prognostiska faktorer och negativt påverkat överlevnaden i koloncancer . Dess roll i rektumcancer är fortfarande inte klar.
högre TuS var också associerad med pT4–scenen, rapporterades ha sämst prognos än T1-2N1-scenen (Intergroup trial INT-0089) . Tumörbördan kan återspegla en tumörs förmåga att sprida sig genom tarmväggen, noder och andra organ. I vår studie hade TuS faktiskt ett prediktivt ROC-analysvärde nära det prediktiva värdet av antalet positiva lymf. I tumörer mindre än 4 cm observerade vi inte en skillnad i överlevnad mellan steg II och III-patienter. Detta resultat kan förklaras av det faktum att vår stadium II-befolkning var en högriskpopulation med sämre prognos (nära stadium III-prognos): många steg pT4, många fall med mindre än 12 borttagna lymfkörtlar, många fall som drivs i nödsituationer (för perforering och obstruktion). I två SEER-databaserade studier hade mindre tumörer sämre prognos som är stadium II-sjukdom. Författarna antog att små TuS kan vara en surrogatmarkör för biologisk aggressivitet vilket resulterar i sämre resultat jämfört med relativt större TuS bland steg II . Samma observationer sågs i en italiensk studie . Vi undersökte också rollen för flera prognostiska faktorer enligt TuS. Vi observerade att flera prognostiska faktorer som ålder, Stadium, antal involverade lymfkörtlar, tumörplats inte hade någon signifikant inverkan i gruppen patienter med låg TuS. I vår studie hade adjuvant kemoterapi positiv inverkan i små tumörer, bör TuS betraktas som en högriskfaktor i steg II? Ytterligare studier som fokuserar på denna speciella fråga behövs.
flera fallgropar kan noteras i vår serie: den lilla provstorleken, retrospektiv insamling av data och frånvaron av central granskning av patologirapport för en exakt TS-utvärdering. Vi hade inte tillräckligt med tillgängliga data om exakt tumörplats, så vi kunde inte utföra sådan analys. Molekylär testning introducerades i Tunisien 2015, under vår studieperiod var den inte tillgänglig. Utvärdering av TuS enligt Stadium och administrering av oxaliplatin gjordes inte, för för litet antal patienter att dra slutsatser.
slutsats
TuS är en objektiv parameter som lätt kan mätas under patologiundersökning. Det kan representera en ytterligare prognostisk faktor i en befolkning med hög grad av lokalt avancerat stadium.
framtida perspektiv
flera och komplexa genetiska aletraions och/eller vägar, kan ligga bakom TuS i kolorektal cancer, molekylär analys med hänsyn till tumörens storlek kan leda till mer exakta explantationer i sin prognostiska rollen.
finansiell & konkurrerande intressen disclosure
författarna har inga relevanta anknytningar eller ekonomiskt engagemang med någon organisation eller enhet med ett ekonomiskt intresse i eller ekonomisk konflikt med ämnet eller material som diskuteras i manuskriptet. Detta inkluderar anställning, konsultföretag, honoraria, aktieägande eller optioner, expertutlåtanden, bidrag eller patent mottagna eller pågående, eller royalties.
ingen skrivhjälp användes i produktionen av detta manuskript.
etiskt uppförande av forskning
författarna uppger att de har erhållit lämpligt institutionellt granskningsnämndsgodkännande eller har följt principerna i Helsingforsdeklarationen för alla experimentella undersökningar av människor eller djur. För undersökningar som involverar människor har informerat samtycke erhållits från de inblandade deltagarna.
- 1 Torre LA, Bray F, Siegel RL et al. Global cancerstatistik, 2012. CA. Cancer J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Kolorektal cancer i Centrala Tunisien: ökande incidenstrender under en 15-årsperiod. Asiatiska Pac. J. Cancer Föregående. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Trender i förekomsten av cancer i Sousse-regionen, Tunisien, 1993-2006. Int. J. Cancer 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 Yang J, Du XL, Li ST et al. Egenskaper hos olika lokaliserade kolorektala cancer stöder proximal och distal klassificering: en populationsbaserad studie av 57 847 patienter. PLoS EN 11 (12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang H et al. Effekten av tumörstorlek på överlevnad hos patienter med pt4an0m0 magcancer. Är. Surg. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. påverkan av tumörstorlek på prognosen hos patienter med koloncancer. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Mindre tumörstorlek är förknippad med dålig överlevnad i stadium II koloncancer: en analys av 7719 patienter i Seer-databasen. Int. J. Surg. Lond. Engl. 33 (Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier JE, McMillan DC, McArdle CS et al. Tumörstorlek är associerad med det systemiska inflammatoriska svaret men inte överlevnad hos patienter med primär opererbar kolorektal cancer. J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta GD et al. Tidig koloncancer: ESMO riktlinjer för klinisk praxis för diagnos, behandling och uppföljning. Ann. Oncol. 24 (Suppl. 6), VI64–VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, kyrka TR, Bond JH et al. Effekten av fekal ockult-blod screening på förekomsten av kolorektal cancer. N. Engl. J. Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Kolorektal cancerstatistik, 2017. CA Cancer J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer a, Rehak P, Langner C. värde av tumörstorlek som en prognostisk variabel i kolorektal cancer: en kritisk omprövning. Är. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. Tumörstorlek förutsäger långsiktig överlevnad i koloncancer: en analys av National Cancer Data Base. Är. J. Surg. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon AL et al. Koloncanceröverlevnad är förknippad med ökande antal analyserade lymfkörtlar: en sekundär undersökning av Intergruppsstudie INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Ogynnsam effekt av liten tumörstorlek på orsaksspecifik överlevnad i stadium IIA koloncancer, en SEER-baserad studie. Int. J. Kolorektal Dis. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi A, Cananzi FCM et al. Tumörstorlek som en prognostisk faktor hos patienter med stadium IIa koloncancer. Är. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar