syror, baser och pH
|
|||||||||
syror och deras konjugatbaser
kom ihåg Bronsted–Lowry-definitionen av en syra: en syra är en protondonator. Det är uppenbart att ättiksyra i vårt tidigare exempel donerar sin proton till H2O i framreaktionen, vilket resulterar i bildandet av acetatjonen. I den omvända reaktionen accepterar acetatjonen emellertid en proton från H3O+ för att återgå till CH3COOH. Från Bronsted-Lowry-definitionen är en bas en protonacceptor.
|
således fungerar acetatjonen som en bas i den omvända reaktionen och är kallas konjugatbasen av ättiksyra. Ättiksyra och acetatjonen är kända som ett syrabas–konjugatpar. Intressant nog finns det ett andra syrabas–konjugatpar i reaktionen ovan. Lägg märke till hur H3O+ i omvänd reaktion donerar en proton (gör den till en syra), medan H2o i den främre reaktionen accepterar en proton (gör den till en bas). H2O och H3O+ är ett konjugat syra–baspar, med H3O+ är konjugatsyran och H2O är konjugatbasen.
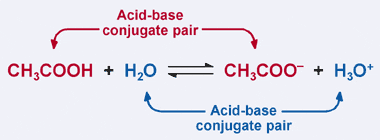
i ett konjugatsyra-baspar har konjugatsyran ytterligare en proton än dess motsvarande konjugatbas.